Сердце больного МС находится под «прессингом» взаимоусугубляющих нарушений утилизации глюкозы с развитием «энергетического голодания» клеток – вследствие первично присутствующей инсулинорезистентности и вторичных нарушений, связанных с нарушениями в липидном и углеводном обменах. Непосредственные причинные изменения при данном синдроме, развивающиеся в стенке артерий и сердца, остаются до настоящего времени полностью не изученными. Поэтому, представляют интерес экспериментальные модели МС, позволяющие проследить развитие заболевания в динамике и изучить эффективность применяемой фармакотерапии на гистологическом уровне.
Одним из фармакологических путей решения этой проблемы явилось применение отечественного биопрепарата – кардиоспаса, имеющего достаточно убедительную доказательную базу в числе антигипоксантов и антиоксидантов, как в экспериментальной так и в клинической терапии [1,2,4-6] . В составе этого препарата, получаемого при обработке коры молодых веток дуба, содержится сумма проантоцианидинов – регуляторных полимерных флавоноидов с различной степенью полимеризации и молекулярной массой 1500:10000 УЕ (средняя молекулярная масса 8278 УЕ). Анализируя вышеизложенное, целью исследования стало выявить влияние кардиоспаса в режиме экспериментального исследования на морфологические изменения в стенке сердца после моделирования МС.
Материал и методы
Эксперименты были проведены на 12 кроликах - самцах, массой от 1600 до 2100 г. Модель МС была воспроизведена согласно рекомендациям Каримова Х.Я и соавт. (2006) [3]. На фоне дальнейшего моделирования МС проводили экспериментальную терапию. В основную группу были отобраны 6 кроликов, которым вводили кардиоспас, растворенный в дистилированной воде, перорально в дозе 50 мг/кг массы тела, ежедневно, в течение 30 дней. Остальные 6 кроликов составили группу сравнения. Забои животных, находивщихся под эфирным наркозом, проводились путем декапитации через месяц экспериментальной терапии. Материалом для гистологического исследования были кусочки сердечной мышцы и аорта кроликов.
Гистологические срезы, полученные на санном микротоме после депарафинизации окрашивали гематоксилином-эозином, коллагеновые волокна выявляли по Ван-Гизон, углеводы по ШИК реакции, эластические волокна определяли по Вейгерту, ретикулярные волокна – по Футу.
Результаты и их обсуждение
У кроликов с МС патоморфологические изменения в виде дистрофических, деструктивных, воспалительных и дисрегенераторных поражений были развиты как в эндокарде, так и миокарде сердца. При этом морфологически отмечалось развитие в эндокарде сердца выраженного отека, мукоидного и фибриноидного набухания, что проявилось метахромазией в виде миксаматоза волокнистых структур.
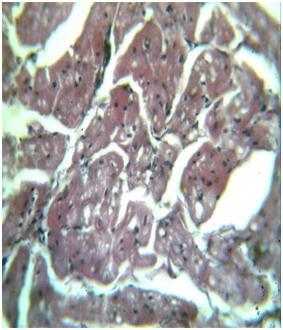
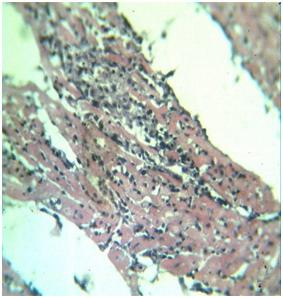
Дисциркуляторные, отечные и дистрофические изменения, развились и в миокарде, имея при этом диффузный характер. Микроскопически во всех отделах миокарда отмечалось полнокровие сосудов, отек и разрыхление интерстициальной соединительной ткани. Характерным морфологическим изменением для МС явилось развитие в КМц паренхиматозной жировой дистрофии, которая проявилась в виде появления в саркоплазме КМц разнообразных липидогенных вакуолярных структур (рис. 1). Данная жировая дистрофия местами в миокарде осложнилась липидогенным миолизом КМц. При этом ядра КМц были подвергнуты дистрофическим и дисрегенераторным изменениям в виде вакуолизации кариоплазмы или деформирующей гиперхромазии хроматина. В интерстиции некоторые гистиоцитарные клетки были гипертрофированными и вокруг них скопилось определенное количество лимфо-гистиоцитраных клеток. Нами было также отмечено, что в отдельных участках миокарда, особенно в стенках предсердия появились очаги метаболического некроза КМц и пролиферация вокруг очага некроза лимфо-гистиоцитарных клеток в виде пролиферативного инфильтрата (рис.3).
 |
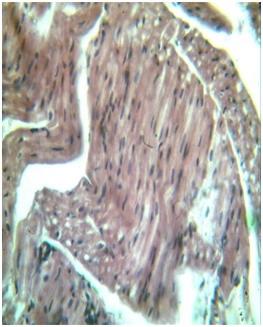 |
| Рис. 1. МС. Сердце, в миокарде разнокапельная паренхиматозная жировая дистрофия. Окраска: гематоксилин-эозин. Ув: ок.10, об.40. | Рис. 2. Лечение кардиоспасом. Сердце, уменьшение объема паренхиматозной жировой дистрофии в миокарде. Окраска: гематоксилин-эозин. Ув: ок.10, об.40. |
После лечения МС кардиоспасом, в сердце кроликов отмечалось уменьшение объема патоморфологических изменений в виде дистрофических, деструктивных, воспалительных и дисрегенераторных поражений как в эндокарде, так и миокарде сердца. Под действием препарата, происходит антиоксидантная стабилизация метаболизма как белкового, так и липидного обмена. За счет этого, происходит нормализация процессов перераспределения кислых гликозамингликанов, гидрофильности и проницаемости волокнистых структур, вследствие этого, исчезает отек и разрыхление волокнистых структур.
Под действием фармакотерапии кардиоспасом стабилизировались дисциркуляторные, отечные и дистрофические явления в эндокарде и миокарде сердца, характерные для МС. Микроскопически во всех отделах миокарда отмечалось умеренное полнокровие сосудов, незначительный отек интерстициальной соединительной ткани. Выше было указано, что характерным морфологическим изменением для МС явилось развитие в КМц паренхиматозной жировой дистрофии, которая при лечении кардиоспасом несколько уменьшилась и морфологически в КМц исчезли липидные вакуоли. Лишь небольшая мелкокапельная жировая дистрофия определялась в стенке предсердий (рис. 2). В интерстиции миокарда отмечалось умеренное скопление лимфо-гистиоцитарных клеток. Кроме того, не было отмечено наличие очагов метаболического миолиза и некроза КМц (рис. 4).
 |
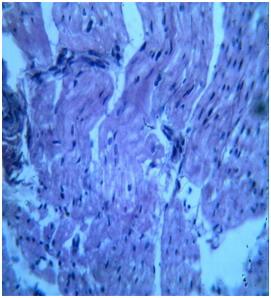 |
| Рис. 3. МС. Сердце, очаги метаболического некроза и пролиферативного инфильтрата в стенке предсердия. Окраска: гематоксилин-эозин. Ув: ок.10, об.40. | Рис.4. Лечение кардиоспасом. Сердце, умеренная гипертрофия гистиоцитарных клеток интерстиции миокарда. Окраска: гематоксилин-эозин. Ув: ок.10, об.40. |
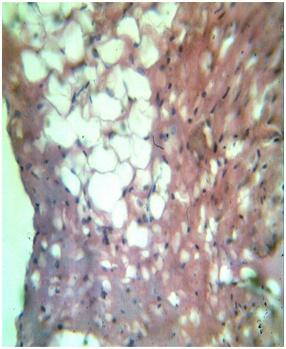
У кроликов с МС со стороны эпикарда сердца отмечалось выраженное увеличение количества жировой клетчатки, прорастание её в толщу миокарда. Особенно это явление было более выражено в стенках предсердий. Первоначально в составе имеющейся жировой ткани увеличилось количество жировых клеток, затем происходила метаплазия окружающей соединительной ткани в жировую и отмечалось прорастание в окружающие ткани. В миокарде при этом отмечалось расширение интерстициальной соединительной ткани и замещение её жировыми клетками. В данных зонах липоматоза отмечалась определённая атрофия КМц и развитие очаговой паренхиматозной жировой дистрофии КМц (рис. 5).
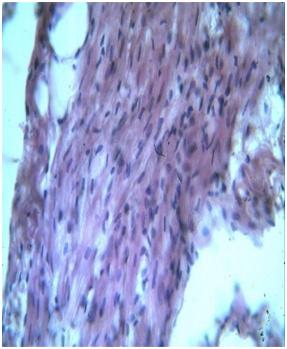
У животных основной группы со стороны эпикарда, уменьшился объем ожирения сердца, или морфологически под эпикардом уменьшилось количество жировых клеток и не отмечалось прорастания жира в миокард (рис. 6).
 |
 |
| Рис. 5. МС. Сердце, прорастание жировых клеток в миокард, атрофия и паренхиматозная жировая дистрофия кардиомиоцитов. Окраска: гематоксилин-эозин. Ув: ок.10, об.40. |
Рис. 6. Лечение кардиоспасом. Сердце, единичные жировые клетки под эпикардом. Окраска: гематоксилин-эозин. Ув: ок.10, об.40. |
Таким образом, проведенное исследование показало наличие значительных изменений в миокарде в рамках метаболического синдрома, прежде всего строма-сосудистых белковых дезорганизационных явлений, возможно, связанных с дисбалансом между резко возросшими потребностями в кислороде и субстратах метаболизма КМц и сниженным уровнем кровоснабжения. К тому же отмеченная выраженная жировая инфильтрация интерстиция миокарда при МС также затрудняет диффузию кислорода и субстратов из немногочисленных капилляров в рабочие клетки миокарда, что способствует нарушению трофики КМц, повреждению обменных процессов и в конечном итоге ведет к быстрому прогрессированию патологического процесса. Уменьшение паренхиматозной жировой дистрофии после фармакотерапии кардиоспасом возможно опосредованно связано со снижением синдрома липотоксичности и объясняется выраженными антиоксидантными его свойствами [2], кроме того снижение дистрофических и дисциркуляторных процессов может быть обусловлено доказанной способность кардиоспаса снижать процессы деградации NO [3], соответственно предотвращать развитие эндотелиальной дисфункции и приводить к улучшению коронарного кровотока. Гиполипидемическое свойство кардиоспаса [6] приводит к снижению накопления триглицеридов и жирных кислот в мышечных клетках, нарушающих сократительную функцию миофибрилл, возможно этим и обусловлено снижение деструктивных процессов. Мы предпологаем, что отсутствие очагов некроза и миолиза КМц после фармакотерапии, вероятно связано с улучшением процессов окислительного фосфорилирования в митохондриях клеток, с повышением связывания и захвата Са2+, снижением перекисного окисления липидов и накопления их продуктов в миокарде.
Исчезновение патоморфологических изменений возникших при МС в стенке сердца, позволяет констатировать выраженные органопротективные свойства кардиоспаса.
Выводы
- МС характеризуется поражением эндокарда и миокарда, носящий диффузный характер, в основном это проявляется миолизом, полиморфно-ядерной инфильтрацией, дистрофией и сосудистыми изменениями, отложением в них липидов.
- Фармакотерапия МС кардиоспасом существенно снижает дистрофические, дисциркуляторные изменения, уменьшает отложения жировых включений, лимфоцитарно-макрофагальной инфильтрации и миолиза. Полученные результаты указывают на целесообразность включения кардиоспаса в комплекс лечения сердечно-сосудистых осложнений у больных с МС.
