Введение. Для полного понимания функционирования центральной нервной системы необходимо в совершенстве изучить её морфологическое строение. Несмотря на многочисленные публикации в научной литературе [1-3, 5], проблема микроскопического строения коры больших полушарий сохраняет до настоящего времени актуальность, как в практической медицине, так и в теоретических исследованиях.
Целью исследования явилось изучение клеточного состава слоев переднетеменной зоны коры головного мозга половозрелых крыс-самцов.
Материалы и методы исследования. Исследования проводились на 20 белых беспородных половозрелых крысах-самцах массой 200–250 г., на 8–10 неделе постнатального онтогенеза. Животные забивались путем декапитации под наркозом смеси эфира с хлороформом (1:1) с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинской декларации, и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных.
Материалом для исследования служили участки коры головного мозга крыс, выделяемые согласно цитоархетектоническим картам [4]. Для получения материала с полости черепа ножницами срезали кожно-мышечные покровы, обнажая костную ткань, затем щипцами «откусывали» шейные позвонки и затылочную кость, снимали ее. Подводя браншу кусачек (щипцов) под крышу черепа сбоку, откусывали теменно-височные кости с обеих сторон и снимали их. Открытый таким образов головной мозг приподнимали со стороны лобных долей кверху, перерезали зрительный тракт, поднимали мозг еще выше, подрезали с обеих сторон твердую мозговую оболочку, покрывающую мозжечок, и вынимали головной мозг, перерезая спинной мозг в шейном отделе. Разрезая оболочки, освобождали из ложа орган, взвешивали и опускали в банку с фиксатором [3]. Фиксацию мозга осуществляли 10% раствором формалина, приготовленном на 0,2 М фосфатном буфере и смесью Карнуа. При отсутствии макроскопически видимых повреждений органа делали продольный срез на уровне продолговатого мозга. Изготовление срезов осуществляли путём резки блоков, залитых в парафиновые среды. Парафиновые срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином для обзорных целей, а для изучения цитоархитектоники – метиленовым синим по Нисслю.
Исследования препаратов проводилось с помощью цифрового микроскопа MT 4000 Series Biological Microscope с программным обеспечением для анализа изображений «Bio Vision Version 4.0». Фотосъемку препаратов производили с помощью встроенной цифровой камеры при увеличении 10×10, 40×10 и 100×10. Разрешение полученных изображений 1280×1024 пикселей.
Результаты исследования и их обсуждение. При гистологическом исследовании неокортекса белой крысы обнаружено 6 слоев нервных клеток, снаружи внутрь располагающиеся в следующем порядке: 1. Молекулярный слой; 2. Наружный зернистый слой; 3. Наружный пирамидный слой; 4. Внутренний зернистый слой; 5. Внутренний пирамидный слой; 6. Полиморфный слой (рис. 1).
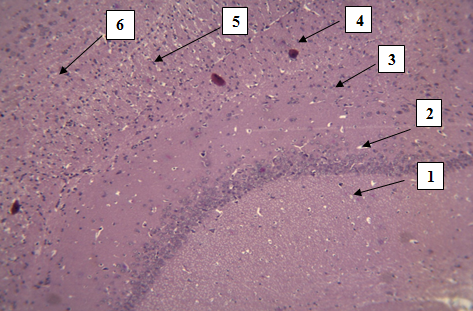
Рис. 1. Кора больших полушарий головного мозга крыс, содержащая 6 слоев нервных клеток. Окраска гематоксилином и эозином. Стрелками обозначены слои нервных клеток (снизу вверх: 1-молекулярный,2-наружный зернистый,3-наружный пирамидный, 4-внутренний зернистый, 5-внутренний пирамидный,6-полиморфный). Ув. 10×10.
На препаратах переднетеменной зоны коры головного мозга молекулярный слой содержит редкие нейроны слегка вытянутой или овальной формы. Цитоплазма клетки имеет мелкозернистую структуру, за счет присутствующего в ее составе белка. Основной объем этого слоя составляют отростки аксоны и дендриты (рис. 2.).
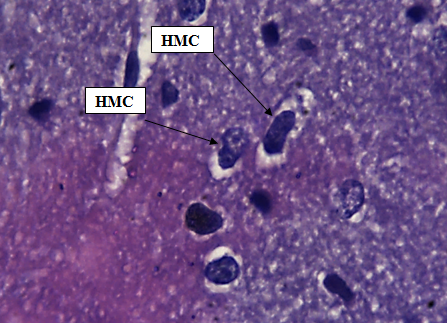
Рис. 2. Молекулярный слой коры больших полушарий. Стрелкой обозначены нейроны молекулярного слоя коры больших полушарий (НМС). Окраска гематоксилином и эозином. Ув. 100×10.
Наружный зернистый слой образован крупными нейронами, имеющими чаще всего округлую или пирамидную форму. Нейроны содержат ядра, имеющие слегка вытянутую, овальную форму. Цитоплазма клетки имеет крупнозернистую структуру. Клетки расположены плотно, образуя четко отделяющийся слой (рис. 3).
Наружный пирамидный слой представлен немногочисленными пирамидными нейронами средней величины, размеры их перикариона возрастают в глубоких частях слоя. Слой пирамидных клеток состоит из клеток конической формы. Нейроны содержат мелкие ядра, имеющие округлую форму. Цитоплазма клеток имеет гладкую, незернистую структуру (рис. 4).
Внутренний зернистый слой содержит мелкие звездчатые, зернистые и пирамидные нейроны. Клетки расположены парно или на относительно небольшом расстоянии друг от друга. Ядра перикарионов имеют четко выраженную структуру, мелкие. Цитоплазма в клетке распределена равномерно, без крупных белковых включений (рис. 5).
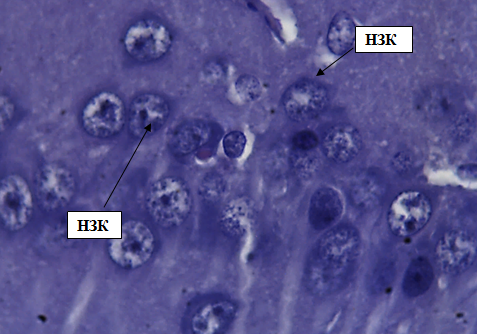
Рис. 3. Наружный зернистый слой коры больших полушарий. Стрелкой обозначены нейроны наружного зернистого слоя (НЗК). Окраска гематоксилином и эозином. Ув. 100×10.
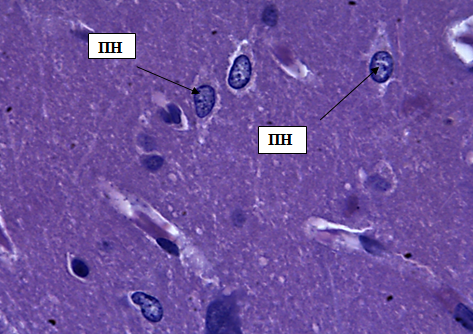
Рис. 4. Наружный пирамидный слой коры больших полушарий. Стрелками обозначены пирамидные нейроны (ПН). Окраска гематоксилином и эозином. Ув. 100×10.
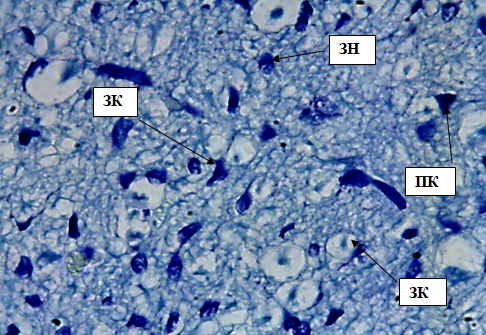
Рис. 5. Внутренний зернистый слой коры больших полушарий. Стрелкой обозначены звездчатые клетки (ЗК), пирамидные клетки (ПК), зернистые нейроны (ЗН). Окраска метиленовым синим по Нисслю. Ув. 100×10.
Внутренний пирамидный слой представлен крупными нейронами (клетки Беца, клетки Мейнерта) и небольшим количеством звездчатых клеток (рис. 6, 7).
Клетки Беца расположены в V слое коры, это самые крупные нейроны коры, которые дают начало миелиновым волокнам пирамидного тракта. Цитоплазма не содержит крупных включений, ядра крупные.
Клетки Беца имеют длинный апикальный дендрит, выходящий из вершины пирамиды в вышележащие слои, и другие дендриты, отходящие от перикариона сбоку и от основания перикариона. От основания пирамиды отходит аксон, уходящий в белое (рис. 6).
Клетки Мейнерта – достаточно крупные нейроны, локализованные на протяжении всего V слоя коры полушарий. Ядра относительно крупные, округлые. Клетки имеют пирамидную форму, однако по сравнению с клетками Беца лишены крупных апикальных и боковых дендритов. Клетки располагаются по всей толще коры.
Перикарионы звездчатых нейронов имеют округлую, полигональную или треугольную форму (рис. 7).
Полиморфный слой образован множеством нейронов различной величины и формы, а так же некоторым количеством пирамидных и зернистых нейронов (рис. 8). Клетки располагаются цепочками. Пирамидные нейроны имеют слегка вытянутую форму с заметными удлинениями. Ядра небольшие с ровной структурой. Зернистые нейроны имеют округло-угловатую форму. Цитоплазма с крупными белковыми включениями, придающими зернистость внутреннему содержимому клетки. Ядра клеток вытянутые.
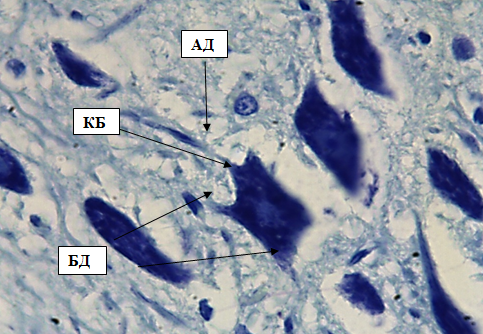
Рис. 6. Внутренний пирамидный слой коры больших полушарий. Стрелками обозначены: клетки Беца (КБ), апикальный дендрит (АД), боковые дендриты (БД). Окраска метиленовым синим по Нисслю. Ув. 100×10.
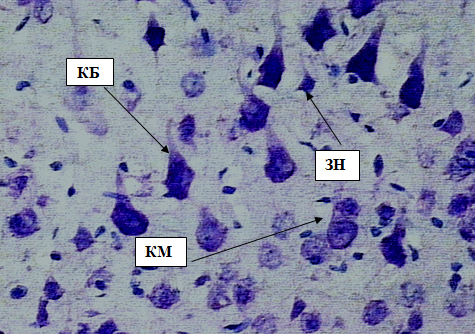
Рис. 7. Внутренний пирамидный слой коры больших полушарий. Стрелками обозначены: клетки Беца (КБ), клетки Мейнерта (КМ), звездчатые нейроны (ЗН). Окраска метиленовым синим по Нисслю. Ув. 40×10.
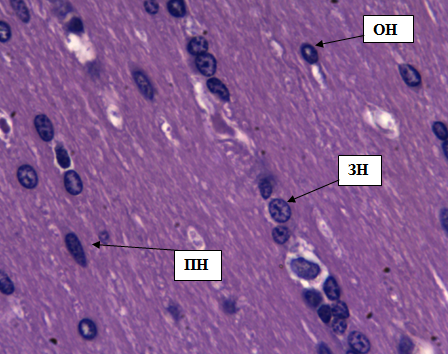
Рис. 8. Полиморфный слои коры больших полушарий. Стрелками обозначены: пирамидные нейроны (ПН), зернистые нейроны (ЗН), овальные нейроны (ОН). Окраска гематоксилином и эозином. Ув. 40×10.
В полиморфном слое мы также встретили нейроны овальной формы (ОН) с небольшим апикальным отростком. Контуры клеток ровные, цитоплазма имеет пористую структуру, ядра мелкие (рис. 8).
Таким образом, проведенные исследования позволили показать подробное гистологическое строение клеточного состава слоев переднетеменной зоны коры головного мозга крыс-самцов к моменту полового созревания.
