Введение. Известно, что радиационные хронические низко интенсивные воздействия распространены и действенны в повседневной жизни, сфере здравоохранения, промышленных и бытовых условиях, в условиях космоса в пилотируемых космических аппаратах [5,7-9,11]. Иммунная система, как одна из важнейших регуляторных систем организма, не может не участвовать в ответной реакции организма при действии этих факторов, морфологическим эквивалентом которого являются ее структурно-функциональные изменения [9]. Нарушение и изменение показателей структурных компонентов иммунной системы при лабораторных исследованиях называют иммунной недостаточностью, которая может сопровождаться иммунодефицитом. Селезенка является важнейшим органом периферического звена иммунной системы. Она участвует в формировании иммунного ответа (преимущественно антителообразование к полисахаридным антигенам), фильтрации измененных клеток крови и циркулирующих микроорганизмов, а также в процессе экстрамедуллярного гемопоэза в плодном периоде или после рождения в условиях дефицита медуллярного гемопоэза [2,4,6,8,12]. Имеющиеся данные об изменениях белой пульпы селезенки после воздействий единичные, не всегда сопоставимы, во многом устарели и не соответствуют радиологическим критериям сегодняшнего дня [6,11-13,16,17].
Цель исследования - изучение структурных особенностей центров размножения лимфоидных узелков селезенки мышей после экспериментального воздействия радиационного фактора низкой интенсивности.
Материалы и методы. В качестве материала исследования взята селезенка 84 мышей-самцов линии F1(CBAxC57BL6), массой 25-30 гр, из которых группу контроля составляет 12 мышей. Животные содержались на стандартном пищевом рационе с двухнедельным карантином в условиях вивария.
Общая длительность эксперимента составила ~230 суток (8 месяцев). Облучение проводили с помощью гамма-установки ГОБО-60 с источником Cs137. Экспериментальные животные (72 мыши) подвергались общему равномерному гамма-облучению в течение 70 суток при мощности дозы 25 сГр в час. Облучение проводилось 1 раз в неделю по 2 часа в утреннее время суток. Доза гамма-облучения за одну неделю составляет 50 сГр. Суммарная доза облучения для животных за 70 суток составляет 500 сГр. Доза облучения у различных групп животных являлась единственным фактором, который влиял экспериментальных животных. Доза облучения лабораторных животных – 500 сГр, с учетом разницы в продолжительности жизни и чувствительности к радиационному воздействию животных (мышей) и человека, соответствует дозе облучения 170 сГр для человека. Доза облучения 170 сГр соответствует предельно допустимому уровню, характерному для межпланетных пилотируемых полетов [15]. Из эксперимента мышей выводили сразу же после его окончания (12 мышей), а также в реабилитационном периоде (после воздействий) через 9, 14, 30, 60 и 90 суток (по 12 мышей в каждой группе). Контрольную группу (не подвергавшихся облучению) выводили из эксперимента также непосредственно после его окончания.
Животные забивались методом цервикальной дислокации (смещение шейных позвонков иглой, после применения эфирного наркоза). Гибели мышей во время облучения, в реабилитационном периоде не наблюдали.
Лимфоидные структуры селезенки после ее фиксации в нейтральном формалине изучали на срезах, окрашенных гематоксилином-эозином. Использовали методику точечного счета, по Глаголеву А.А. [3] в модификации Стефанова С.Б. [10]. Статистическая обработка данных включала вычисление средне арифметических показателей и их ошибки, достоверность различий определяли методом доверительных интервалов. Эксперимент проводился на базе государственного научного центра Российской Федерации института медико-биологических проблем РАН и Первого Московского Государственного Медицинского Университета им И.М. Сеченова.
Результаты исследования и их обсуждение. В результате проводимого исследования нами установлено, что пульпа селезенки представлена, лимфоидными узелками, периартериальными лимфоидными влагалищами и эллипсоидами [9]. По нашим данным, как в контроле, так и у мышей экспериментальной группы, преимущественное большинство лимфоидных узелков селезенки имеют центр размножения. Центры размножения повторяют, в основном, форму самих лимфоидных узелков, в состав которых они входят.
В контрольной группе мышей ширина периартериальной лимфоидной зоны (до центра размножения) составляет от 17,80 до 50,75 мкм, (34,17±2,65). На 9 сутки эксперимента этот показатель от контроля достоверно не отличается (р>0,05). Незначительное увеличение этого параметра наблюдается на 14 и 30 сутки. (р>0,05). Однако на 60 сутки эксперимента происходит уменьшение периартериальной лимфоидной зоны от 20, 90 мкм до 70,40 мкм, (51,91±3,80). На 90 сутки восстановительного периода происходит уменьшение этого параметра относительно 60 суток, однако, контрольных параметров он не достигает и составляет 47,80±3,51 мкм.
Ширина периартериальной зоны (до мантийной зоны) в контрольной группе варьирует от 17,80 мкм до 80,25 мкм (45,66±5,84). На 9 сутки опыта значение этого показателя равно 52,25±5,25 мкм, на 14 сутки - 50,95±3,01 мкм, что почти соответствует контрольным данным. На 30 сутки данный параметр уменьшается (34,30±2,90 мкм), а на 60 сутки воздействия составляет 49,28±3,48 мкм. На 90 сутки восстановительного периода этот показатель практически не изменился относительно 60 суток, составляя при этом 51,29±3,88 мкм.
При изучении диаметра центра размножения отметились следующие особенности. В контрольной группе животных этот показатель варьирует от 122,4 до 335,5 мкм, в среднем составляя 240,65±18,90 мкм, на 9 сутки опыта отмечается незначительное увеличение и он равен 267,08±16,87 мкм. На 14 сутки экспериментального воздействия происходит уменьшение диаметра центра размножения как по отношению к 9 суткам, так и по отношению к контрольным показателям, составляя 174,89±15,98 в 1,1 раза. На 30 сутки диаметр центра размножения продолжает уменьшаться, в среднем его размеры составляют 107,8±5,88 мкм, что в 2,5 раза меньше данных на 9 сутки опыта. На 60 сутки центр размножения лимфоидных узелков в среднем равен 93,03±3,33 мкм, что ниже по отношению 30 суток. На 90 сутки – восстановительного периода происходит незначительное увеличение диаметра центра размножения лимфоидных узелков в сравнении с 60 суткми. Он составляет 101,2±4,13, что ниже значений группы контроля в 2,4 раза.
Мантийная зона располагается концентрическими слоями (как правило, от 5 до 17). Мы установили, что на 9 и 14 сутки опыта происходит уменьшение количества слоев на участке мантии противоположном от периртериальной зоны, а с 30 суток и до 60 суток происходит увеличение количеств слоев с 5-17 до 9-20, в 1,2 раза.
В ходе эксперимента выявлено, что толщина мантийной зоны лимфоидных узелков на гистологических срезах, селезенки мышей варьирует от 32,75 мкм до 75,20 мкм, как в контрольной группе, так и на 9 сутки эксперимента. На 14 сутки этот показатель находился в пределах от 40,75 мкм до 100,0 мкм, что выше контрольных данных в 2,5 раза. На 30 и 60 сутки варьирует от 40,75 мкм до 110,0 мкм, а на 90 сутки уменьшается и составляет от 35,25 мкм до 105,0 мкм. Однако четкой взаимосвязи между размерами центров размножения и мантийной зоной лимфоидных узелков мышей контрольной группы и группы эксперимента не обнаружено (табл. 1, рис. 1).
Таблица 1. Размеры различных зон лимфоидных узелков с центрами размножения на срезах селезенки мышей линии F1 (CBAx C57 BL/6) при воздействии радиации низкой интенсивности (Х±Sх; min-max; мкм)
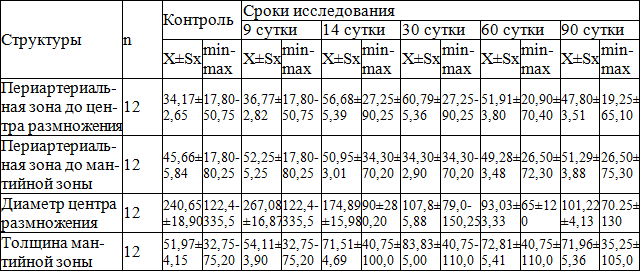
Примечание: n - число наблюдений, измерение на площади среза 880 мкм
Заключение
В результате проведенного исследования нами установлено, что белая пульпа селезенки контрольной и экспериментальной группы животных представлена лимфоидными узелками, периартериальными лимфоидными влагалищами и эллипсоидами лимфоидные узелки всех изученных групп имели центры размножения. На 9 сутки эксперимента диаметр центра размножения увеличился, по сравнению с контрольными показателями. По-видимому, следует предположить, что происходит развитие ответной реакции организма на повышение дозы радиации. C 14 по 60 сутки опыта диаметр центра размножения лимфоидных узелков снижается однонаправлено, что говорит об уменьшении процессов активации иммунитета [1, 14,17,18]. Только на 90 сутки восстановительного периода диаметр центра размножения лимфоидных узелков увеличивается по сравнению с предыдущими сроками эксперимента, контрольных показателей при этом не достигает.
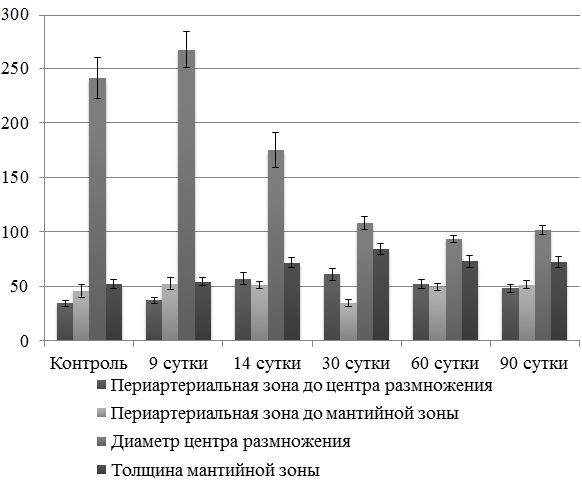
Рис. 1. Размеры различных зон лимфоидного узелка белой пульпы селезенки в разные сроки экспериментального воздействия
Материалы нашего исследования могут быть востребованы как в практической медицине (авиационная медицина) для расчетов предельно допустимых доз излучения для живого организма, так и рекомендованы для включения в руководства и учебные пособия по морфологии, иммунологии, космической и авиационной медицине, гигиене труда.
