Понимание природы любого патологического процесса становится возможный при ясном представлении биохимических, анатомо-морфологических и динамических функциональных связей его с клинико-физиологическим состоянием организма как единого целого. При этом одним из важнейших аспектов является выяснение основных структурно-функциональных параметров пораженной ткани, органа или системы, играющих ведущую роль в патогенезе болезни. В этом отношении важнейшее значение приобретает оценка морфо-функционального состояния печени как основного «барьерного» органа, ответственного за поддержание физиологических параметров гомеостаза [3, 6].
Печень ответственна за переработку поступающих в организм метаболитов, синтез большинства белков плазмы крови, прежде всего альбуминов, фибриногена, протромбина, некоторых фракций глобулинов, многих ферментных систем; непосредственно участвует в углеводно-липидном, витаминном обмене, пищеварении. Динамика, последовательность, качественные и количественные параметры, пределы их изменений при различных патологических унитарных, полиэтиологических, первичных и вторичных, острых и хронических, органных и системных нарушениях всегда имеют важнейшее или определяющее значение в обосновании лечебных, профилактических и прогностических заключений [7, 8].
Вместе с тем, расширение и углубление представлений о роли печени в патогенезе болезней, выработке качественных и количественных критериев оценки ее морфо-функциональных показателей в динамике представляет и на современном уровне знаний трудную, многоплановую, но крайне актуальную задачу [3, 6, 7].
Цель работы – изучение иммунотропной и метаболической активности культуральной жидкости аллогенных гепатоцитов, гептрала и мексикора у интактных животных.
Материал и методы. Эксперименты проводили на 144 здоровых половозрелых крысах линии Вистар, массой 180-200 г. В опытах использовали животных, прошедших карантинный режим вивария Курского государственного медицинского университета и не имевших внешних признаков каких-либо заболеваний. Все исследования проводили в одно и то же время суток, с 8 до 12 ч, с соблюдением принципов, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (г. Страсбург, Франция, 1986) и согласно правилам лабораторной практики РФ (приказ МЗ РФ № 267 от 19.06.2003 г.).
Способ введения препаратов соответствовал рекомендациям, приведенным в пособии по фармакотерапии М.Д. Машковского «Лекарственные средства» и аннотациях по использованию препаратов. Перерасчет доз с человека (средний вес 70 кг) на животных – белых крыс производился в сторону увеличения в 5,9 раз. Первое введение препаратов выполнялось за 1 час до манипуляции. Мексикор вводился внутрибрюшинно по 5 мг/кг через 24 часа №5, гептрал внутримышечно по 5,5 мг/кг через 24 часа №5, а культуральную жидкость (КЖ) аллогенных гепатоцитов (АГ) в объеме 0,1 мл внутрибрюшинно.
Для оценки неспецифической резистентности устанавливали фагоцитарно-метаболическую активность полиморфноядерных лейкоцитов по фагоцитарному числу (ФЧ) и фагоцитарному индексу (ФИ), показателям спонтанного и индуцированного зимозаном НСТ-теста опсонизированного зимозаном (о/з) и неопсонизированного (н/з) [10, 11]. Оценка иммунологической реактивности основывалась на показателях гуморального иммунного ответа (ГИО) (количество антителообразующих клеток – АОК) и гиперчувствительности замедленного типа (ГЗТ) (разнице масс регионарного и контрлатерального лимфатических узлов – РМ и по разнице количества в них кариоцитов – РК) [5].
В сыворотке крови экспериментальных животных определяли концентрацию общего билирубина, общего белка, фибриногена и активность аспартат- и аланинаминотрансфераз (АЛТ и АСТ), щелочной фосфатазы (ЩФ), γ-глутамилтранспептидазы (ГГТ), ставили тимоловую пробу (ТП) и определяли протромбиновый индекс (ПТИ). Величины всех перечисленных показателей определяли унифицированными методами с использованием стандартных наборов реактивов [8]. Выраженность перекисного окисления липидов оценивали по содержанию ацилгидроперекисей (АГП) и малонового диальдегида (МДА), кроме этого, в сыворотке крови определяли активность каталазы [2, 9].
Эритроциты получали из 5 мл гепаринизированной крови по методу E. Beutler [12]. Определяли сорбционную способность эритроцитов (ССЭ) и сорбционную емкость их гликокаликса (СЕГ) [1]. О функциональном состоянии эритроцитов судили также по накоплению в них малонового диальдегида [1].
Статистическую обработку результатов исследования проводили, используя параметрические и непараметрические методы [4].
Результаты и обсуждение. В условиях введения интактным животным КЖ АГ достоверных различий между изучаемыми показателями иммунной реактивности и фагоцитарной активности нейтрофилов периферической крови получено не было (табл. 1).
При этом КЖ АГ приводит у интактных животных к повышению кислородзависимой активности нейтрофилов периферической крови, о чем свидетельствует повышение значения НСТ-теста спонтанного и стимулированного опсонизированного и неопсонизированного (табл. 1).
Введение интактным животным сочетания гептрала и мексикора не оказывает достоверного влияние на изучаемые показатели иммунной реактивности и функционально-метаболической активности нейтрофилов периферической крови (табл. 1).
Таблица 1. Иммунная реактивность и функция полиморфноядерных лейкоцитов при введении культуральной жидкости аллогенных гепатоцитов, гептрала и мексикора интактным животным (M±m)
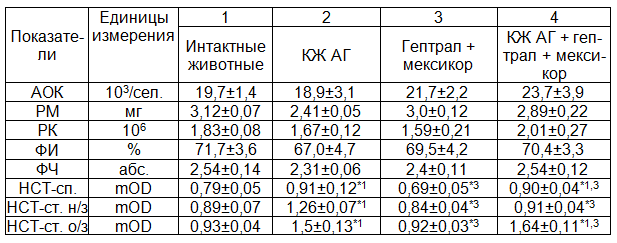
Примечание: здесь и в табл. 2 звездочкой отмечены достоверные отличия средних арифметических (p < 0,05); цифры рядом со звездочкой – по отношению к показателям какой группы даны эти различия.
Применение сочетания КЖ АГ и гептрала с мексикором позволило по сравнению с группой животных, получавших только КЖ АГ, повысить значения НСТ-теста стимулированного опсонизированного (табл. 1).
На 5-е сутки после введения КЖ АГ интактным животным у последних не получено было достоверных различий в функциональной активности гепатоцитов и уровне продуктов ПОЛ в плазме крови (табл. 2).
Тогда как применение гептрала и мексикора как отдельно, так и в сочетании с культуральной жидкость аллогенных гепатоцитов у животных повышает активность в плазме крови щелочной фосфатазы (табл. 2).
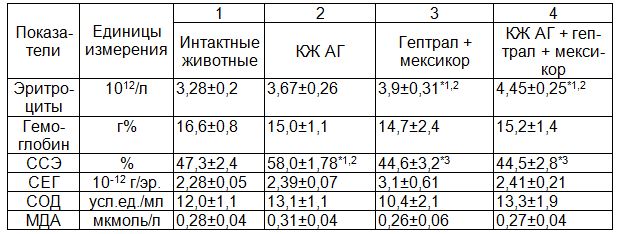
Введение животным КЖ АГ повышает ССЭ, тогда как использование гептрала и мексикора отдельно и в сочетании с КЖ АГ не оказывает существенного влияние функциональную активность эритроцитов, увеличивая лишь незначительно общее количество красных клеток крови (табл. 3).
Таблица 2. Функциональная активность гепатоцитов, состояние процессов ПОЛ и активность каталазы при введении культуральной жидкости аллогенных гепатоцитов, гептрала и мексикора интактным животным (M±m)
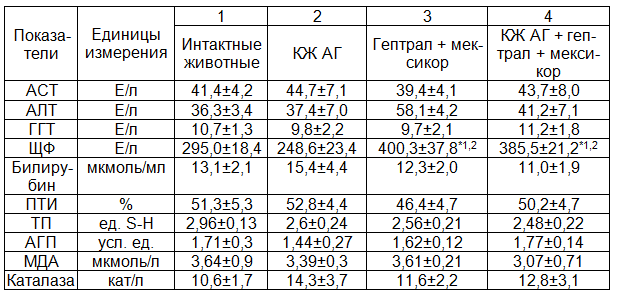
Таблица 3. Структурно-функциональные свойства эритроцитов при введении культуральной жидкости аллогенных гепатоцитов, гептрала и мексикора интактным животным (M±m)
Полученные результаты свидетельствуют о положительном влиянии КЖ АГ на иммунометаболический статус у интактных животных: повышая кислородзависимую активность нейтрофилов периферической крови, стимулируя активность гепатоцитов, не влияя на иммунную реактивность.
Выявленные эффекты культуральной жидкости аллогенных гепатоцитов могут быть усилены сочетанным использование гептрала и мексикора, что может быть использовано в клинической практике.
Полученные результаты свидетельствуют о возможности апробирования предложенных схем коррекции иммунометаболических нарушений, возникающих при патологии печени, как в эксперименте, так и в условиях клиники.
