Атопический дерматит (АД) является одной из наиболее актуальных проблем современной дерматологии. По различным экспертным оценкам считается, что не менее 10-15% населения Земли страдают аллергическими заболеваниями, из них 25-30% приходится на атопический дерматит [1].
Значимость данной проблемы обусловлена не только высокой распространенностью АД, но и ранним началом и быстрым переходом заболевания из острой фазы в хронические формы с частыми рецидивами, сопровождающимися обострением сопутствующих заболеваний, таких как бронхиальная астма, поллиноз, крапивница, отек Квинке, аллергический ринит и др., что ведет к снижению социальной адаптации и инвалидизации населения [2].
Несмотря на достигнутый прогресс в изучении механизмов развития АД, этиология и патогенез атопического дерматита во многом остаются неясными. Возникновение и хроническое течение атопического дерматита в основном связывают с наследственной предрасположенностью, нейрогуморальными и нейрососудистыми нарушениями, психоэмоциональными расстройствами, влиянием неблагоприятных условий окружающей среды и т. д. [3-7]. Важная роль в патогенезе атопического дерматита отводится дисфункции иммунной системы, проявляющейся снижением супрессорной и киллерной активности Т-системы иммунитета, дисбалансом продукции сывороточных иммуноглобулинов с увеличением уровня IgE, что обуславливает склонность организма к различным аллергическим реакциям, подверженность к бактериальным и вирусным инфекциям [8, 9]. В связи с чем, при выборе стратегии лечения АД немаловажную роль играет коррекция звеньев иммунной системы с включением в комплекс терапии иммунотропных препаратов различной природы, особенно в период снижения адаптационной устойчивости организма, присоединения острых простудных заболеваний, бактериальных инфекций кожи, обострения сопутствующей патологии [10-12]. Следует отметить, что, несмотря на широкий спектр имеющихся методов воздействия на иммунную систему, проблема атопического дерматита далека от разрешения. Все чаще возникают более тяжелые формы заболевания и торпидность к проводимой терапии [13]. Возможно, это связано с тем, что стратегия лечения АД в основном направлена на эффекторные звенья Т-системы иммунитета, в частности на тучные клетки, базофилы и IgE-зависимые механизмы аллергического воспаления [10, 12, 14] и не учитывается роль В-системы иммунитета, непосредственно участвующей в механизмах десенсибилизации организма. В то же время, персистенция аллергенов и гиперчувствительность организма в первую очередь обусловлены супрессией протективной функции В-системы иммунитета, связанной с преимущественной секрецией функционально неактивных низкоавидных антител G класса. Низкоавидные антитела, образуя с аллергенами мелкие непрочные иммунные комплексы, длительно циркулируют в крови и, таким образом, способствуют активации Th2- типа иммунного ответа и IgE-зависимых механизмов аллергического воспаления [15-19]. Показано, что иммунокоррегирующая терапия, направленная на повышение содержания функционально активных высокоавидных антител G класса в крови больных АД, способствует десенсибилизации организма, снижению интенсивности аллергического воспаления в кожных покровах и развитию клинической ремиссии [20-23].
В настоящей работе предпринята попытка найти взаимосвязь между авидитетом антител G класса и индексом SCORAD при лечении больных АД с помощью поливалентной вакцины бактериального происхождения «Иммуновак-ВП-4» с целью разработки алгоритма эффективной вакцинотерапии на основании контроля протективной функции В-системы иммунитета.
Материалы и методы. Под наблюдением находились две группы больных АД (n=55) cо средне-тяжелым течением заболевания в возрасте от 19 до 55 лет с длительностью заболевания от 3 до 24 лет. Степень тяжести АД определяли по шкале индекса SCORAD [24].
Большинство больных предъявляли жалобы на зуд различной степени интенсивности, нарушение сна, повышенную утомляемость. Высыпания локализовались на коже лица, шеи, туловища, сгибательной поверхности верхних и нижних конечностей в виде папулезных или эритематозно-сквамозных высыпаний, множественных расчесов, покрытых геморрагическими корками. Наблюдалась выраженная инфильтрация и лихенизация кожи.
Сопутствующей патологией являлись заболевания желудочно-кишечного тракта, хронические заболевания легочной системы, заболевания с аллергическим компонентом (поллиноз, крапивница, бронхиальная астма, аллергический конъюнктивит, аллергический ринит), вегето-сосудистая дистония.
Характерным для всех больных являлось супрессия протективной функции В-системы иммунитета, обусловленная повышенной (90,9±5,1%) секрецией функционально неактивных низкоавидных антител G класса, не обладающих защитными свойствами.
Протективную активность В-системы иммунитета определяли с помощью тест-системы для экспресс диагностики доклинических и клинически выраженных форм иммунологической недостаточности, разработанной в Институте биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук (ИБХ РАН). В норме содержание высокоавидных антител составляет 80-100%, низкоавидных - 0-20% [18].
Первая – контрольная группа больных (n=25) c индексом SCORAD 46,0±2,07 получала традиционную терапию, включающую антигистаминные, десенсибилизирующие, седативные, ферментативные препараты, наружные средства в виде паст, кремов, мазей.
Вторая группа больных АД (n=30), со средним значением индекса SCORAD 44,39±3,4, получала наряду с традиционной терапией препарат «Иммуновак-ВП-4», представляющий собой смесь водорастворимых антигенов микробных клеток Staphylococcus aureus, Klebsiella pneumoniae, Proteus vulgaris, Escherichia coli [11, 25]. Количество курсов и сроки проведения иммунокоррегирующей терапии диктовались состоянием протективной активности В-системы иммунитета. Показанием для назначения вакцинотерапии являлось снижение уровня функционально активных высокоавидных антител G класса и нарастание функционально неактивных низкоавидных антител в межкурсовом периоде.
Вакцину «Иммуновак-ВП-4» вводили назально-подкожным методом по схеме (схема одного курса): 1-ая процедура – 1 капля в один носовой ход, 2-ая процедура – по 1 капле в каждый носовой ход, 3-я процедура – по 2 капли в каждый носовой ход. Промежуток между процедурами составлял 1 сутки. Далее препарат вводили подкожно в угол лопатки, меняя поочередно сторону введения, по следующей схеме: 0,05 мл – 0,1 мл – 0,2 мл – 0,2 мл – 0,2 мл с интервалом между инъекциями в 5 дней. Интервал между назальным и подкожным методом введения составлял 3 дня.
Эффективность терапии (Кэт) вычисляли по формуле:

Статистическую обработку результатов исследования проводили с помощью параметрических критериев пакета Biostat, 1998. Достоверность значимых различий средних показателей оценивали с помощью парного t-критерия Стьюдента. Выяснение наличия функциональной связи между индексом SCORAD и авидностью антител проводили с помощью определения коэффициентов регрессии и корреляции по Пирсону [26].
Результаты и их обсуждение. Результаты исследования показали, что в группе больных, получавших традиционную терапию, отмечалось небольшое снижение индекса SCORAD (в среднем на 24,3%, p<0,05), Кэт составил 1,32 (табл. 1). Переход из фазы обострения в фазу клинической ремиссии сопровождался нарастанием высокоавидных антител G класса (с 9,1% до 22,5%, р<0,05, норма 80-100%) и снижением низкоавидных антител (с 90,9% до 77,5%, p<0,05, норма 0-20%). Столь незначительное увеличение высокоавидных антител не могло обеспечить десенсибилизацию организма, о чем косвенно свидетельствовало небольшое (на 33,8%) снижение числа эозинофилов (с 873±115 до 578±95). Между индексом SCORAD и содержанием высокоавидных антител наблюдалась средней степени корреляционная связь (r=-0,56) (табл.1).
Отдаленные наблюдения за больными АД показали, что традиционная терапия не обеспечивала развитие стойкой клинической ремиссии. У 80% пациентов (n=20) наблюдались частые обострения заболевания (5-6 раз в год) и только у 20% пациентов отмечалась более длительная ремиссия (3-4 месяца).
Из вышеизложенного следует, что применение антигистаминных и седативных препаратов не обеспечивает нормализацию протективной функции В-системы иммунитета и развитие стойкой клинической ремиссии.
Таблица 1. Изменения индекса SCORAD и содержания высоко- и низкоавидных антител G класса у больных АД в результате традиционной терапии
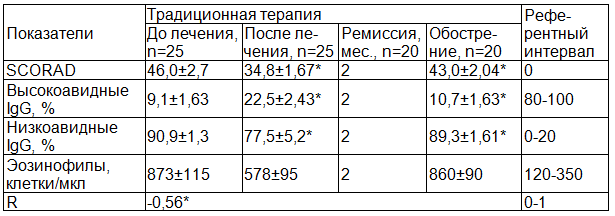
Примечание: здесь и далее R - коэффициент корреляции между индексом SCORAD и авидностью IgG, * - р<0,05.
Во второй группе больных АД включение в терапию вакцины «Иммуновак-ВП-4» привело к достоверному увеличению в крови содержания высокоавидных антител G-класса (с 10% до 35%, р<0,05), снижению низкоавидных антител (с 90% до 65%) и индекса SCORAD на 68% (с 44,39±3,4 до 14,09±2,67, p<0,05), при этом Кэт составил 3,15, т.е. был значительно выше, чем при традиционной терапии (табл.2).
Однако проведение одного курса вакцинотерапии оказалось недостаточным для достижения стойкой иммунологической и клинической ремиссии. Очередное обострение АД повторилось через 3 месяца после окончания лечения. При этом у пациентов отмечалось увеличение индекса SCORAD до 34,14±3,4, снижение высокоавидных антител G класса до 20% (p<0,05) и увеличение низкоавидных до 80%. Следует отметить, что при обострении уровень высокоавидных антител был в два раза выше в сравнении с исходным значением.
Снижение протективной активности В-системы иммунитета послужило основанием для проведения повторного курса иммунокоррегирующей терапии, в результате чего было достигнуто повышение уровня высокоавидных антител G класса (с 20% до 55%, p<0,05), снижение низкоавидных антител (с 80% до 45%, p<0,05), уменьшение индекса SCORAD на 59% (с 34,14±3,4 до 13,83±3,21, p<0,05) и аллергического воспаления. Между индексом SCORAD и авидитетом антител наблюдалась средней степени корреляционная связь (r= -0,67) (табл.1).
Таким образом, в результате повторной вакцинации значительно повысились адаптационные резервы организма, что способствовало увеличению продолжительности клинической ремиссии до 4,5 месяцев.
Важно отметить, что после двух курсов вакцинотерапии последующее обострение было не столь выраженным, индекс SCORAD увеличился на 33,5%, т.е. с 13,83±3,21 до 20,80±3,4. Обострение протекало на фоне снижения уровня функционально активных высокоавидных антител G класса до 35% и повышения низкоавидных антител до 65%, что свидетельствовало о развитии супрессии протективной функции В-системы иммунитета и необходимости дополнительной иммунокоррекции.
Проведение третьего курса вакцинации обеспечило нормализацию протективной функции В-системы иммунитета, выражающуюся в достоверном (p<0,05) увеличении секреции высокоавидных антител G-класса до 75% и уменьшении низкоавидных антител до 25%, а также существенное снижение индекса SCORAD на 80% (с 20,8±3,4 до 4,07±3,13), при этом Кэт составил 5,11. Между индексом SCORAD и авидностью антител отмечалась высокая корреляционная связь (r= -0,78). После третьего курса также уменьшилось количество эозинофилов до 343±79 (табл.2).
Таблица 2. Изменения индекса SCORAD и содержания высоко- и низкоавидных антител G класса у больных АД в результате комплексной терапии с включением вакцины «Иммуновак-ВП4»
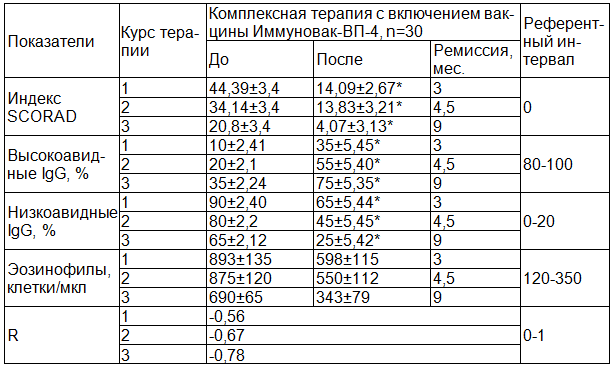
Наблюдения за пациентами основной группы, получавших комплексную терапию с включением вакцины «Иммуновак-ВП4», показали, что каждый последующий курс вакцинации приводил к уменьшению выраженности иммунологической недостаточности, снижению индекса SCORAD и увеличению промежутков времени между обострениями. После трех курсов вакцинотерапии была достигнута стойкая иммунологическая и клиническая ремиссии продолжительностью в девять месяцев и более.
Таким образом, становится очевидным, что необходимым условием достижения максимального терапевтического эффекта и стойкой клинической ремиссии при лечении больных АД с помощью вакцины «Иммуновак ВП-4» является нормализация протективной функции В-системы иммунитета, т.к. нарастание высокоавидных антител (до 80-100%) ведет к увеличению клиренса ЦИК, усилению выведения из организма атопенов и аллергенов, десенсибилизации организма и, как следствие, к снижению аллергического воспаления. При этом изменения в Т-системе иммунитета носят вторичный характер [15, 20-23].
Таким образом, впервые показано, что «Иммуновак-ВП-4» влияет на авидность антител G класса и может быть использован в качестве корректора протективной функции В-системы иммунитета при лечении больных АД. Однако для достижения оптимального терапевтического эффекта выбор стратегии вакцинации должен базироваться на оценке степени супрессии протективной функции В-системы иммунитета.
