Монооксигеназная система (МОС) гепатоцитов является одной из важных систем организма, так как именно в ней осуществляется биотрансформация большинства ксенобиотиков, а также многих жизненно важных эндобиотиков. В этом аспекте МОС печени обеспечивает постоянство гомеостатических констант организма. Измененная активность ферментов МОС играет не самую последнюю роль в патогенезе многих заболеваний. В этой связи представляет большой интерес возможности коррекции измененной активности МОС гепатоцитов. Для этой цели часто применяют различные препараты, которые могут оказывать также побочные действия. Для нас представлял большой интерес разработка способа модификации активности МОС гепатоцитов, лишенного данных недостатков.
В последние годы наблюдается появление совершенно новых технологий, которые кардинально меняют наше понимание структуры и функции живой системы. Эти технологии не только пополняют наши знания о живой системе, но и позволяют регулировать ее функционирование, что очень важно с позиций коррекции нарушенных функций. Одним из таких технологий являются клеточные технологии. Под клеточными технологиями в настоящее время понимают применение стволовых клеток, для восстановления структурно измененных частей ткани, для замещения некротизированных участков различных тканей нормальными клетками этих же тканей [15]. Однако если учесть, что в основе этих технологий все же лежит использование клеток, то применение других, дифференцированных клеток для аналогичных целей, или же для моделирования различных состояний и коррекции определенных нарушений также можно отнести к клеточным технологиям. В этом плане особый интерес представляют адоптированные лимфоциты. В настоящее время известно, что с помощью адоптированных лимфоцитов можно переносить информацию о регенерации [6], о хроническом токсическом гепатите [11, 23], нефрозонефрите [1], панкреатите [10], гипертрофии миокарда [17] и почек [26, 27], остеопетрозе [24] и стрессе [12]. К тому же лимфоциты обладают стимулирующим влиянием на регенерацию кожи [9], тонкой кишки [20] и желудка [2]. Лимфоидные клетки обладают регулирующим влиянием на миогенез [25], развитие скелета [14], заживление ран [7], эритропоэз [21]. В общем, можно сказать, что лимфоциты обладают регулирующим влиянием на эпителиальную, мышечную и соединительную ткани.
Цель исследования. Учитывая вышеизложенное, мы попытались использовать адоптированные лимфоциты для модификации (индукции и ингибировании) активности МОС гепатоцитов, что и явилась целью настоящего исследования.
Материал и методы исследования. Опыты проведены на 115 белых беспородных мышах-самцах массой 16-23 г. Для получения функционально активного состояния МОС печени она была индуцирована индукторами – бензоналом и зиксорином. Бензонал вводили мышам в дозе 50 мг/кг, а зиксорин – 40 мг/кг массы тела на крахмальном клейстере, перорально в течение 3 дней [22]. Для получения функционально пассивного состояния МОС печени система была ингибирована ингибиторами – циметидином и хлоридом кобальта (II) (CoCl2). Циметидин вводили мышам в виде водного раствора в дозе 100 мг/кг массы тела, перорально в течение 10 дней, а СоСl2 в виде водного раствора в дозе 15 мг/кг массы тела, внутрибрюшинно 1 раз [22]. Контрольная группа мышей получала соответствующий объем крахмального клейстера или воды. Была также отдельная интактная группа (без каких либо вмешательств).
После моделирования разных функциональных состояний МОС печени животные, находящиеся под эфирным наркозом, были забиты. Выделяли общую популяцию лимфоцитов из лимфатических узлов брыжейки, которые в количестве 5 млн. на мышь были введены интактным животным. Через день после введения лимфоцитов у опытных животных была изучена длительность гексеналового сна, которая характеризует состояние МОС печени in vivo. Гексенал животным вводили внутрибрюшинно в дозе 100 мг/кг массы тела.
Цифровые результаты обрабатывали статистически с применением t-критерия Стъюдента.
Результаты исследований и обсуждение. Результаты показали, что при введении общей популяции лимфоцитов, выделенной из контрольных мышей (получавшие крахмальный клейстер без индуктора МОС бензонала) в интактные животные, длительность гексеналового сна равнялась 31,90±1,19 мин (рис. 1).
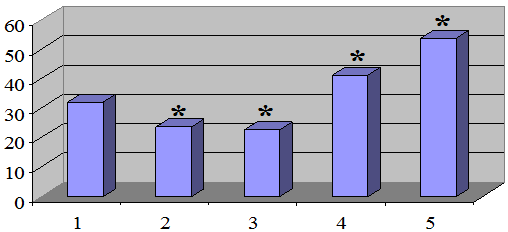
Рис. 1. Длительность гексеналового сна мышей при введении адоптированных лимфоцитов: 1 - интактная группа; 2 - индукция бензоналом; 3 - индукция зиксорином; 4 - ингибирование циметидином; 5 - ингибирование СоCl2. Здесь и на рис. 2 и 4: по оси ординат – длительность сна в мин., * - Р < 0,05 по сравнению с значениями интактной группы
При этом мыши без экспериментального вмешательства (интактная группа) спали 30,85±0,52 мин. При введении общей популяции лимфоцитов, выделенной из животных с индуцированной бензоналом МОС печени в интактные животные, длительность гексеналового сна равнялась 23,70±0,59 мин. При экспериментах с применением другого индуктора МОС печени – зиксорина было показано, что при введении общей популяции лимфоцитов, выделенной из контрольных мышей (получавшие крахмальный клейстер без индуктора МОС зиксорина) в интактные животные, длительность гексеналового сна равнялась 30,4±1,9 мин. При этом мыши без экспериментального вмешательства (интактные) спали 31,8±3,6 мин. При введении общей популяции лимфоцитов, выделенной из животных индуцированной с зиксорином МОС печени в интактные животные, длительность гексеналового сна равнялась 22,7±1,7 мин.
Следовательно, при введении интактным животным общей популяции лимфоцитов, выделенной из животных с индуцированной бензоналом МОС печени, наблюдается статистически значимое укорочение длительности гексеналового сна на 25,7%, а с – зиксорином на 28,6%.
В экспериментах по изучению ингибированного состояния МОС было выявлено, что при введении общей популяции лимфоцитов, выделенной из контрольных мышей в интактные животные, длительность гексеналового сна равнялась 31,00±0,65 мин. При введении общей популяции лимфоцитов, выделенной из животных с ингибированной циметидином МОС печени в интактные животные, длительность гексеналового сна равнялась 41,09±0,49 мин, а при ингибировании МОС – CoCl2 она равнялась 53,8±3,0 мин.
Следовательно, общая популяция лимфоцитов, выделенная из животных с ингибированной циметидином МОС, при введении интактным животным статистически значимо удлиняет длительность гексеналового сна у них на 32,6%, а с CoCl2 - на 51,3%.
Обобщенные результаты приведены на рис. 2. Из него видно, что при введении индукторов длительность гексеналового сна была укорочена на 25%, а ингибиторов, наоборот, удлинена на 54% от интактного значения.
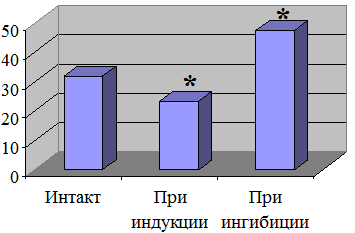
Рис. 2. Изменение длительности гексеналового сна при введении лимфоцитов от индуцированных и ингибированных мышей к интактным мышам
Бензонал является мощным индуктором МОС печени, причем это действие обусловлено преимущественным увеличением содержания цитохрома Р-450 [13]. Зиксорин также является индуктором МОС печени, однако под его действием преимущественно увеличивается содержание цитохрома Р-448 [19]. Ингибиция МОС печени СоСl2 обусловлено ингибирующим действием Со на синтез гема, основы молекулы цитохрома Р-450 [9]. И, наконец, Н2-гистаминоблокатор циметидин ингибирует МОС печени связываясь с цитохромом Р-450 [16].
Из вышеприведенных видно, что примененные нами препараты и вещества имеют разную химическую структуру, механизмы их влияния на МОС печени также различны.
Следовательно, можно заключить, что индукция и ингибиция, вызванные введением адоптированных лимфоцитов, не зависит от химической структуры самого индуктора или ингибитора.
При изучении явлении «адопции» нами была использована общая популяция лимфоцитов. При этом оставался неизвестным ответ на вопрос: все ли формы лимфоцитов обладают адоптивным свойством или это явление касается только одной формы лимфоцитов?
Для выяснения роли в переносе информации отдельных популяций лимфоцитов общая их популяция, выделенная как из контрольных животных, так и из животных с индуцированной бензоналом МОС, была разделена на Т- и В-лимфоциты с помощью бараньих эритроцитов. Разделение общей популяции лимфоцитов на Т- и В-лимфоцитов приведено на рис. 3. После разделения лимфоцитов на Т- и В-популяции, они раздельно были введены интактным мышам и через сутки у последних проводили гексеналовый тест.
Результаты исследований показали, что при введении В-лимфоцитов, выделенных из контрольных мышей (получавшие крахмальный клейстер без индуктора МОС бензонала), к интактным животным, длительность гексеналового сна равняется 30,60±0,67 мин (рис. 4).
Мыши без экспериментального вмешательства (норма) находились в состоянии наркотического сна 29,75±1,18 мин. При введении В-лимфоцитов, выделенных из животных с индуцированной МОС печени к интактным, длительность гексеналового сна равнялась 32,00±0,89 мин.
При введении Т-лимфоцитов, выделенных из контрольных мышей (получавшие крахмальный клейстер без индуктора МОС бензонала), к интактным животным, длительность гексеналового сна равнялась 31,00±0,91 мин. При введении Т-лимфоцитов, выделенных из животных с индуцированной МОС печени к интактным животным, длительность гексеналового сна равнялась 19,60±0,51 мин.
Следовательно, введение адоптированных В-лимфоцитов практически не влияет на длительность гексеналового сна у животных-доноров (повышение длительности гексеналового сна на 4,6% от контроля статистически не значимо), тогда как введение адоптированных Т-лимфоцитов статистически значимо снижает длительность гексеналового сна у животных-доноров на 36,8% от контроля.
Результаты свидетельствуют, что морфогенетическая функция характерна только для Т-лимфоцитов. Наши результаты совпадают с результатами А.Г. Бабаевой с соавт. (1980) [5] . Так, они путем обработки вводимой взвеси клеток селезенки частично гепатэктомированных доноров специфическими антисыворотками против В- или Т-лимфоцитов показали, что за морфогенетическую активность отвечают только Т-лимфоциты.
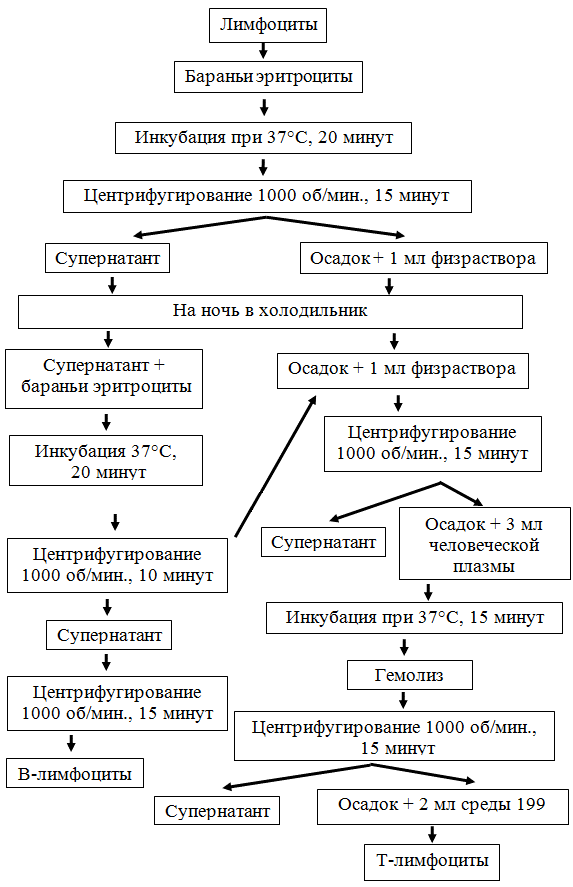
Рис. 3. Схема разделения общей популяции лимфоцитов на Т- и В-клетки
Таким образом, результаты однозначно свидетельствуют, что как индуцированное, так и ингибированное состояние МОС можно моделировать, используя клеточные технологии, а именно введением адоптированных лимфоцитов. Такой подход к модификации активности МОС гепатоцитов позволит получить более чистые результаты, не обусловленные влиянием самих химических веществ на разные системы и органы организма. Более того, ингибитор CoCl2 дает примерно 30% смертность, что как с точки зрения гуманного отношения к экспериментальным животным, так и экономически не очень приемлемы. В нашем случае летальные исходы среди животных не наблюдаются.
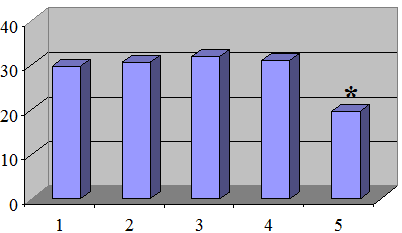
Рис. 4. Длительность гексеналового сна (в мин.) у мышей при введении адоптированных Т- и В-лимфоцитов: 1 - интактная группа; 2 - при введении В-лимфоцитов, полученных из контрольных мышей; 3 - при введении В-лимфоцитов, полученных из индуцированных мышей; 4 - при введении Т-лимфоцитов, полученных из контрольных мышей; 5 - при введении Т-лимфоцитов, полученных из индуцированных мышей
