Одним из ключевых элементов мониторинга нежелательных реакций (НР) после иммунизации является оценка степени достоверности причинно-следственной связи между примененной вакциной и клиническим событием. Клиническое событие, развившееся после вакцинации, далеко не всегда имеет причинную связь с вакциной как таковой. Неблагоприятные события в поствакцинальном периоде могут явиться результатом программных ошибок, реакциями на процедуру вакцинации или интеркуррентными заболеваниями, совпавшими по времени с введением вакцины [4, 6].
Практически полное отсутствие патогномоничных клинических симптомов, позволяющих однозначно судить о наличие связи НР с примененной вакциной, и ограниченное число диагностических критериев, позволяющих отвергнуть связь с вакцинацией, приводят к необходимости проведения тщательной дифференциальной диагностики с использованием всех клинических, лабораторных и инструментальных методов исследования [4, 5]. Важность однозначной оценки индивидуальных сообщений в отношении наличия или отсутствия причинно-следственной связи НР с вакцинацией, обусловлено, в том числе, существующей социальной поддержкой граждан в случае установления факта поствакцинального осложнения [1, 3].
Проведение сравнительного анализа подходов к экспертной оценке материалов по побочному действию вакцин, позволит определить основные направления по совершенствованию алгоритма расследования НР после иммунизации.
Целью настоящего исследования было изучение особенностей информации, используемой для проведения экспертизы случаев НР после применения вакцин и подходов к оценке степени достоверности причинно-следственной связи между вакцинацией и развившейся НР.
Материалы и методы. В ходе настоящего исследования был проведен ретроспективный анализ 686 спонтанных сообщений о НР, поступивших в отечественную базу данных АИС Росздравнадзор и 2155 стимулированных сообщений и медицинской документации, поступивших в базу данных ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП», за период с 1 января 2008 года по 31 декабря 2010 года включительно. Также в анализ были включены повторные сообщения о развитии НР при применении вакцин, поступившие в базу АИС Росздравнадзор, акты расследовании поствакцинальных осложнений (ПВО) и вся дополнительная медицинская документация, поступившие в ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП».
Оценка степени достоверности причинно-следственной связи (СД ПСС) спонтанных сообщений о НР, развившихся после вакцинации проводилась на основании рекомендованного Центром ВОЗ по международному мониторингу вопросника в соответствии с критериями ВОЗ [8]. По сообщениям, поступившим в базу ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП» проводился анализ экспертных заключений. Экспертиза случает развития НР, проводилась специалистами ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП».
За период с 1 января 2008 по 31 декабря 2011 г. был отобран 41 случай развития НР, информация о котором поступила одновременно в обе базы данных (сообщения-дубликаты), для проведения анализа подходов к оценке СД ПСС.
Результаты и обсуждение. При анализе качества информации поступающей в базы данных, выявлено, что помимо 2155 (100%) первичных сообщений (внеочередных донесений о ПВО) в ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП» для 2142 (99,4%) сообщений были присланы «Акты расследования осложнений после вакцинации». Для 403 (18,7%) сообщений по запросу, была прислана дополнительно медицинская документация: копии историй болезни или выписные эпикризы. По 11 случаям летальных исходов ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП» была запрошена и поступила дополнительная медицинская документация (индивидуальная карта беременной и родильницы, история родов, история развития новорожденного, история развития ребенка, карта профилактических прививок, заключение судебно-медицинского эксперта или патологоанатома), готовые гистологические препараты и/или формалиновый архив.
В базу АИС Росздравнадзор за анализируемый период помимо первичных карт-извещений дополнительная информация (повторные сообщения) была получена для 54 (7,9%) спонтанных сообщений и содержала данные в большей части касающиеся информации, которая отсутствовала в основных разделах карт-извещений в первичных сообщениях. Из сообщений, поступивших в базу данных АИС Росздравнадзор, 519 (75,7%) карт-извещений были заполнены полностью, частично заполненными оказались 78 (11,3%). В последних отсутствовала информация о серии препарата, торговом названии вакцины, введенной дозе. В 89 (13,0%) картах-извещениях отсутствовали основные данные для проведения экспертизы и установления причинно-следственной связи, в том числе отсутствовали даты начала и разрешения НР, даты введения препарата. В 495 (72,1%) сообщениях был заполнен раздел «Дополнительная информация». При этом, как видно из табл. 1, содержащиеся в нем сведения, в большей части дублировали информацию основных разделов карты-извещения.
Обращает внимание отсутствие в стандартной форме карты-извещения разделов, касающихся условий и режима хранения вакцины, которые являются необходимыми для данной группы препаратов. В результате, только в 28 (4,1%) сообщениях о развитии НР в разделе «Дополнительная информация» указана информация об условиях и температурном режиме хранения вакцины. Информация о повторном развитии НР при повторном назначении вакцины (dechallenge/rechallenge) во всех сообщениях не указывалась или указывалось, что повторно ЛС не назначалось. Несмотря на то, что данная информация имеет большое значение для определения СД ПСС терапевтических лекарственных средств, но, в связи с тем, что схема применения вакцин предполагает однократное введение препарата или введение с продолжительными интервалами, теряет свою информативность [6]. В 7 сообщениях (1,0%) указано о применении шкалы Naranjo клиническими фармакологами региональных центров для определения СД ПСС, выставляемой отправителем. Вместе с тем, шкала Naranjo и подобные стандартизованные шкалы, широко используемые для оценки СД ПСС, не рекомендуются в случае определения связи между НР и введенной вакциной [5, 8].
Таблица 1. Данные, указанные в разделе «Дополнительная информация»
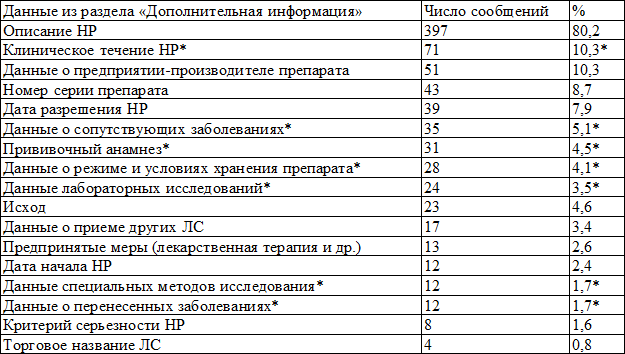
Примечание: * - приведена доля от общего числа сообщений, так как данная информация, может быть заполнена только в разделе «Дополнительная информация»
Оценка степени достоверности причинно-следственной связи (СД ПСС) между вакциной (или несколькими вакцинам) и возникшей НР по данным базы АИС Росздравнадзор, показала, что СД ПСС была расценена как «определенная» в 21 (3,1%) случае, «вероятная» - в 454 (66,2%), «возможная» - в 94 (13,7%), «сомнительная» - в 10 (1,5%), «условная» - в 12 (1,7%) случаях. Из-за недостаточной или противоречивой информации 95 (13,8%) случаев были расценены как «неклассифицируемые».
При оценке серьезных НР выявлено, что СД ПСС была расценена следующим образом: «вероятная» - в 64 (53,8%) случаях, «возможная» - в 50 (42,0%), «сомнительная» - в 1 (0,8%), «условная» - в 2 (1,7%), «неклассифицируемая» - в 2 (1,7%) случаях. При этом ПСС расцененная как «вероятная», касалась только сообщений о НР характеризующихся общими расстройствами и нарушениями в месте введения, а также реакциями гиперчувствительности. Из 119 сообщений о серьезных НР, в 73 (61,3%) сообщениях содержалась информация о НР, относящихся к перечню ПВО подлежащих обязательной регистрации и расследованию, а в случае подтверждения связи клинического события с примененной вакциной, дающих право на получения государственной денежной компенсации [1, 3]. СД ПСС в данных 73 сообщениях расценена как «вероятная» в 50 случаях, как «возможная» - в 22 случаях, как «сомнительная» - в 1 случае.
В табл. 2 представлены категории данных, указанные в спонтанных сообщениях о серьезных НР и использованные для проведения экспертизы и оценки СД ПСС.
Таблица 2. Данные использованные для экспертизы и оценки СД ПСС
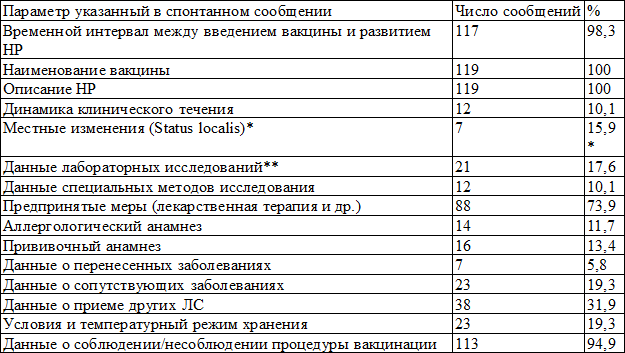
Примечания: * - для местных НР и осложнений, указана доля от сообщений о серьезных местных НР и осложнений; ** - в случае необходимости, включающие результаты бактериологических, вирусологических и серологических исследований и пр.
Оценка СД ПСС стимулированных сообщений проводилась на основании клинико-диагностических данных, по материалам Актов расследования ПВО и медицинской документации. В ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП» помимо оценки СД ПСС, для подтверждения диагноза ПВО проводилась дифференциальная диагностика неблагоприятных событий в поствакцинальном периоде. Так, из случаев, поступивших в базу стимулированных сообщений, за анализируемый период, по 3500 (99,8%) случаям были даны однозначные заключения как о СД ПСС, так и о числе случаев, относящихся к ПВО: 1756 (50,1%) случаев были расценены как ПВО, 1533 (43,7%) случаев - как поствакцинальные реакции, 211 (6,0%) случая - как интеркуррентные заболевания, не связанные с вакцинацией. В стадии расследования находились 5 (0,2%) случаев. Во многом такой оценке способствует комиссионное расследование серьезных НР специалистами лечебно-профилактических учреждений, где выявлен случай подозрительный на поствакцинальное осложнение, что является обязательной составляющей метода стимулированных сообщений [2].
Трудности в определении СД ПСС и невозможность дать однозначное заключение о наличие или отсутствие связи между вакцинацией и НР вызваны преимущественно недостаточностью данных присылаемых в базу АИС Росздравнадзор для проведения экспертизы. Дети первого полугодия жизни, прививаемые в соответствии с Национальным календарем профилактических прививок, фактически все время находятся в поствакцинальном периоде, поэтому крайне важно при проведении оценки ПСС между развитием НР и примененной вакциной в первую очередь исключить интеркуррентные заболевания [4]. Кроме того, учитывая схему применения вакцин, оказалось практически невозможно использовать информацию о факте отмены препарата и возобновлении его применения.
Заключения в отношении СД ПСС по 41 сообщению-дубликату, поступившему одновременно в обе базы данных, представлены в табл. 3.
Таблица 3. Заключения о СД ПСС сообщений-дубликатов
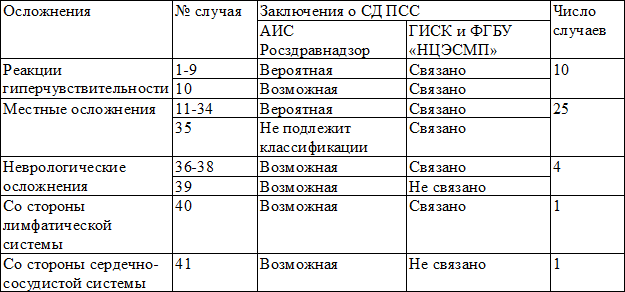
Выявлено, что в 32 (78,0%) случаях, где по данным, поступившим в ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП», была однозначно подтверждена связь НР с примененной вакциной, по данным АИС Росздравнадзор СД ПСС расценена как «вероятная». Стоит отметить, что указанные 32 случая, оцененные с высокой СД ПСС, касались только реакций гиперчувствительности (анафилактический шок, отек Квинке, сывороточная болезнь) и местных осложнений (поствакцинальный абсцесс, реакция в месте инъекции). В остальных 9 (22,0%) случаях по данным АИС Росздравнадзор СД ПСС расценена как «возможная» или «неклассифицируемая», в тоже время по данным ГИСК им. Л.А. Тарасевича и ФГБУ «НЦЭСМП» для данных 9 случаев были даны однозначные заключения в 7 случаях подтверждающие, 2 случаях отвергающие связь с вакцинацией.
По данным базы АИС Росздравнадзор, из 5 сообщений-дубликатов, касающихся развития анафилактического шока, только в 3 сообщениях было указано точное время (в часах и минутах) развития НР. Данные аллергологического анамнеза из 10 сообщений о реакциях гиперчувствительности указывались в 2 сообщениях, а прививочного анамнеза в 3 сообщениях. Из 12 сообщений о развитии поствакцинальных абсцессов результаты бактериального посева были указаны только в 5 сообщениях.
Сообщения о развитии неврологических осложнений, свищевой форме подмышечного лимфаденита и остром миокардите оказались наиболее трудными в определении СД ПСС, где по данным АИС Росздравнадзор ПСС была расценена как «возможная», которая не исключает связь клинического события с другими факторами и, в том числе, с интеркуррентными заболеваниями.
Считается, что только по данным спонтанных сообщений однозначно подтвердить или опровергнуть связь НР с вакцинацией в большинстве случаев оказывается крайне затруднительно. Выставление однозначного заключения, в отсутствии дополнительных данных, в том числе по случаям, предполагающим государственную денежную компенсацию, оказывается невыполнимым. Кроме того, недостаточно документированные случаи могут необоснованно попасть в категорию «сигнальной» информации [5, 7].
Выводы
Анализ и оценка СД ПСС между НР и примененной вакциной по данным метода спонтанных сообщений затруднены, в связи с недостаточностью информации, содержащихся в стандартных формах карт-извещений.
Как правило, дать однозначное заключение о связи серьезной НР с примененной вакциной по данным, полученным с помощью метода спонтанных сообщений, не представляется возможным.
Данные полученные с помощью метода стимулированных сообщений, обеспечивают более полную и качественную информацию для проведения экспертизы случаев НР и осложнений.
Данные полученные с помощью метода стимулированных сообщений имеют определенные преимущества и позволяют давать однозначную оценку наличия или отсутствия связи НР/осложнения с примененной вакциной, что обусловлено, в том числе, возможностью использования для оценки первичной медицинской документации.
Представляется целесообразным дополнение стандартной формы бланка спонтанного сообщения такими разделами как «Условия и температурный режим хранения и транспортирования препарата», а также вынесение в отдельный раздел для заполнения такой информации как «Данные прививочного анамнеза».
Для осуществления более точной оценки СД ПСС спонтанных сообщений целесообразно установить порядок предоставления дополнительной медицинской документации (например, выписных эпикризов, включающих результаты лабораторных и специальных методов исследования) при развитии серьезных НР.
