Актуальность. Своевременная и адекватная терапия первичных иммунодефицитных состояний позволяет достичь стабильного общего состояния больных, социальной адаптации при большинстве этих заболеваний [2]. Классификация нарушений функционального состояния иммунной системы позволит оказать помощь практическому врачу в формировании правильного диагноза, определении методов лечения на основе современных представлений о патогенезе и клинике заболевания. Также она необходима для статистического анализа, разработки медико-экономических стандартов диагностики и лечения больных и проведения сравнительного анализа ситуации в разных медицинских учреждениях [1, 2, 4].
Среди первичных иммунодефицитов, требующих регулярного динамического наблюдения и лечения у врача-иммунолога в течение всей жизни, включенных в региональный регистр и данное исследование, практически в равной мере присутствовали антительные дефекты (35,7%), дефекты фагоцитов (28,6%), а также группа других, хорошо определяемых форм врожденной иммунной недостаточности (35,7%) [3, 5].
Липиды мембран иммунокомпетентных клеток служат молекулярной основой, определяющей их структурные и функциональные свойства [6, 7]. Они принимают непосредственное участие в процессах активации, пролиферации Т- и В-лимфоцитов [3, 4, 7], усилении продукции медиаторов иммунного ответа [8], регуляции функции макрофагов и полиморфных лейкоцитов [1, 5]. Несмотря на важное значение липидов в определении индивидуального типа реакции иммунной системы, данные о связи функций иммуннокомпетентных клеток с изменением мембранных липидов отсутствуют.
Цель исследования: изучить состав липидов мембран в иммунокомпетентных клетках морских свинок в норме и при развитии иммунодефицитного состояния на фоне воздействия гербицида толуина (растворитель демитилсульффоксид).
Материалы и методы исследования: морские свинки массой 175-250 г содержались на обычном рационе вивария. Материалом для исследования служили кровь, лимфоциты крови, ткани печени, тимуса, селезенки, костного мозга.
Модель иммунодефицитного состояния создавали подкожным введением 2,5% раствора толуина в течение 7 и 14 дней из расчета 1,2 и 2,5 мг на 1 кг массы тела.
О состоянии иммунного статуса судили по изменению показателей иммунных реакций (Т-, В-, О- и общих лимфоцитов, спонтанного реакция бласттрансформации лимфоцитов из фитогемагглютинин, лизоцима, комплемента).
Лимфоциты из периферической крови выделяли на градиенте фиколл-верографии. Их жизнеспособность определяли путем окраски 0,3% раствором трипанового синего с последующим подсчетом в камере Горяева.
Липиды из тканей и лимфоциты экстрагировали методом Фольча [8]. Фракционирование проводили методом одномерной хроматографии в тонком слое силикогеля [4]. Для фосфолипидов использовали систему хлороформ – метанол – уксусная кислота – вода (в соотношении 65:43:1:4), а для ганглиозидов – хлороформ – метанол – аммиак – вода (в соотношении 60:35:2:8:3,2). Соответствующие зоны фосфолипидов и ганглиозидов выявляли по цветным реакциям и парами йода, нанесением свидетелей. Фосфолипиды, определяли по содержанию неорганического фосфора, ганглиозиды – по количеству н-ацетилнейраминовой кислоты [4].
Результаты исследования. Введение толуина сопровождалось развитием иммунодефицитного состояния, выражающегося в изменении иммунитета (см. табл. 1).
Таблица 1. Показатели иммунитета у морских свинок при введении толуина в течение 7 (числитель) и 14 (знаменатель) дней
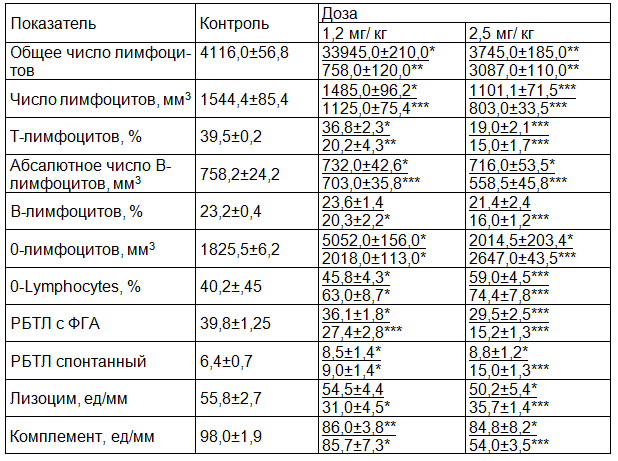
Примечания: РТБЛ - реакция бластной трансформации лимфоцитов, ФГА – фитогемагглютинин, * - достоверность данных к показателям контроля (* - P> 0,5-0,1;** P>0.05-0.02;*** P<0.01-0.001).
Низкие дозы гербицида приводили к менее умеренным, а высокие – к более выраженным изменениям. Максимальное отклонение показателей иммунитета по сравнению с нормой наблюдалось на 14-й день при введении толуина в дозе 2,5 мг/кг.
Общие, Т- и В-лимфоциты снижались по сравнению с контролем на 40-50%, реакция бласттрансформации лимфоцитов с фитогемагглютинином– на 62%, лизоцим – на 36%, комплемент – на 45%. Содержание О-лимфоцитов, напротив, повышалось на 85%. Увеличивался спонтанный реакция бласттрансформации лимфоцитов в 2,4 раза.
Эти данные свидетельствуют о развитии иммунодефицитного состояния, выраженность которого зависит от дозы ядохимиката и длительности его поступления в организм.
На фоне иммунодефицитного состояния в лимфоцитах крови, органах иммунной системы (тимус, селезенка, костный мозг) и печени происходили изменения в количественном составе индивидуальных фосфолипидов и ганглиозидов, выраженность которых также зависела от дозы. Наиболее выраженные изменения в липидном составе отмечены на 14-й день при введении 2,5 мг/кг гербицида.
Наблюдалось снижение содержания фосфадилхолина, фосфатидилэтаноамина, фосфадилинозита и повышение содержания сфингомиелина, фосфатидилсерина, кардилипина, фосфатидной кислоты, лизофосфатидилхолина. Снижалось содержание общих фосфолипидов.
Следует отметить, что изменения индивидуальных фосфолипидов во всех изученных органах и лимфоцитах крови были однотипны, по различной выраженности. Наиболее значительные изменения отмечались в печени и лимфоцитах крови.
Во всех изученных органах и лимфоцитах крови изменялось содержание индивидуальных ганглиозидов, которое также зависело от дозы ядохимиката. Максимальные отклонения в составе ганглиозидов отмечались при высоких дозах толуина. Следует отметить снижение всех классов и общих ганглиозидов. Причем изменение количества индивидуальных и общих ганглиозидов во всех изученных органах и лимфоцитах также носит стереотипный характер, отличающийся по своей выраженности.
Результаты изучения липидного состава мембран иммунокомпетентных клеток указывают на наличие взаимосвязи изменений иммунологических показателей и липидного состава лимфоцитов крови, органов иммунной системы и печени. Изменения в составе липидов печени свидетельствуют не только о мембранотропном иммунодепрессивном, но и о гепатотропном действии гербицида.
Видимо, изменения в составе липидов связаны с нарушением химического гомеостаза и усилением процессов образования лимфоцитов, ведущим к деструктивным явлениям. Повышение содержания лизофосфатидилхолин, видимо, обусловливает активацию лизосомальных ферментов (фосфолипаза, спалидаза и т.д.).
Следует отметить, что ганглиозиды, неразрывно связанные с фосфолипидами, расположены на наружной стороне липидного бислоя. Они не только определяют структурную ригидность, но и внедряются во внутреннюю часть мембраны, а ее пирамидная часть образует водородные связи со специфическими мембранными белками, вызывая конформационные превращения белков, обеспечивая рецепторные их функции [7, 8]. Следовательно, ганглиозиды, окружая функциональный белок, служат в качестве кофакторо-мембранных ферментов и функциональных белков и играют важную роль в регуляции функции этих белков.
Снижение содержания ганглиозидов, очевидно, обусловливает нарушение функций мембранных белков. Кроме того, при снижении содержания ганглиозидов уменьшается ригидность мембраны и нарушается ионная проницаемость.
Фосфолипиды играют важную роль в процессах активации и пролиферации лимфоцитов. Изменение в фосфолипидном составе лимфоцитов обусловливает ряд нарушений. Так, процесс активации лимфоцитов связан с увеличением лизофосфатидилхолин, который повышает подвижность мембран. Снижение его содержания, безусловно, отражается на ее подвижности и этим самым нарушает, видимо, нерекисное связывание рецепторов [4].
Изменение содержание сфингомиелин в лимфоцитах также, видимо, сопровождает нарушения подвижности мембран, что, вероятно, ведет к нарушению агрегации рецепторов, снижая пролиферативную активность. Особенно важным является снижение содержания фосфадилинозит, играющего важную роль в процессах активации пролиферации Т и В лимфоцитов.
Снижение содержание фосфатидилэкаламин, фосфадилинозит в лимфоцитах иммунной системы, видимо, обусловливает нарушения в механизме трансмембранного переноса активационного сигнала внутрь клеток, сопровождаемое снижением функциональной активности лимфоцитов.
Таким образом, непосредственное участие мембранных липидов активации, продукции медиаторов иммунного ответа, в регуляции фагоцитоза и цитотоксических реакций определяет важное значение гоместаза мембранных липидов в стабилизации иммунных реакций организма. Дисбаланс липидных компонентов иммунокомпетенных клеток под влиянием экзогенных или эндогенных факторов, видимо, сопровождает процессы активации и регуляции иммунного ответа, обусловливая развитие иммунодефицитного состояния. В этой связи проблема весьма распространенных вторичных иммунодефицитов, видимо, должна рассматриваться с позиции молекулярных механизмов.
Выводы
1. Снижение содержания ганглиозидов, обусловливает нарушение функций мембранных белков. Снижение содержания ганглиозидов приводит к уменьшению ригидности мембраны, нарушая ионную проницаемость.
2. Изменение в фосфолипидном составе лимфоцитов обусловливает ряд нарушений, связанных с увеличением содержания лизофосфатидилхалина, который повышает подвижность мембран, в связи, с чем нарушается перекисное связывание рецепторов и снижается пролиферативная активность.
3. Снижение содержания фосфадилхолин, фосфодилинозит в лимфоцитах иммунной системы, видимо, обусловливает нарушение в механизме трансмембранного переноса активационного сигнала внутрь клеток сопровождаемого снижением функциональной активности лимфоцитов.
