Введение. Инфицирование вирусом папилломы человека (ВПЧ) является основным этиологическим фактором развития цервикальной интраэпителиальной неоплазии (CIN) и рака шейки матки [1,2].
По данным Всемирной организации здравоохранения (ВОЗ) в 50-62% наблюдений в течение 3 лет ВПЧ – ассоциированные поражения эпителия шейки матки подвергаются регрессии при отсутствии отягощающих факторов, таких как возраст старше 30 лет, большое количество половых партнеров, отсутствие барьерных методов контрацепции, нарушения гормонального гомеостаза.
По сведениям учёных Калифорнийского университета (США) у 70% молодых ВПЧ-инфицированных женщин дезоксирибонуклеиновая кислота (ДНК) ВПЧ перестаёт определяться в эпителии шейки матки в течение 24 мес.
До настоящего времени остается неясным, почему в одних случаях происходит спонтанная элиминация ВПЧ, а в других наблюдается персистенция вируса. Можно предположить, что ключевую роль в этом процессе играют локальные иммунные механизмы, в частности цитокиновая регуляция локального иммунного ответа на ВПЧ. Нарушение данной регуляции, проявляющееся в преобладании противовоспалительных цитокинов над провоспалительными, возможно, повышает вероятность персистенции вируса в организме, что может способствовать формированию неопластических процессов.
Целью настоящего исследования являлось изучение уровней про- и противовоспалительных цитокинов в цервикальном отделяемом женщин с цервикальной интраэпителиальной неоплазией и у женщин с латентной формой папилломавирусной инфекции.
Материал и методы. В исследование вошли 60 женщин в возрасте от 20 до 40 лет с ВПЧ-ассоциированным поражением шейки матки, которые были разделены на 2 группы с использованием метода «случай-контроль». В 1 группу были включены 30 женщин с латентной формой, во 2 группу - 30 женщин с CIN.
Выделение форм ВПЧ-поражения эпителия шейки матки выполнялось на основании классификации ВПЧ-ассоциированных поражений нижнего отдела гениталий [3].
Диагноз CIN установливался на основании гистологического заключения согласно классификации ВОЗ. Из 30 женщин с CIN у 11 женщин была CIN I, у 12 женщин - CIN II и у 7 женщин - CIN III. Диагноз латентной формы ВПЧ-ассоциированного поражения шейки матки уставлен на основании отсутствия клинических, морфологических, цитологических изменений при наличии дезоксирибонуклеиновой кислоты (ДНК) ВПЧ в клетках эпителия шейки матки.
У всех женщин была выявлена ДНК вируса папилломы человека 16 типа методом полимеразной цепной реакции (ПЦР) с использованием типичных праймеров (L1C1/L1C2/L1C2M) для области L1 вируса папилломы человека [4].
Особенности цитокиновой регуляции локального иммунитета шейки матки оценивалась на основании концентрации уровней цитокинов: интерферона гамма (ИФНγ), интерлейкина 1 бета (ИЛ-1β), интерлейкина 10 (ИЛ-10) в цервикальном отделяемом.
Уровни цитокинов определялись методом иммуноферментного анализа (ИФА) с использованием тест-системы «ProCon». Забор цервикального отделяемого осуществлялся с помощью глазной губки [5,6,7,8].
Статистическая обработка проводилась с использованием программы «Statistica 8.0». Результаты выражались в виде медианы и интерквартильного размаха и считались статистически значимыми при р<0,05. Сравнение двух независимых групп выполнялось с использованием непараметрического критерия Манна-Уитни.
У всех женщин, включенных в исследование, было получено письменное информированное согласие на участие в исследовании.
Результаты и обсуждение. В результате сравнительного анализа концентраций цитокинов в цервикальном отделяемом было выявлено статистически значимое повышение уровня ИЛ-10 у пациенток с цервикальной интраэпителиальной неоплазией в сравнении с женщинами с латентной формой (60 [25;85] пг/мл и 41 [25;55] пг/мл соответственно, p=0,009 (рис.1).
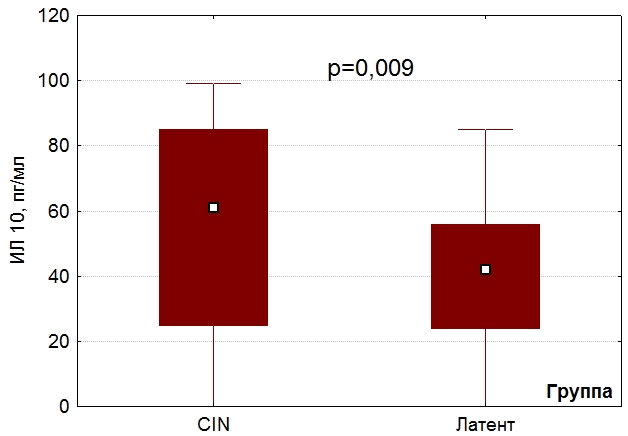
Рис. 1. Концентрация ИЛ-10 у женщин с CIN и у женщин с латентной формой ВПЧ.
ИЛ-10 относится к группе противовоспалительных цитокинов и является ингибитором активности Т-хэлперов 1 типа (Th1-клеток). Он синтезируется Т-хэлперами 2 типа (Th2-клетками), моноцитами и цитотоксическими Т-клетками. Основная функция ИЛ-10 состоит в угнетении синтеза цитокинов Th1-клетками и в снижении активности макрофагов, в том числе продукции провоспалительных цитокинов. В то же время ИЛ-10 является синергистом ИЛ-4 и повышает синтез иммуноглобулинов M и A (IgM, IgA).
Таким образом, ИЛ-10 является важным регулятором иммунного ответа, подавляющим активность макрофагов и Th1-клеток, в результате чего осуществляется цитотоксический ответ макроорганизма, а также обеспечивает реализацию некоторых биологических эффектов Th2-клеток, что способствует развитию гуморальной составляющей иммунного ответа, обусловливая аллергическую реактивность организма. Но избыток ИЛ-10 ведет к снижению противоинфекционной защиты и развитию хронических инфекций. Также полагают, что ИЛ-10 способствует стимуляции опухолевого роста в результате ингибирования T-клеточного иммунного ответа.
Наряду с повышением концентрации ИЛ-10 у пациенток с цервикальной интраэпителиальной неоплазией в сравнении с пациентками, у которых имелась латентная форма, отмечалось уменьшение концентраций ИЛ-1β (180[20;250] пг/мл и 230[130;370] пг/мл, p=0,033) (рис.2) и ИФНγ (4[0;12] пг/мл и 10 [0;18] пг/мл, p=0,05) (рис.3).
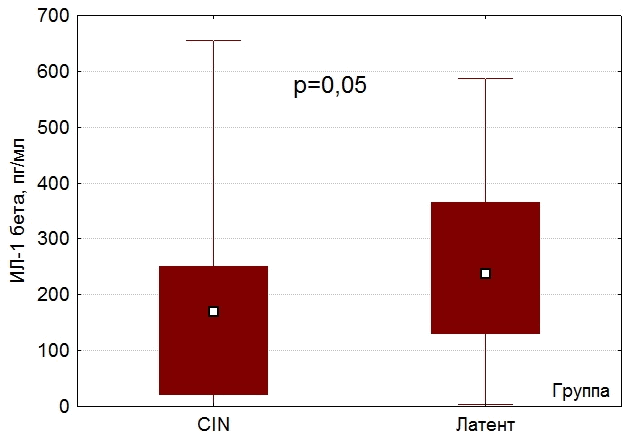
Рис. 2. Концентрация ИЛ-1β у женщин с CIN и у женщин с латентной формой ВПЧ.
ИФНγ образуется при стимуляции различными антигенами Т-лимфоцитов. По большинству своих свойств ИФНγ активирует мононуклеарные фагоциты; повышает экспрессию молекул МНС I и II класса; непосредственно влияет на дифференцировку Т и В лимфоцитов; активирует нейтрофилы и естественные киллеры; является активатором васкулярных эндотелиальных клеток. Одним из первых было открытие противовирусного действия ИФН, проявляющееся как против неонкогенных, так и онкогенных вирусов.
ИЛ1 – полипептид впервые был описан как фактор, производимый мононуклеарными фагоцитами и усиливающий Т-клеточный ответ на антигены или поликлональные активаторы, то есть костимулятор Т-клеточной активации. Исследование генов ИЛ1 показало, что существует два различных белка – ИЛ-1α и ИЛ-1β, имеющие сходную активность и молекулярную массу и различающиеся по изоэлектрической точке. Считается, что ИЛ-1 является лидирующим среди цитокинов воспаления [9].
Выводы. Полученные данные свидетельствуют о преобладании противовоспалительных цитокинов в цервикальном отделяемом над провоспалительными в регуляции локального иммунного ответа у пациенток с CIN в сравнении с пациентками, имеющими латентное течение ВПЧ -инфекции. Таким образом, дисбаланс цитокинов в цервикальной слизи является одним из факторов риска развития CIN в результате персистенции ВПЧ в эпителии шейки матки.
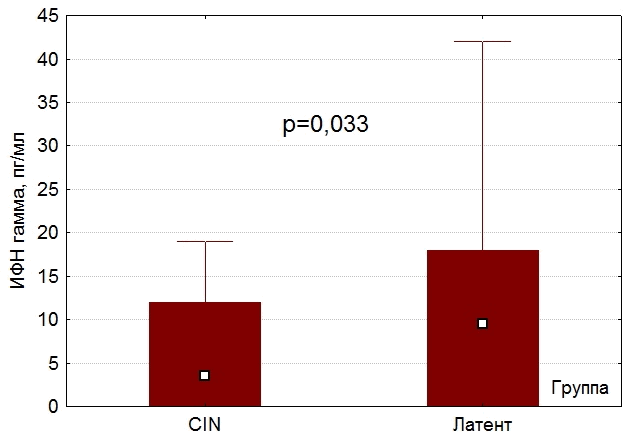
Рис. 3. Концентрация ИФН-γ у женщин с CIN и у женщин с латентной формой ВПЧ.
Заключение. На основании полученных данных можно предположить, что дисбаланс цитокиновой регуляции локального иммунного ответа с преобладанием противовоспалительных цитокинов является важным фактором, поддерживающим персистенцию ВПЧ в эпителии шейки матки и способствующим развитию и прогрессированию CIN. В то же время, повышенный уровень провоспалительных цитокинов, возможно, играет важную роль в процессе элиминации ВПЧ.
Изучение взаимосвязи между концентрациями ключевых цитокинов локального иммунного ответа в шейке матки и установление связи с развитием CIN может позволить понять механизмы персистенции и иммунологического контроля над ВПЧ при его внедрении в эпителий.
В дальнейшем это позволит разработать и внедрить в клиническую практику более совершенные скрининговые мероприятия для выявления женщин с высоким риском развития CIN и рака шейки матки.
