Введение. Одной из актуальных проблем современной медицины является высокая заболеваемость герпесвирусными инфекциями. Герпесвирусы широко распространены в человеческой популяции, они способны поражать практически все органы и системы хозяина, вызывая латентную, острую и хроническую формы инфекции. Это позволяет рассматривать герпес как системное заболевание организма [5-7].
Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией, с недостаточностью различных звеньев иммунной системы, могут вызывать тяжелые заболевания со смертельным исходом. Вирусы герпеса поражают эритроциты, тромбоциты, лейкоциты и макрофаги, способны длительно персистировать в организме, формируя нестерильный иммунитет. Вируснейтрализующие антитела сохраняются в течение всей жизни в высоких титрах, но они не предупреждают возникновение иммунодефицита и реактивации инфекции [6, 9, 10].
Альфа-герпес-вирусы, включающие вирусы простого герпеса 1-го и 2-го типа, вирус опоясывающего герпеса (herpes-zoster), характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция альфа-герпес-вирусов протекает в различных типах клеток и могут сохраняться в латентной форме, преимущественно в нервных ганглиях [9, 10].
Опоясыващий герпес развивается как вторичная эндогенная инфекция у лиц, перенесших ветряную оспу в клинически выраженной, стертой или латентной форме вследствие реактивации вируса varicella zoster (ВЗ), интегрированного в геном клеток черепно-спинальных сенсорных ганглиев. Механизм реактивации вируса ВЗ недостаточно изучен. К факторам риска относят пожилой возраст и старческий, сопутствующие заболевания, прежде всего онкологические, гематологические, ВИЧ-инфекция, применение кортикостероидов, цитостатиков, лучевая терапия, трансплантацию органов. Реактивация вируса может быть спровоцирована стрессовыми состояниями, физическими травмами, переохлаждением, инфекционными заболеваниями, алкоголизмом [7, 9, 10].
В результате активизации вируса varicella zoster развивается ганглионеврит с поражением межпозвоночных ганглиев, ганглиев черепно-мозговых нервов и задних корешков. В процесс могут вовлекаться вегетативные ганглии, вещество и оболочки головного и спинного мозга. Распространяясь по нервным стволам вирус попадает в клетки эпидермиса и вызывает в них воспалительные дегенеративные изменения, что проявляется соответствующими характерными высыпаниями в пределах дерматома. Возможно и гематогенное распространение вируса, о чем свидетельствуют возникновение генерализованных высыпаний, наличие вируса на слизистых оболочках [7, 9].
В процессе длительной эволюции и в связи с вынужденным сосуществованием вирусов в организме человека герпесвирусы выработали различные молекулярные механизмы защиты от распознавания и элиминации иммунной системой. Механизмы уклонения вируса от иммунного ответа в целом могут быть разделены на три группы: 1) изменения иммуннодоминантных эпитопов вирусов; 2) препятствие клеточному иммунитету, подавление презентации вирусных пептидов и подавления активности натуральных киллеров (HK-клеток); 3) подавление реализации эффекторных функций, например, экспрессии цитокинов, а также апоптоза инфицированных клеток. Так вирусы кодируют гомологи цитокинов, хемокинов, растворимых форм мембранных антигенов – молекул, которые играют важную роль в контроле иммунного ответа [6, 11, 12].
Четверть века назад было обнаружено, что у белков, присутствующих на мембране клеток иммунной системы, могут быть растворимые гомологи. Такие гомологи обнаруживаются в биологических жидкостях, и в том числе в крови, в разных концентрациях. Основной способ образования растворимых форм мембранных антигенов клеток иммунной системы - это протеолитическое отщепление внеклеточной части мембранных белков с поверхности клеток, называемое протеолитическим шеддингом (слущиванием, сходом), или кливеджем (расщеплением) [1, 2]. Шеддинг чаще всего является следствием активационных процессов, затрагивающих различные популяции клеток. Растворимые формы мембранных антигенов участвуют в регуляции иммунологических механизмов на разных этапах реализации иммунного ответа. Существует тесная связь между цитокиновой сетью и пулом растворимых антигенов. Механизмы регулирующего действия растворимых форм мембранных антигенов клеток довольно разнообразны. Растворимые антигены исполняют роль клеточных коммуникаторов. При этом в клетку может передаваться сигнал, изменяющий ее функциональное состояние, что может оказывать влияние на состояние Т-клеточного иммунитета, на формирование Т-эффекторного потенциала иммунной системы. Изменение концентрации растворимых антигенов, по-видимому, может давать важную мониторинговую, прогностическую информацию и характеризовать глубину иммунодефицита при герпетической инфекции [3, 4, 7].
Различают три основных группы мембранных белков клеток иммунной системы, имеющих растворимые формы.
Первая из них – это молекулы главного комплекса гистосовместимости. У человека продемонстрировано существование растворимых форм молекул HLAI и II классов [7, 8].
Вторая группа мембранных белков клеток иммунной системы, имеющих растворимые формы, - это рецепторы цитокинов. К этой обширной группе растворимых антигенов относятся растворимые рецепторы интерлейкинов – 1, 2, 4, 5, 6, 7, 9, рецептор интерферона альфа (ИНФα) и фактора некроза опухоли (ФНО).
К третьей категории мембранных антигенов, имеющих растворимые изоформы, можно отнести обширную группу дифференцировочных антигенов, представленных разнообразными белками, принимающих участие в созревании клеток иммунной системы и выполнении ими своих эффекторных функций [6, 7, 8].
Наибольшее практическое значение имеют следующие растворимые дифференцировочные антигены: CD18, CD50, CD54, CD95, HLAI.
sСD18 – принимает участие в механизмах адгезии лейкоцитов к ламинину, фибронектину, коллагену I и IY типа.
sСD50 – способствует презентации антигена Т-лимфоцитам и активации Т-лимфоцитов.
sCD54 – играет важную роль в механизмах адгезии и участвует в формировании иммунологического синапса.
sCD95 - один из клеточных рецепторов, инициирующих апоптоз.
sHLAI – обеспечивает распознавание иммунной системой чужеродных антигенов и аутоантигенов.
Результатом взаимодействия вируса и макроорганизма является активация механизмов апоптоза, адгезии, активация Т-лимфоцитарных реакций, распознавание чужеродных антигенов, формирование иммунологического синапса. Медиаторы иммунного ответа и растворимые формы дифференцировочных антигенов могут характеризовать различные механизмы взаимодействия возбудителя и макрооргазима. Поэтому, мы можем оценивать содержание растворимых форм дифференцировочных антигенов у больных с герпетической инфекцией с целью прогнозирования течения болезни и эффективности противовирусной и иммунокорригирующей терапии [3, 4, 6].
Цель работы: оценить содержание растворимых форм дифференцировочных антигенов у больных с опоясывающим герпесом в зависимости от клинических и лабораторных показателей; у больных с развитием постгерпетической невралгии; в процессе динамического наблюдения.
Материалы и методы. Показатели иммунного ответа изучались у 62 больных с опоясывающим герпесом (30 мужчин, 32 женщины) в возрасте от 35 до 85 человек (средний возраст – 66,4±4,2 лет). Младшую возрастную группу (менее 60 лет) составили 15 пациентов, старшую возрастную группу (более 60 лет) - 47 больных. Среднетяжелая форма болезни отмечена у 52 пациентов, тяжелая форма – у 10 больных, постгерпетическая невралгия (ПГН) - у 18 пациентов.
Диагноз опоясывающего герпеса (ОГ) устанавливали на основании данных анамнеза, клинических данных (односторонние везикулярные высыпания по ходу нервных окончаний, сопровождающиеся выраженным болевым синдромом).
Содержание растворимых форм дифференццировочных антигенов (sCD95, sCD18, sCD50, sHLAI, sCD54) изучалось методом иммуноферментного анализа с применением моноклональных антител (АТ) ИКО 20 и поликлональных АТ к антигенам мононуклеарных клеток периферической крови человека (Нижегородский Институт молекулярной биологии и региональной экологии ННГУ им. Н.А. Лобачевского, директор института – д.б.н. профессор В.В. Новиков).
В контрольную группу вошли 60 здоровых доноров, сопоставимых по возрасту и полу с основной группой. Средние показатели sCD95, sCD18, sCD50, sHLAI, sCD54 в контрольной группе составили соответственно 374,5±23,4 U/ml, 120,1±10,6 U/ml, 57,7±6,7 U/ml, 74,1±5,9 U/ml, 168,7±17,7 U/ml.
Статистическая обработка фактического материала и анализ результатов, полученных при исследованиях, выполнялись на компьютере с использованием пакета программ «Биостат». Применялись статистические критерии Стьюдента, Вилкоксона-Манна-Уитни. Различия считались достоверными при р<0,05.
Результаты исследования. Оценка содержания растворимых форм дифференцировочных антигенов проводилась у мужчин, женщин, у больных старшей возрастной группы (более 60 лет) и младшей возрастной группы (менее 60 лет), со среднетяжелым и тяжелым течением болезни.
Было установлено, что у женщин определялась тенденция к более высоким показателям растворимых форм дифференцировочных антигенов, характеризующих механизмы активации апоптоза, адгезии, Т-эффекторных механизмов, распознавание чужеродных антигенов (sCD95, sCD18, sCD50, sHLAI) по сравнению с мужчинами (табл. 1).
Выявлено, что у больных в младшей возрастной группе содержание sCD95, sCD18, sCD50, sCD54 было несколько выше по сравнению с пациентами старшей возрастной группы (табл. 1). Необходимо отметить, что отсутствовали достоверные различия содержания растворимых форм дифференцировочных антигенов в исследуемых группах больных в зависимости от пола и возраста.
Проведена оценка содержания растворимых форм дифференцировочных антигенов у больных с опоясывающим герпесом в зависимости от тяжести течения болезни. Содержание антигенов, характеризующих активность апоптоза и адгезии (sCD95, sCD18) у больных со среднетяжелым течением были существенно выше по сравнению с тяжелыми формами (табл. 1).
Таблица 1. Содержание растворимых дифференцировочных антигенов у мужчин и женщин, старшей и младшей возрастной группы, при разных формах тяжести и развитием ПГН у больных ОГ (данные первичного обследования, U/ml, * - различия достоверны)
Одной из задач исследования было изучение содержания растворимых форм дифференцировочных антигенов в зависимости от наличия постгерпетической невралгии (ПГН).
В ходе дальнейшего анализа наблюдаемые больные были разделены на две группы с наличием и отсутствием ПГН. Эти пациенты были проанализированы по полу, возрасту, тяжести течения, сопутствующим заболеваниям, лабораторным данным и иммунологическим показателям.
Было отмечено, что среди больных с ПГН несколько чаще встречались женщины (77%, 14), чем в сравнительной группе (54%, 24). Однако, эти различия оказались недостоверны.
Среди больных с ПГН с высокой частотой были зарегистрированы пациенты старшей возрастной группы (72%, 13) по сравнению с младшей возрастной группой (34%, 15).
Было выявлено, что в группе больных с ПГН значительно чаще выявлялись пациенты с тяжелым течением болезни (44%, 8) по сравнению с пациентами, у которых отсутствовала ПГН (4%, 2).
Оценивая локализацию высыпаний, можно было отметить значительно более частые высыпания на голове (72%, 13) при ПГН по сравнению с локализацией на туловище (34%, 15).
При изучении сопутствующих заболеваний было установлено, что у больных с ПГН они встречались значительно чаще (83%, 15) по сравнению с группой, у которой отсутствовала ПГН (40%, 18).
Было выявлено, что воспалительная реакция крови чаще регистрировалась у больных с отсутствием ПГН (46%, 20) по сравнению с больными с наличием ПГН (28%, 5).
При оценке уровня мочевины крови можно отметить, что у больных с ПГН значительно чаще определялись повышенные показатели (11%, 2) по сравнению с пациентами, у которых отсутствовала ПГН (4%, 2).
Следующим этапом исследования было изучение содержания растворимых форм дифференцировочных антигенов у больных с ПГН по сравнению с пациентами, у которых отсутствовало это осложнение.
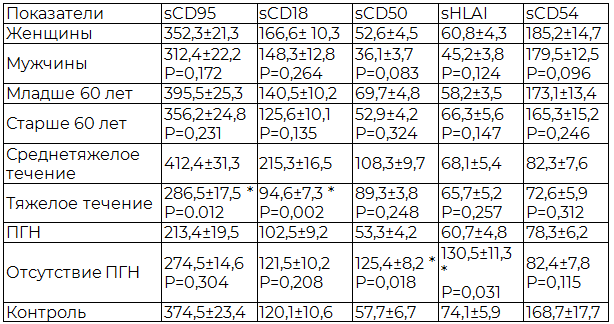
Было выявлено существенно более низкое содержание растворимых форм антигенов, характеризующих активацию Т-лимфоцитов и механизмы распознавания чужеродных антигенов (sCD50, sHLAI) у больных с формированием ПГН по сравнению с пациентами, у которых отсутствовало это осложнение (рис. 1).
Проводилась оценка содержания растворимых форм дифференцировочных антигенов у больных с опоясывающим герпесом в процессе динамического наблюдения. Изучение содержания дифференцировочных антигенов проводилось в группе больных с циклическим течением и в группе больных с формированием постгерпетической невралгии.
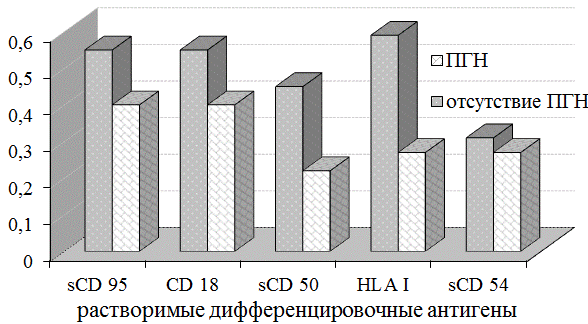
Рис. 1. Частота повышения растворимых дифференцировочных антигенов у больных с опоясывающим герпесом, осложненным постгерпетической невралгией.
Пациенты наблюдались в течение 4-х недель. Уровень растворимых форм дифференцировочных антигенов у больных с опоясывающим герпесом с циклическим течением снижался к 4-й неделе наблюдения. Было выявлено существенное снижение содержания sHLAI к 4-й неделе наблюдения (рис. 2). В процессе динамического наблюдения содержание sCD95, sCD18, sCD54 снижались незначительно.
У больных с постгерпетической невралгией уровень растворимых форм дифференцировочных антигенов в процессе динамического наблюдения изменялся несущественно. Сохранялись монотонно-низкие показатели растворимых форм дифференцировочных антигенов.
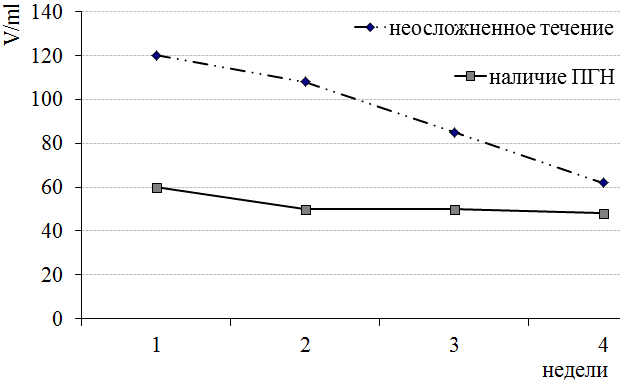
Рис. 2. Содержание sHLAI у больных с опоясывающим герпесом в процессе динамического наблюдения при различных вариантах течения болезни.
Обсуждение. У больных с опоясывающим герпесом проводили изучение содержания растворимых форм дифференцировочных антигенов, характеризующих активность апоптоза (sCD95), адгезию лейкоцитов (sCD18), активность Т-лимфоцитов (sCD50), формирование иммунологического синапса (sCD54).
На основании проведенных исследований выявлено, что у женщин, у пациентов младшей возрастной группы большинство изучаемых показателей (sCD95, sCD18, sCD50, sCD54) были несколько выше, чем у мужчин и пациентов старшей возрастной группы. Хотя эти различия были недостоверны.
Показатели растворимых форм дифференцировочных антигенов определялись у больных с опоясывающим герпесом со среднетяжелым и тяжелым течением болезни. Было установлено, что у пациентов со среднетяжелым течением болезни показатели активации апоптоза (sCD95) и адгезии лейкоцитов (sCD18) были существенно выше по сравнению с тяжелым течением болезни. Это, по-видимому, характеризовало слабость иммунного ответа, неэффективность апоптотических механизмов у больных с тяжелым течением инфекции.
В ходе дальнейшего анализа наблюдаемые больные были разделены на две группы с наличием и отсутствием ПГН. Эти пациенты были проанализированы по полу, возрасту, тяжести течения, сопутствующим заболеваниям, лабораторным данным и иммунологическим показателям.
Среди больных с ПГН с высокой частотой были зарегистрированы пациенты старшей возрастной группы, с тяжелым течением болезни, с локализацией высыпаний в области головы, с сопутствующими заболеваниями, с повышенным уровнем мочевины крови.
Было установлено, что у пациентов с ПГН показатели активации Т-лимфоцитов (sCD50) и показатели, характеризующие распознавание чужеродных антигенов (sHLAI), существенно ниже по сравнению с больными с отсутствием этого осложнения. Это характеризовало слабость Т-клеточных механизмов и механизмов распознавания чужеродных антигенов, что, возможно, приводило к более длительной персистенции вируса и формированию ПГН.
Проводилась оценка содержания растворимых форм дифференцировочных антигенов у больных с опоясывающим герпесом в процессе динамического наблюдения. Уровень растворимых форм дифференцировочных антигенов у больных с опоясывающим герпесом с циклическим течением снижался к 4-й неделе наблюдения. Было выявлено существенное снижение содержания sHLAI к 4-й неделе болезни, что характеризовало уменьшение антигенного раздражения и снижение активности Т-эффекторных механизмов. В процессе динамического наблюдения содержание sCD95, sCD18, sCD54 снижались незначительно.
У больных с постгерпетической невралгией уровень растворимых форм дифференцировочных антигенов в процессе динамического наблюдения изменялся несущественно. Сохранялись монотонно-низкие показатели растворимых форм дифференцировочных антигенов, что характеризовало слабость Т-клеточных механизмов и формирование неадекватного иммунного ответа.
Выводы
1. Факторами, способствующими неосложненному течению герпетической инфекции, является возраст моложе 60 лет, среднетяжелое течение болезни, локализация высыпаний в области туловища, отсутствие сопутствующих заболеваний, повышение в 1,5-2 раза sHLAI по сравнению с контрольными значениями.
2. Ко-факторами формирования ПГН был пожилой возраст (более 60 лет), тяжелое течение болезни, локализация высыпаний в области головы, наличие сопутствующих заболеваний, повышение уровня мочевины крови, снижение sCD95 и sCD54 в 1,5-2 раза по сравнению с контрольными показателями.
