Пневмонии - острые инфекционные (преимущественно бактериальные) заболевания, сопровождающиеся вовлечением респираторных отделов легких. В России, США и Европейском союзе внебольничные и внутрибольничные пневмонии занимают ведущие места по показателям заболеваемости и летальности [1,2].
Для развития пневмонии микроорганизмам необходимо преодолеть барьеры противоинфекционной защиты органов дыхания, одним из которых является неспецифический и специфический клеточный иммунитет [1,3,4].
Клетки первого из них представлены преимущественно нейтрофильными лейкоцитами и макрофагами, а клетки второго - специфическими к антигену лимфоцитами [5,6].
После инициации воспаления микроорганизмами, нейтрофильные лейкоциты в течение нескольких минут мигрируют в очаг пневмонии [5], а стандартное время их накопления очаге – от нескольких часов до трех суток [3,7]. Моноциты также поступают к очагу воспаления, где трансформируются в макрофаги, хотя миграция их происходит позднее (через 24-48 часов), чем нейтрофилов [8]. Лимфоциты - окончательный клеточный компонент воспаления, появляются в альвеолах на 5-7 день от начала процесса. Их функция – организация специфического иммунного ответа на антиген [7]. Еще более ста лет назад стало очевидно, что легочная микроциркуляция играет уникальную роль в регуляции движения лейкоцитов при воспалении [9]. Более того, в отличие от других органов преимущественным местом миграции клеток неадаптивного и адаптивного иммунного ответа в очаг воспаления при пневмонии являются капилляры [3].
Несмотря на наличие работ, отражающих временные интервалы смены клеточных популяций неспецифического и специфического иммунитета в очаге пневмонии [10], имеются исследования показывающие, что нейтрофилы и макрофаги продолжают поступать в очаг воспаления во время фазы специфического иммунного ответа и взаимодействуют с клетками специфического иммунного ответа в борьбе, как с внутриклеточными, так и с внеклеточными микроорганизмами. Последние данные подтверждаются и тем, что индукция специфического иммунного ответа происходит при непосредственном участии нейтрофилов и макрофагов и их взаимодействии [11].
Вместе с тем, в доступной нам литературе не встретилась количественная оценка клеточных популяций неспецифического и специфического иммунного ответа, изучаемая с позиции наиболее активного выхода (из капилляров) данных клеточных популяций при пневмонии.
Цель исследования: изучить морфологию клеточного компонента неспецифического и специфического иммунитета при внебольничных и нозокомиальных пневмониях.
Материалы и методы. Исследование проведено в двух группах. Первую группу составил материал 19 аутопсий внебольничных очаговых пневмоний со смешанным характером экссудата пациентов, умерших в возрасте от 37 до 83 лет. Время нахождения пациентов в стационаре составило от 1 до 48 часов.
Вторую группу составил материал 31 аутопсии нозокомиальных очаговых, пневмоний со смешанным характером экссудата пациентов, умерших в возрасте от 22 до 87 лет. Время нахождения пациентов в стационаре составило от 3 до 65 дней. Бактериологическое исследование материала осуществлялось в НИИ антимикробной химиотерапии города Смоленска. В результате бактериологического исследования пневмоний была получена смешанная бактериальная флора.
Фрагменты легких, забранные для гистологического исследования, фиксировали в 10%-ом водном нейтральном растворе формалина и подвергали парафиновой проводке. Окраску гистологических срезов толщиной 4-5 мкм осуществляли гематоксилином и эозином.
Морфометрическое исследование проводили на микроскопе Olympus CX-21 при увеличении х1000 (окуляр х10 и объектив х100). С учетом технических характеристик микроскопа при данном увеличении площадь поля зрения составляет 21969,11 мкм², в то время как площадь всего гистологического среза равна 1 см² (то есть 107 мкм²). В каждом микропрепарате легочной ткани опытной и контрольной групп исследования осуществляли в 10 полях зрения, подсчитывая абсолютное количество нейтрофилов, макрофагов и лимфоцитов. При этом капилляр межальвеолярной перегородки помещали в центр поля зрения. Учитывали все изучаемые клеточные популяции поля зрения. Поля зрения каждого из 10 последующих исследований микропрепарата не перекрывались.
Таким образом, в первой группе проведен количественный подсчет клеточных популяций (нейтрофилов, макрофагов, лимфоцитов) в 190 полях зрения (n=190), а во второй группе проведен количественный подсчет клеточных популяций (нейтрофилов, макрофагов, лимфоцитов) в 310 полях зрения (n=310).
Статистическая обработка данных осуществлялась пакетом Microsoft Excel 2000. Формулы и методы статистического анализа использовали из руководства [12]. Оценка согласия распределения показателей с нормальным законом осуществлялась с помощью критерия Шапиро-Уилка. Поскольку выборки группы были распределены ненормально, то для описания центральной тенденции распределения данных использовали медиану, нижний и верхний квартиль. Учитывая, что выборки являются независимыми, то для сравнительного анализа внутригрупповых и межгрупповых клеточных популяций применялся U-критерий Манна-Уитни. Статистические гипотезы проверялись на уровне значимости α=0,05.
Цель исследования. Провести количественную сравнительную морфологическую оценку нейтрофилов, макрофагов и лимфоцитов в очагах внебольничных и нозокомиальных пневмоний.
Результаты исследования и их обсуждение. Показатели центральной тенденции распределения изучаемых клеточных популяций очага внебольничной пневмонии представлены в табл. 1.
Таблица 1. Результаты распределения нейтрофилов, макрофагов и лимфоцитов внебольничной пневмонии
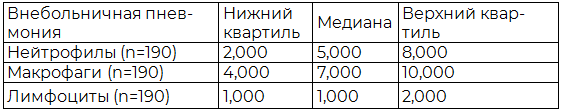
Анализируя полученные данные, можно предположить, что в очаге пневмонии клетки неспецифического иммунитета преобладают над клетками специфического иммунитета, что выражается в более высоких показателях нижнего квартиля, медианы и верхнего квартиля. В тоже время, среди клеток неспецифического иммунитета количественные показатели макрофагов преобладают над нейтрофилами.
Для статистического подтверждения этого был проведен сравнительный количественный анализ клеточных популяций очага внебольничной пневмонии с использованием U-критерия Манна-Уитни, который показан в табл. 2 и отражает значимые различия между сравниваемыми выборками (p<0,05).
Таблица 2. Результаты сравнительного анализа нейтрофилов, макрофагов и лимфоцитов очага внебольничной пневмонии
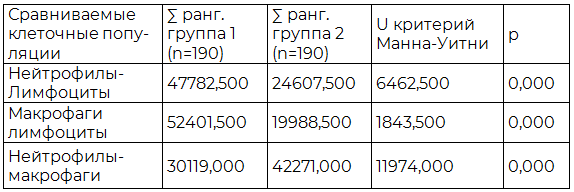
Преобладание клеток неспецифического иммунитета указывает на активное течение воспаления и может быть связано с различными причинами [7,13], среди которых нам хотелось бы обратить внимание на взаимодействия клеток инфильтрата с клетками паренхимы и компонентами стромы (пневмоцитами, фибробластами) способными привести к задержке нейтрофилов в альвеолах и, соответственно, к более затяжному клинико-морфологическому течению пневмонии [3,7, 13,14].
Показатели центральной тенденции распределения изучаемых клеточных популяций очага нозокомиальной пневмонии представлены в табл. 3.
Таблица 3. Результаты распределения нейтрофилов, макрофагов и лимфоцитов нозокомиальной пневмонии
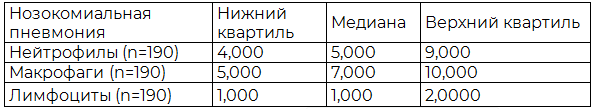
Данные центральной тенденции распределения клеток неспецифического и специфического иммунитета нозокомиальной пневмонии практически повторяют аналогичные результаты при внебольничной пневмонии, что также свидетельствует о преобладании фазы неспецифического иммунного ответа и во второй группе исследования. Для статистического подтверждения этого был выполнен сравнительный количественный анализ клеточных популяций очага нозокомиальной пневмонии с использованием U-критерия Манна-Уитни, который показан в табл. 4 и также отражает значимые различия между сравниваемыми выборками (p<0,05).
Таблица 4. Результаты сравнительного анализа нейтрофилов, макрофагов и лимфоцитов очага нозокомиальной пневмонии
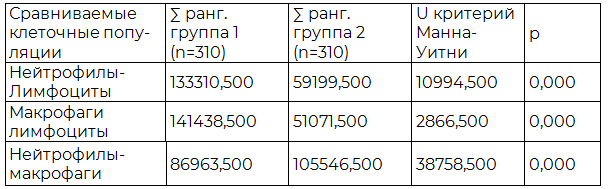
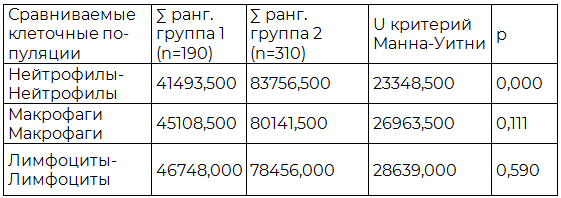
Для сравнительного межгруппового анализа идентичных клеточных популяций очага воспаления внебольничной и нозокомиальной пневмонии использован критерий Манна-Уитни, показанный в табл. 5 и отражающий значимые различия только между популяциями нейтрофилов (p<0,05) исследуемых пневмоний, в то время как различия между популяциями макрофагов и лимфоцитов незначимые (p>0,05).
Таблица 5. Результаты сравнительного анализа нейтрофилов, макрофагов и лимфоцитов очагов внебольничной и нозокомиальной пневмонии
Заключение. На основании проведенного исследования можно сделать вывод, что в очагах внебольничных и нозокомиальных пневмоний преобладают клетки неспецифического иммунного ответа, среди которых лидируют макрофаги, что подтверждает их ключевую роль при пневмонии [3].
