Лечение заболеваний дыхательных путей, включая грипп и другие ОРВИ является актуальной проблемой современного здравоохранения. В подавляющем большинстве случаев этиологическими факторами заболеваний дыхательных путей являются вирусные инфекции и микстинфекция. Так, по данным литературы более 200 различных представителей, включая 4 семейств РНК-содержащих вирусов (ортомиксо-, парамиксо-, короно-, пикорновирусы), и 2 семейств ДНК-содержащих вирусов (адено- и герпесвирусы) могут вызывать острые заболевания дыхательных путей.
В настоящее время установлена координирующая роль провоспалительного IL-18 в качестве дополнительного стимулятора продукции интерферона (прежде всего интерферона-γ), определяющего в значительной степени противовирусную защиту организма. Помимо этого, IL-18 в синергизме с интерлейкином-12 и интерфероном (α и β) способен вызывать продукцию других (помимо интерферона-γ) провоспалительных цитокинов Th1-лимфоцитами, которые, в свою очередь, могут привести к разрушению тканей организма путём излишней стимуляции выработки макрофагами фактора некроза опухоли-α, а также свободных радикалов кислорода и окиси азота.
Интерлейкин-18 (IL-18) относится к семейству интерлейкина-1, он также, как и интерлейкин-1, является медиатором воспаления. По структуре IL-18 представляет собой белок с молекулярной массой 18 кДа. IL-18 продуцируют, прежде всего, активированные макрофаги в зоне воспаления, однако его могут вырабатывать и другие иммунокомпетентные клетки, а также клетки поджелудочной железы, скелетной мышечной ткани, кожи, почек. IL-18 является активным фактором межклеточного взаимодействия, посредством участия которого в составе цитокиновой сети осуществляется связь между иммунной, эндокринной и нервной системами организма [1, 3].
Т.о. образом, участие IL-18 в противовирусной защите в большей степени предполагается не столько прямое, сколько связанное с усилением активности других провоспалительных цитокинов (прежде всего интерферона-γ, а через него и фактора некроза опухоли-α), т.е. непрямым путём.
Общеизвестен факт повышенной выработки иммунокомпетентными клетками провоспалительного IL-18, активно участвующего в реализации врождённого иммунитета при внедрении вируса гриппа [6]. При исследовании Chen W.J. et al [5] ДНК больных тяжёлым острым респираторным синдромом (SARS), вызываемом коронавирусом и характеризующимся развитием тяжёлой атипичной пневмонии с высокой летальностью, оказалось, что высокая смертность была связана с полиморфизмом аллелей, кодирующих синтез IL-18. Авторы предполагают, что данные выводы в связи с универсальностью механизмов врождённого иммунитета, кроме коронавируса, могут быть применимыми и к другим респираторным вирусам, в частности, к вирусу гриппа.
Исходя из вышеизложенного, целью настоящей работы явилось исследование динамики уровня провоспалительного IL-18 в сыворотке крови больных острыми респираторными вирусными инфекциями (ОРВИ) с определением возможной прогностической роли данного цитокина при различных ОРВИ.
Материалы и методы исследования. Обследовано 82 больных ОРВИ средней тяжести в возрасте 15-54 лет: гриппом pH1N1 (n=15), гриппом А/H3N2 (n=17), аденовирусной инфекцией (n=17), парагриппом (n=20) и респираторно-синцитиальной вирусной инфекцией (РС-инфекцией) (n=13). Отдельную группу (n=10) составили больные с тяжёлым течением pH1N1 с летальным исходом в возрасте 19-61 лет.
Степень тяжести гриппа А оценивали по выраженности интоксикационного и катарального синдромов. При среднетяжёлой форме гриппа А заболевание начиналось остро, температура тела повышалась в пределах 38–40°С, симптомы интоксикации и катаральные явления были умеренно выражены. Длительность лихорадочного периода составляла 4-5 дней. Тяжёлая форма гриппа характеризовалась внезапным началом заболевания, высокой (39,5°С и более) лихорадкой, резко выраженными симптомами интоксикации (адинамией, резкой головной болью, головокружением, обморочным состоянием, анорексией, рвотой, судорогами, сердечно-сосудистыми нарушениями). Данная форма осложнялась двусторонней пневмонией с развитием ОРДС с последующим (наступившим на 5-17 дни болезни) летальным исходом.
Забор крови производили в остром периоде (1-2 день болезни) и в периоде реконвалесценции (на 7-9 день болезни). Диагноз был подтверждён с помощью метода полимеразной цепной реакции или реакции непрямой гемагглютинации (выявлением специфических антител с ростом их титра в 4 и более раз). Уровень цитокинов определяли в сыворотке крови методом ИФА коммерческими тест-системами "Вектор-Бест" (Россия).
Результаты клинических и лабораторных исследований были внесены в специально разработанные карты индивидуального обследования пациентов с последующим представлением в виде электронных таблиц Microsoft Excel 2007. Статистическая обработка результатов исследований была проведена с использованием пакета StatGraphics 15.0.
Нормальность распределения вариационных рядов (соответствие закону Гаусса) проверяли с помощью критериев согласия Колмогорова-Смирнова и Шапиро-Вилкса, одного из самых мощных критериев нормальности. При выполнении гипотезы нормальности распределения в качестве точечной оценки характеристики центра группирования значений случайной величины использовали выборочное среднее (Mo) [2]. В случае нормального распределения каждой из выборок межгрупповые различия выявляли при помощи t-критерия Стьюдента (СТ) и точного критерия Фишера для сравнения дисперсий. При не выполнении гипотезы нормальности распределения в качестве точечной оценки характеристики центра группирования значений случайной величины использовали медиану (Ме) – показатель наименее подверженный влиянию со стороны индивидуальных колебаний признака. Между собой выборки сравнивали с помощью непараметрического критерия Вилкоксона-Манна-Уитни (ВМУ) – рангового критерия, хорошо приспособленного для анализа малых выборок и робастного к виду закона их распределения, а также двухвыборочного критерия Колмогорова-Смирнова (КС) [2]. Уровень значимости при проверке всех статистических гипотез – р<0,05 (доверительная вероятность >0.95).
Контролем служила кровь 17 здоровых доноров в возрасте 19-40 лет (Me=263,8 пг/мл). Полученные нами значения IL-18 контрольной группы лиц согласуются со средним показателем, полученным при обследовании сыворотки крови 68 здоровых доноров фирмой-производителем тест-систем "Вектор-Бест": 370 пг/мл (с вариацией от 104 до 650 пг/мл).
Результаты и обсуждение. Сравнительная характеристика динамики концентрации IL-18 в остром периоде и периоде ранней реконвалесценции сыворотки крови больных ОРВИ представлена в табл. 1. В основном, изменения уровня IL-18 в сыворотке крови больных ОРВИ оказались статистически незначимыми, что свидетельствует о том, что при среднетяжёлом течении ОРВИ изученной нами этиологии у находящихся в месте воспаления иммунокомпетентных клеток оказывается достаточно компенсаторных возможностей по синтезу данного цитокина, эффективно действующего даже в минимальных, не отличающихся от нормы концентрациях.
Таблица 1. Сравнительная характеристика уровня IL-18 у больных ОРВИ
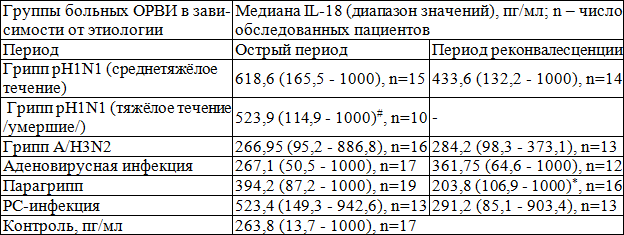
Примечания: * – достоверные различия показателей в динамике заболевания (ВМУ, КС р<0,05); # – достоверное отличие от контроля (КС р<0,05).
Острый период. Визуально высокие показатели уровня IL-18 – в сравнении с контролем – характеризовали острый период гриппа pH1N1 (как его среднетяжёлое, так и тяжёлое течение), а также РС-инфекции. Так, самый высокий уровень отмечен у больных среднетяжёлым течением гриппа pH1N1. Хотя он статистически значимо не отличался от нормы, но он был достоверно выше, чем при гриппе A/H3N2 как в остром периоде (СТ р<0,05), так и в периоде реконвалесценции (ВМУ, КС р<0,05), что можно рассматривать как признак дисбаланса функционирования цитокиновой сети при действии на организм нового для человечества вируса гриппа А.
Статистически значимым оказалось повышение уровня IL-18 у больных с тяжёлым течением гриппа pH1N1 в сравнении с контролем (КС р<0,05), а также в сравнении с острым периодом гриппа A/H3N2 (ВМУ, КС р<0,05). Концентрация же IL-18 у других групп больных в остром периоде ОРВИ достоверно не была повышена (в сравнении с контролем) (ВМУ, КС р>0,05).
Период реконвалесценции. В периоде реконвалесценции гриппа pH1N1 концентрация IL-18 оставалась на высоком уровне, но не прямо (в сравнении с контролем), а в сравнении с аналогичным периодом гриппа А/H3N2 (ВМУ, КС р<0,05) и парагриппа (ВМУ, КС р<0,05). В сравнении с реконвалесцентным периодом гриппа А/H3N2 (ВМУ р<0,05) и парагриппа (ВМУ, КС р<0,05) концентрация IL-18 достоверно выше определялась также и при аденовирусной инфекции.
Таким образом, выявлено, что концентрация IL-18 в реконвалесцентном периоде гриппа pH1N1 и аденовирусной инфекции была более высокой в сравнении с тем же уровнем IL-18 при гриппе A/H3N2 и парагриппе.
Несмотря на то, что визуально в большинстве групп пациентов определяются более высокие показатели в остром периоде заболевания с тенденцией к снижению их концентрации к периоду реконвалесценции (что является достаточно характерным для провоспалительных цитокинов, в том числе и IL-18, обеспечивающих инициирование и развитие инфекционного процесса), статистически достоверное снижение уровня IL-18 в периоде реконвалесценции по сравнению с острым периодом выявлено только при парагриппе (ВМУ, КС р<0,05).
Таким образом, из всех исследованных нами групп ОРВИ изменения уровня IL-18 в крови наиболее ярко были представлены при гриппе pH1N1: в виде относительно высоких показателей (при среднетяжёлой форме) и статистически достоверного повышения (при тяжёлом течении) (КС р<0,05). Выявленная тенденция высокого уровня IL-18 при среднетяжёлой форме гриппа pH1N1, сменяющаяся статистически значимым повышением концентрации фактора при утяжелении состояния может свидетельствовать о прогрессирующем повышении активности макрофагов в зоне воспаления с усиленной выработкой ими IL-18, который еще более стимулирует синтез мощного провоспалительного цитокина – интерферона (прежде всего γ), участвующего в реализации патогенетических механизмов "цитокинового шторма (бури)".
Повышенная концентрация IL-18 при тяжёлом течении гриппа pH1N1, характеризующимся бесконтрольным выбросом мощных провоспалительных цитокинов [4], также вносит свой "вклад" в процессы повреждения тканей и неизбежный летальный исход.
К периоду реконвалесценции уровень IL-18 остаётся в пределах нормальных значений (р>0,05), но относительно высокая концентрация, отмеченная при гриппе pH1N1, сохраняется, что свидетельствует о наступлении при данном заболевании неполной лабораторной реконвалесценции. Похожая тенденция в виде более высокого уровня IL-18 (в сравнении с больными гриппом А/H3N2 и парагриппом) характеризует и аденовирусную инфекцию.
Выводы
1. Установлено прогностическое значение высокого уровня IL-18, прямо стимулирующего выработку интерферона-γ, при тяжёлом течении гриппа pH1N1.
2. Для оценки состояния иммунного статуса и определения прогноза рекомендуется исследование концентрации IL-18 у больных ОРВИ, прежде всего, гриппом pH1N1.
