Доступность и широкое использование в клинической практике антиретровирусной терапии (АРВТ) для борьбы с вирусом иммунодефицита человека (ВИЧ) снизили частоту развития синдрома приобретенного иммунодефицита (СПИДа) и оппортунистических инфекций [1, 2, 3, 4]. Сдерживание этих заболеваний продлило жизнь ВИЧ-инфицированных, и они стали доживать до срока развития печеночной недостаточности в исходе хронического гепатита С (ХГС) [5, 6]. Есть сведения, что после внедрения АРВТ, смертность от болезней печени у ВИЧ-инфицированных увеличилась с 5-12% до 35-50% [7].
В Росийской Федерации по данным Федерального научно-методического центра по профилактике и борьбе со СПИДом в структуре летальных исходов среди больных ВИЧ-инфекцией терминальная стадия поражений печени в исходе хронических вирусных гепатитов до 2009 г. уже составляла существенную долю - 13,5-14,5%. В 2009 г. этот показатель вырос до 15,7%, хотя общая смертность среди ВИЧ-инфицированных снизилась с 3,4% (2008 г.) до 3% (2009 г.) [8].
Убедительно звучит, что «иммуносупрессия, связанная с ВИЧ, не может не сказываться на течение хронического гепатита С, точно также состояние печени не может не отражаться на функциональных показателях иммунитета и эффективности лечения ВИЧ-инфекции» [9].
Неблагоприятное течение гепатита С при наличии ВИЧ-инфекции, увеличение смертности от заболеваний печени, повышение риска гепатотоксического действия лекарственных препаратов - аргументы, указывающие на необходимость лечения гепатита С у больных ВИЧ-инфекцией [10, 11, 12].
Целью настоящего исследования явилось изучение эффективности противовирусной терапии (ПВТ) ХГС при моно- и коинфекции с ВИЧ.
Методы исследования. Под наблюдением находилось 134 больных с ХГС: коинфекцией ВИЧ/ХГС – 109 больных и моноинфекцией ХГС – 25 больных, получавших противовирусную терапию в 2008-2010 г. Все больные получали комбинированную терапию, включающую пегилированные интерфероны (ПЕГ-ИФН) α2а (Пегасис) или α2в (Пегинтрон) и рибавирин.
Курс противовирусной терапии соответствовал рекомендуемым стандартам: при коинфекции ВИЧ/ХГС – 48 недель, независимо от генотипа вируса гепатита С (ВГС), при моноинфекции ХГС – 24-48 недель в зависимости от генотипа. У 5 (4,6%) больных коинфекцией ВИЧ/ХГС, в связи с поздней элиминацией РНК ВГС из сыворотки крови (к 24 неделе лечения), продолжительность терапии составила 72 недели. В исследование не были включены пациенты: ранее получавшие ПВТ, с микст-гепатитами, c серьезными хроническими сопутствующими заболеваниями, с компенсированным и декомпенсированным циррозом печени, принимающие алкоголь и наркотики, с уровнем СД4+ лимфоцитов менее 350 клеток/мкл.
Вирусологический мониторинг РНК ВГС методом полимеразной цепной реакции (ПЦР) проводился согласно рекомендациям Федерального научно-методического центра по профилактике и борьбе со СПИДом (2007 г.) на сроках 4 недели и в последующем каждые 12 недель. После завершения ПВТ больные обследовались в течение 2–х лет (1 раз в 6 месяцев). У всех больных коинфекцией определяли уровень CD4+лимфоцитов каждые 12/24 недели на протяжении курса наблюдения.
Высокую вирусную нагрузку РНК ВГС (более 2 млн. копий/мкл) имели 69 больных (63,3%) с коинфекцией ВИЧ/ХГС и 9 больных (36,0%) с моноинфекцией ХГС. Генотип 1 ВГС был обнаружен у 55 пациентов (50,5%) с коинфекцией и у 17 (68,0%) с моноинфекцией ХГС.
В соответствии с клинической классификацией ВИЧ-инфекции В.И. Покровского (2002г.) 48 больных (44,0%) коинфекцией ВИЧ/ХГС находились на субклинической стадии (3 стадия) ВИЧ-инфекции, 60 (55,0%) – на стадии 4А и 1 больной на стадии 4Б в фазах ремиссии. На момент начала противовирусной терапии 32 (29,4%) пациента получали антиретровирусную терапию.
Схемы АРВТ у 31 (96,9%) пациента включали бустированные ритонавиром ингибиторы протеазы (ИП): у 19 – лопинавир, у 6 – дарунавир, у 4-х – реатаз, по одному пациенту получали – телзир и саквинавир. Схему с ненуклеозидным ингибитором обратной транскриптазы (ННИОТ) – эфавирензом принимал один пациент (3,1%). Из нуклеозидных/нуклеотидных аналогов (НИОТ) пациенты получали ламивудин в сочетании с абакавиром - 90,6% (29 пациентов), либо с фосфазидом – 9,4% (3 пациента).
Статистическая обработка полученных результатов проводилась с помощью программного обеспечения Microsoft Excel и STATISTICA. При этом использовались параметрические методы оценки результатов – вычисление средней арифметической, среднеквадратического отклонения, средней ошибки средней арифметической. Оценка различий между сопоставляемыми группами по избранным критериям осуществлялась по критерию Стьюдента. Достоверность изменений признавалась при вероятности ошибки ρ меньшей или равной 0,05.
Результаты и их обсуждение. Анализ полученных результатов показал, что в группе больных коинфекцией ВИЧ/ХГС исчезновение РНК ВГС из сыворотки крови на 4 неделе лечения (быстрый вирусологический ответ - БВО) было зарегистрировано у 50 (45,9%) больных: частота БВО у пациентов, инфицированных генотипом 1 составила - 23,6%; у пациентов с генотипом 2, 3 – 70,6%. Через 12 недель (ранний вирусологический ответ – РВО) авиремия была достигнута у большинства пациентов ВИЧ/ХГС - 87 человек (79,8%): частота РВО у пациентов инфицированных генотипом 1 составила 33 человека (60,0%); с генотипом 2,3 - 54 человека (100%). Непосредственный ответ при завершении терапии (НВО) наблюдался у 35 (63,6%) пациентов с генотипом 1 и у 54 (100%) с генотипом 2,3.
В группе больных моноинфекцией ХГС БВО наблюдался у 11 (44 %) больных: с 1-м генотипом у 5-ти (29,4%), с генотипом 2 и 3 – у 6-ти пациентов (75%). РВО был отмечен у 21 (84%) больного: с 1-м генотипом - у 13 (76,5%), с генотипом 2 и 3 – у 8 (100%) больных.
Из 109 коинфицированных ВИЧ/ХГС пациентов 63 (57,8%) человека прошли полный курс терапии. У 16 (14,7%) пациентов отсутствовал вирусологический ответа на фоне ПВТ, поэтому 11 человек из их завершили лечение в 24 недели, остальные 5 пациентов, в ввиду высокой приверженности, прошли 48–ми недельный курс. ПВТ была прекращена у 4 (3,7%) пациентов из-за вирусологического прорыва на сроках 24-36 недель и у 6 (5,5%) - из-за осложнений на сроках 22-47 недель. Отказались от продолжения лечения на сроках 33-38 недель 20 (19,2%) пациентов (все имели отрицательные результаты ПЦР-детекции РНК-ВГС на момент завершения ПВТ). Из них 17 пациентов сохранили устойчивый вирусологический ответ (УВО), у 3-х - через 6 месяцев после лечения наблюдался рецидив заболевания.
В группе больных ХГС моноинфекцией полный курс прошел 21(84,0%) пациент. Из 4-х пациентов (16,0%), у которых не снижалась вирусная нагрузка до 24 недель ПВТ, 2 - завершили лечение в 24 недели; 2 - продолжили курс до 48 недель.
Таким образом, завершили лечение с получением непосредственного вирусологического ответа 89 пациентов (81,7%) с коинфекцией ВИЧ/ХГС и 21 пациент (84,0%) с моноинфекцией ХГС. Не получен вирусологический ответ у 20 пациентов (18,3%) с ВИЧ/ХГС и у 4 (16,0%) - с моноинфекцией ХГС. Все пациенты, не ответившие на терапию, были инфицированы генотипом 1 ВГС.
В ходе исследования выявлено, что частота УВО у больных ВИЧ/ХГС коинфекцией составила 67,0%/73: с генотипом 1 – у 43,6%/24, с генотипом 2 и 3 – у 90,7%/49. Среди больных с моноинфекцией ХГС частота УВО составила 76,0%/19: с генотипом 1 – у 64,7%/11, с генотипом 2 и 3 в 100% случаев (n=8).
Рецидив заболевания (через 6 месяцев после окончания терапии) возник у 16 (14,7%) пациентов с ВИЧ/ХГС (с генотипом 1 – 11 человек и генотипом 2,3 – 5 человек) и у 2 (8,0%) с моноинфекцией (с 1 генотипом).
Таким образом, БВО у больных инфицированных ВГС генотипом 2, 3 прогнозировал более высокий процент УВО как при ко-, так и при моноинфекции. При генотипе 1 ВГС в обеих группах была низкая частота БВО – 23,6% и 29,4% соответственно, и частота УВО в этих группах была ниже. Лучший результат в достижении УВО при генотипе 1 наблюдался у больных моноинфекцией - 64,7% относительно 43,6% больных при коинфекции.
В зависимости от достижения УВО больные были разделены на 2 группы: УВО«+» и УВО«-». В группу УВО«+» вошли больные с устойчивым вирусологическим ответом на ПВТ, в группу УВО«-» - больные с отсутствием вирусологического эффекта на фоне лечения и больные с рецидивом заболевания после завершенной терапии.
Как известно, при составлении прогноза эффективности лечения ХГС, традиционно, учитываются следующие факторы: возраст, стаж инфицирования ВГС и наличие фиброза, генотип ВГС и уровень вирусной нагрузки, а так же наличие быстрого клиренса РНК ВГС в ответ на ПВТ (БВО) [13, 14, 15]. Мы проанализировали данные критерии при сравнении групп больных в зависимости от достижения УВО. У больных коинфекцией дополнительно рассматривались показатели по ВИЧ-инфекции: уровень СД4+ лимфоцитов и прием антиретровирусных препаратов (табл. 1).
В группе больных с коинфекцией ВИЧ/ХГС, у которых был достигнут УВО, превалировали женщины - 45 (61,7%), 2,3 генотип РНК ВГС (67,1%), в 54,8 % отмечался БВО, в 97,3 % - РВО. В группе больных коинфекцией, у которых не был достигнут УВО, превалировали мужчины - 19 (52,7%), генотип 1 РНК ВГС (86,1%), а БВО и РВО были у меньшего числа больных (27,8% и 47,2% соответственно). Возраст старше 40 лет и давность выявления антител к ВГС (6,6±4,0 и 7,0±3,3 года) в обеих группах были сопоставимы. Высокая репликативная активность РНК ВГС в сыворотке крови до начала ПВТ чаще отмечалась у пациентов группы УВО «-» (73,5%) по сравнению с пациентами группы УВО «+» (58,7%), однако, различия были недостоверны (р>0,05). Кроме того, обращала на себя внимание, что в группе с УВО доля больных, получавших АРВТ, была ниже - 20,5% против 47,2% группы УВО «-» (р<0,05) (табл. 1).
На рис. 1 представлены результаты по достижению УВО в зависимости от генотипа ВГС и проведения АРВТ.
Таблица 1. Сравнительная характеристика больных ВИЧ/ХГС в зависимости от достижения УВО (%).
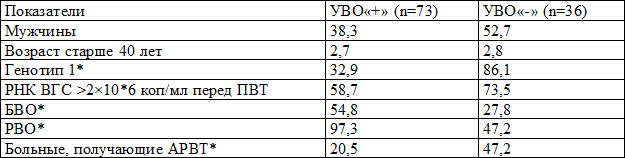
Примечание: *р<0,05 между группами УВО«+» и УВО«-».
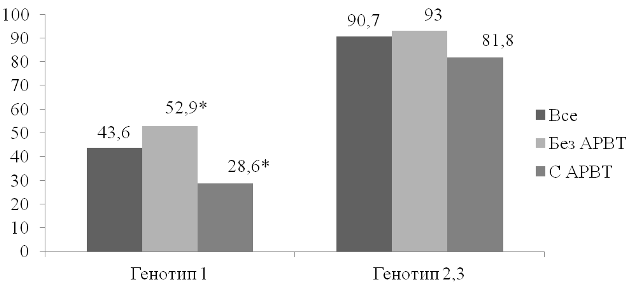
Рис. 1. Устойчивый вирусологический ответ в зависимости от генотипа у пациентов, получавших и не получавших АРВТ: *р<0,05 при генотипе 1 между группами с АРВТ и без АРВТ
Как видно из рис. 1, сочетание антиретровирусной и ПВТ ХГС достоверно (р<0,05) снижает процент больных с устойчивым вирусологическим ответом при 1-м генотипе ВГС. Отрицательное влияние антиретровирусного лечения на достижение УВО было отмечено ранее рядом авторов [16-18]. В нашем исследовании, это может быть связано с более продвинутой стадией ВИЧ-инфекции у пациентов с АРВТ, а также возможными фармакодинамическими взаимодействиями между рибавирином и абакавиром, который входил в схему АРВТ у 90,6% больных, а также их конкуренцией за внутриклеточные ферменты [19-21].
В наблюдаемой нами группе больных моноинфекцией ХГС с УВО превалировали женщины (63,2%), в то время, как при УВО«-», обращало на себя внимание большее количество мужчин (66,6%), причем старше 40 лет. Давность выявления антител к ВГС в группах УВО«+» и УВО«-» была одинаковой 3,8±3,4 и 3,5±2,7 лет. В нашем исследовании, факторами, снижающими частоту УВО как у ко-, так и моно-инфицированных больных явились генотип 1 ВГС и отсутствие БВО на фоне лечения.
Нами была проведена оценка биохимического ответа на противовирусную терапию по нормализации уровня аланинаминотрансферазы (АлАТ) в зависимости от результата вирусологического ответа. Из проведенного нами анализа получено, что исходные показатели АлАТ у больных ВИЧ/ХГС коинфекцией и ХГС моноинфекцией были достоверно выше показателей АлАТ здоровых лиц (N 21,42±1,26 ЕД/л). При сравнении АлАТ в группах УВО «+» и УВО «-» до- и на фоне лечения, мы не выявили достоверных различий между больными моно- и ко-инфекцией. Среди коинфицированных достоверные различия в показателях АлАТ в группах между больными с УВО и не достигшими УВО выявлены спустя 24 недели после завершения терапии (р<0,05) (рис. 2).
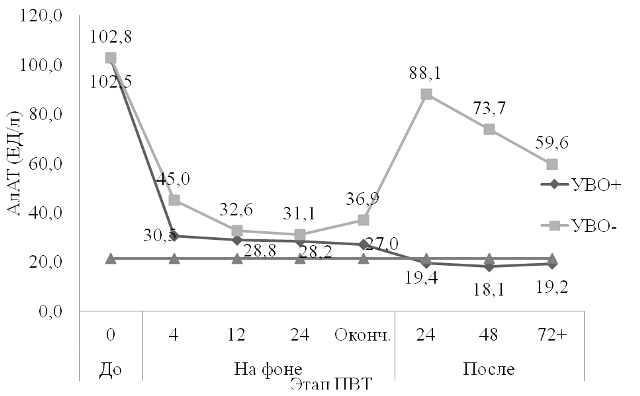
Рис. 2. Динамика активности АлАТ у больных коинфекцией ВИЧ/ХГС в зависимости от результата УВО (ЕД/л)
Таким образом, анализ активности АлАТ показал, что в обеих группах, независимо от вирусологического ответа, происходило достоверное (p<0,05) снижение ее значений на фоне терапии. После завершения лечения средний уровень АлАТ в группе больных с УВО сохранялся в пределах нормы, в отличие от больных группы УВО «-», где уровень АлАТ оставался повышенным по сравнению со здоровыми лицами (88,1±4,5, у здоровых 21,42±1,26 ЕД/л), но ниже при сравнении со значениями до лечения (р<0,05). Учитывая, что 47,2% больных ВИЧ/ХГС коинфекцией, не достигших УВО, находились на АРВТ, возможно, повышенная у них активность АлАТ была обусловлена не только продолжающейся репликацией РНК ВГС (по данным результатов ПЦР), но и токсическим действием антиретровирусных препаратов [19, 22].
Как известно, ПЕГ-ИФН и рибавирину свойственны разнообразные нежелательные явления. Нами проводился сравнительный анализ частоты выявления нежелательных явлений у пациентов с ВИЧ/ХГС коинфекцией и ХГС моноинфекцией. Выявлено, что нежелательные явления в обеих группах были однотипными и не отличались от ранее описанных в литературе [21, 23-25]. Кроме того, нами было замечено, что характер и выраженность нежелательных явлений зависят от сроков проведения ПВТ. Гриппоподобный синдром (подъем температуры до фебрильных цифр, озноб, головная боль, миалгия, артралгия) наблюдался на 1-2–й неделе лечения у 75,2% больных с ВИЧ/ХГС коинфекцией и был более выражен у больных ХГС моноинфекцией - 92% (р<0,02). В последующем температурная реакция снижалась, но начинали нарастать астенический синдром (слабость, недомогание, повышенная утомляемость, снижение работоспособности), чаще наблюдавшийся у больных коинфекцией - 89% против 60% больных с моноинфекцией, и диспепсический синдром (тошнота, сухость во рту, снижение аппетита).
На 4-12 неделе ПВТ в обеих группах регистрировались кожный зуд, сухость, гиперемия в местах инъекций. На 12-24-й неделе лечения отмечались усиление выпадения волос у 52 (47,7%) больных ВИЧ/ХГС и 11 (44,0%) - в группе ХГС и нейропсихические расстройства (раздражительность, снижение памяти и внимания, плаксивость, беспокойство, бессонница, апатия, плохое настроение) - у 47,7% больных ВИЧ/ХГС коинфекцией и 40% - ХГС. Коррекция депрессивных состояний осуществлялась при активном участии психиатра и психолога, в редких случаях назначались антидепрессанты. По литературным данным около 20% больных не доводят лечение до конца из-за непереносимости побочных реакций [26]. В нашем исследовании 18,3% больных ВИЧ/ХГС коинфекцией досрочно прекратили терапию на сроке 33-38 недель. Однако, несмотря на укорочение курса лечения, большинство из них - 85% имели УВО.
Как известно, терапия α-интерфероном и рибавирином часто вызывает гематологические нарушения. Среди наблюдаемых нами пациентов – 51,5 % имели снижение гематологических показателей (анемия, тромбоцитопения, нейтропения). Отмены противовирусной терапии не было ни в одном случае, что позволило закончить терапию с УВО у 37,6% больных с ВИЧ/ХГС коинфекцией и у 32% больных ХГС.
Нами проанализирован уровень СД4+ лимфоцитов у больных ВИЧ/ХГС коинфекцией во время проведения ПВТ в зависимости от наличия УВО (рис. 3).
Как видно из рис. 3, ни на одном этапе наблюдения нами не выявлено достоверных различий между исследуемыми группами.
В обеих группах в ходе терапии происходило снижение абсолютного количества СД4+ лимфоцитов: число больных с уровнем ниже 350 клеток/мкл составило 40,4%/44. Из них больше половины - 68,2%/30 достигли УВО. Среди 65 пациентов, у которых на фоне лечения уровень СД4+ сохранялся выше 350 клеток/мкл частота УВО составила 63,1%/41 (р>0,65).
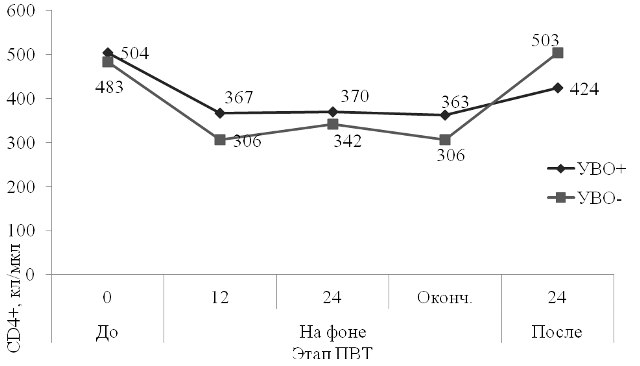
Рис. 3. Динамика уровня СД4 лимфоцитов в зависимости от результата УВО на разных этапах ПВТ (кл/мкл)
Несмотря на то, что снижение СД4-лимфоцитов у большинства не сопровождалось развитием клинической симптоматики вторичных заболеваний, у 6 (5,5%) пациентов терапия была прекращена в связи с развитием осложнений (табл. 2). У всех был получен УВО: 4 пациента с 1 генотипом, 3 – с 3 генотипом.
Таким образом, укорочение курса ПВТ даже при наличии осложнений, явившихся причиной ее отмены, не повлияло на эффективность ПВТ.
Таблица 2. Осложнения на фоне ПВТ у больных ВИЧ/ХГС коинфекцией (n=6)
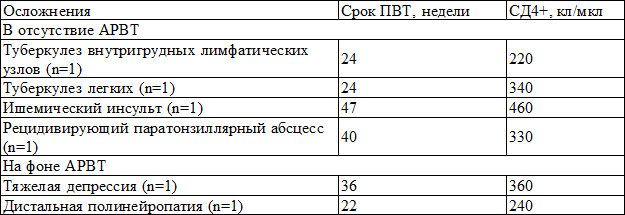
В группе больных моноинфекцией осложнений не наблюдалось.
Заключение
1. Противовирусная терапия ВГС-инфекции показывает высокую эффективность в плане достижения УВО у больных коинфекцией ВИЧ/ХГС преимущественно при генотипах 2,3 вируса.
2. Частота нежелательных явлений при проведении ПВТ у больных коинфекцией ВИЧ/ХГС не является критерием отмены лечения.
3. Сочетание антиретровирусной и противовирусной терапии ХГС снижает частоту УВО у больных коинфекцией преимущественно с 1 генотипом ВГС.
4. Снижение уровня СД4+ лимфоцитов на фоне проведения ПВТ не влияет на частоту УВО.
