В пандемию гриппа в 1918 г., так называемую “испанку”, была вовлечена треть населения земного шара, а количество летальных исходов составило более 50 миллионов. Причем, причина патогенного гриппа человека и его связи с птичьим и свиным гриппом была не понятна. В 30-е годы XX века родственные вирусы гриппа выделены у свиней, а затем у человека. [18]. Вирус пандемического гриппа A/H1N1 впервые обнаружен в конце апреля 2009 г., а по состоянию на 20.11.2009 г. более 206 стран сообщили о лабораторно подтвержденных случаях пандемического гриппа (Н1N1) 2009, включая 6770 случаев с летальным исходом. Новый вирус гриппа А/Н1N1 2009 ранее никогда не циркулировал среди людей и не связан с предыдущими или нынешними сезонными вирусами гриппа. Важной особенностью течения пандемического варианта гриппа являлось более частое и выраженное поражение нижних дыхательных путей, способность к развитию и быстрому прогрессированию острой дыхательной недостаточности вследствие острого респираторного дистресс-синдрома (ОРДС) и пневмонии [8]. Кроме того, многие вирусы, в том числе гриппа, обладают не только эпителиотропной, но и эндотелиотропной активностью [12].
Нарушения системной гемодинамики и микроциркуляции при септических состояниях, безусловно, являются важным этапом пато- и танатогенеза [17]. Наличие в легких значительной массы эндотелиоцитов в альвеолярно-капиллярной мембране определяет развитие синдрома системной воспалительной реакции у данных больных. Все это способствует выбросу большого количества цитокинов и других биологически активных веществ в кровоток, что приводит к развитию полиорганной недостаточности с нарушениями микроциркуляции. Респираторная терапия также может отрицательно сказываться как на системной гемодинамике, так и на микроциркуляции, в том числе в связи со снижением венозного возврата [5]. Таким образом,варианты нарушений системной гемодинамики при септических состояниях в настоящее время достаточно широко изучены, однако, механизмы участия системы микроциркуляции в патогенезе полиорганной недостаточности требуют уточнения.
Цель исследования: оценить состояние микроциркуляции у больных с тяжелым течением гриппа A/H1N1 в зависимости от проводимой респираторной терапии.
Материалы и методы. Для оценки состояния микроциркуляторного русла использовался неинвазивный метод лазерной допплеровской флоуметрии (ЛДФ). С помощью аппарата ЛАКК-02 (НПП «Лазма», Россия) проведено исследование у 30 больных в возрасте от 25 до 50 лет с гриппом A H1N1, осложнённого пневмонией тяжелой степени. Все пациенты находились на стационарном лечении в отделении реанимации городской клинической больницы №1 г. Читы в ноябре 2009 г. Больные разделялись на 2 группы: 1-я группа – больные с сохраненным самостоятельным дыханием, 2-ю группу составили пациенты, находящиеся на искусственной вентиляции легких (ИВЛ). ЛДФ-граммы регистрировались в течение 7-10 минут. Датчик устанавливался по наружной поверхности предплечья в точке, расположенной по срединной линии на 4 см выше основания шиловидных отростков локтевой и лучевой костей. Контрольную группу составили 20 здоровых добровольцев в возрасте от 25 до 45 лет. Оценивались показатель микроциркуляции (ПМ в перфузионных единицах (пф. ед.)), среднеквадратичное отклонение (Q, пф. ед.), коэффициент вариации (Кv, %). С помощью вейвлет-преобразования осцилляций кровотока получали показатели шунтирования (ПШ), нейрогенного (НТ) и миогенного (МТ) тонуса сосудов. Статистический анализ проведен с помощью пакета программ Microsoft Excel, Biostat. При сравнении групп использовался критерий Манна-Уитни.
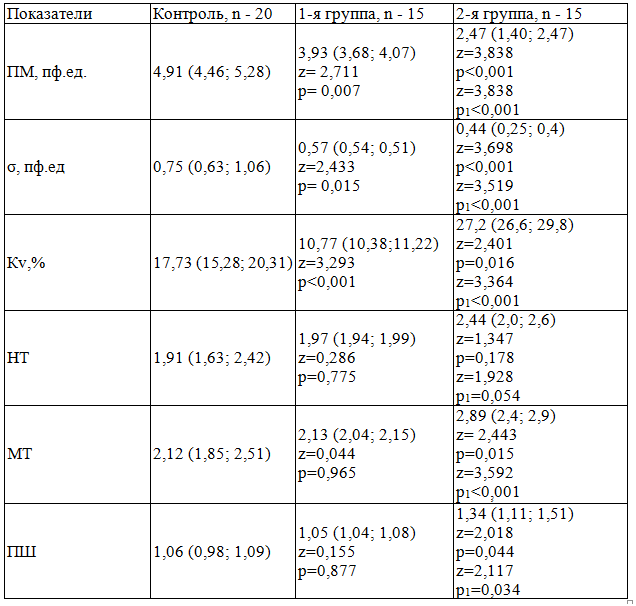
Результаты и обсуждение. Установлено, что у больных с пневмониями на фоне гриппа A/H1N1, не нуждающихся в респираторной поддержке (табл. 1), снижался показатель микроциркуляции (ПМ) относительно контрольной группы в 1,2 раза (p=0,007). Показатель микроциркуляции уменьшался у больных с пневмониями, находящихся на ИВЛ, по сравнению с контролем в 1,9 раза (p<0,001). Отмечено снижение данного параметра у пациентов 2-й группы, по сравнению с пациентами 1-й группы в 1,6 раза (p1<0,001). Одновременно выявлено уменьшение коэффициента вариации (Кv) в 1,6 раза (p<0,001) у пациентов с тяжелым течением гриппа A/H1N1 без респираторной поддержки по сравнению с контрольной группой. Причем, данный показатель увеличивался у больных находящихся на ИВЛ по сравнению со здоровыми людьми в 1,5 раза (p=0,016). При этом у больных 2-й группы коэффициент вариации (Кv ) в 2,5 раза превышал его значения у пациентов без респираторной поддержки (p1<0,001).При исследовании нейрогенного тонуса (НТ) у всех больных с гриппом A/H1N1 изменений выявлено не было (p>0,05).
Таблица 1. Показатели микроциркуляции у больных с гриппом A/H1N1 (Ме (25-й;75-й))
Примечание: здесь и далее Z – коэффициент Манна-Уитни, р – значение различий по сравнению со здоровыми, p1 – значение различий между 1-й и 2-й группами пациентов
Снижение показателя микроциркуляции у больных с тяжелым течением гриппа A/H1N1,как находящихся на ИВЛ, так и без респираторной поддержки, по нашему мнению, связано как с более частым развитием полиорганной недостаточности, так и с отрицательным эффектом искусственной вентиляции легких на гемодинамику [5]. Коэффициент вариации является отражением воздействия на микроциркуляторный кровоток активных механизмов регуляции. Данный показатель снижался у больных без респираторной поддержки, и напротив, резко возрастал у пациентов находящихся на ИВЛ, что является отражением работы локальных механизмов регуляции микрокровотока при критических расстройствах гомеостаза и влиянием принудительной вентиляции на гемоциркуляцию.
Установлено, что при тяжелом течении гриппа A/H1N1 миогенный тонус (МТ) у пациентов на спонтанном дыхании не изменялся по сравнению с контрольной группой (p>0,05). При этом у больных, находящихся на ИВЛ, миогенный тонус (МТ) увеличивался на 26% (p=0,015) по сравнению со здоровыми людьми. Одновременно, (МТ) у пациентов 2-й группы превышал в 1,3 раза (p1<0,001) значения данного параметра 1-й группы. Показатель шунтирования, при тяжелом течении гриппа A/H1N1, у пациентов требующих респираторной поддержки, увеличивался на 20% (p=0,044) по сравнению с контролем. Одновременно данный параметр возрастал на 22% (p1=0,034) у пациентов, находящихся на ИВЛ, по сравнению с больными 1-й группы.
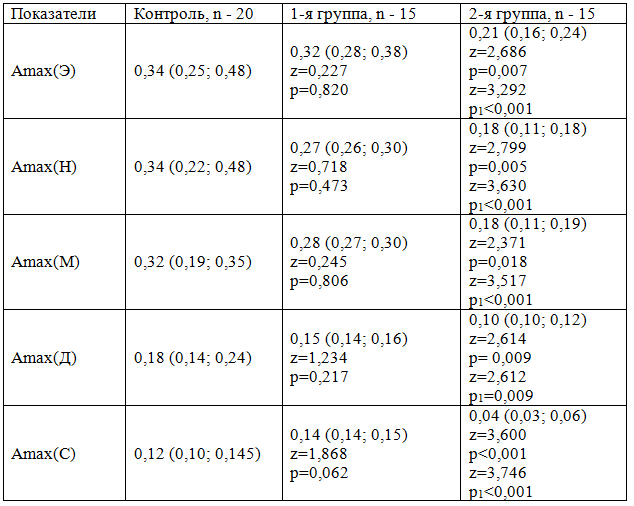
При анализе амплитуд колебаний кровотока в различных диапазонах (Amax(Э), Amax(Н), Amax(М), Amax(Д), Amax(С)) (табл. 2) не выявлено отличий у пациентов, не требующих респираторной поддержки, относительно контроля.
У больных, находящихся на ИВЛ, Amax(Э) снижалась в 1,6 раза (p=0,007) по сравнению со здоровыми людьми, и на 35% (p1<0,001), по сравнению с пациентами с сохраненным самостоятельным дыханием.
При анализе максимальной амплитуды колебаний в нейрогенном диапазоне Amax(Н) установлено, что показатель снижался в 1,8 раза (p=0,005) у пациентов находящихся на ИВЛ по сравнению с контрольной группой. Кроме того установлено, что Amax(Н) у пациентов, нуждающихся в респираторной терапии по сравнению с пациентами с сохраненным самостоятельным дыханием была меньше на 34% (p1<0,001).
Установлено снижение Amax(М) в 1,7 раза (p=0,018) у пациентов находящихся на ИВЛ по сравнению создоровыми людьми. При этом, Amax(М) снижалась у пациентов находящихся на ИВЛ по сравнению с пациентами 1-й группы на 34% (p1<0,001).
При исследовании максимальной амплитуды колебаний в дыхательном диапазоне Amax(Д), отмечено снижение данного показателя у пациентов находящихся на ИВЛ по сравнению с группой контроля в 1,8 раза (p=0,009), и на 34% (p=0,009) по сравнению с пациентами 1-й группы.
У больных находящихся на ИВЛ, по сравнению с группой контроля Amax(С) снижалась в 3 раза (p<0,001). При этом Amax(С) уменьшалась на 74% (p1<0,001) по сравнению с пациентами, которым не выполнялась принудительная вентиляция.
Таблица 2. Значения амплитуд колебаний кровотока в различных диапазонах у больных с гриппом A/H1N1 (Ме (25-й;75-й))
Снижение амплитуды колебаний в нейрогенном и миогенном диапазоне у больных с тяжелым течением гриппа A/H1N1, вероятно, связано с системной вазоконстрикцией, вследствие развившейся симпатотонии, как типовой ответной реакции на стресс и воспаление, и являющейся, возможно, предиктором развития полиорганной недостаточности.
Уменьшение амплитуд колебаний в дыхательном диапазоне у больных с тяжелым течением гриппа A/H1N1, находящихся на ИВЛ, связано, по нашему мнению, с отрицательным влиянием ИВЛ на внутригрудное давление. В частности, при проведении ИВЛ отсутствует характерное для физиологического дыхания отрицательное внутригрудное давление при вдохе, обеспечивающее приток крови к правым отделам сердца.
Наличие септического очага у больных приводило к развитию синдрома системной воспалительной реакции, который является следствием поступления в кровоток провоспалительных цитокинов и других биологически активных веществ, в количествах, в сотни раз превышающие необходимые для реализации физиологических функций концентрации. Цитокины, в свою очередь, влияют на сократимость миокарда, взаимодействуют с эндотелием, гладкомышечными клетками сосудов, тем самым в той или иной степени оказывая влияния на регуляцию микрокровотока.
Известно, что провоспалительные цитокины индуцируют адгезию нейтрофилов к эндотелию, способствуют развитию феномена «краевого стояния» тромбоцитов, активируют лимфоцитарно-тромбоцитарное взаимодействие [1]. Такие реакции приводят к замедлению кровотока и ухудшению тканевого метаболизма. Кроме того, возможен сбой локальных механизмов регуляции сосудистого тонуса, реализуемых через систему NOs-NO. Также, при развитии ОРДС у пациентов с тяжелым течением гриппа A/H1N1, происходит экспрессия большого количества цитокинов и других биологически активных веществ (БАВ) из эндотелиоцитов при повреждении альвеолярно-капиллярной мембраны. Возникающая на этом фоне острая дыхательная недостаточность приводит к развитию гипоксии и ацидоза, играющих важную роль в развитии эндотелиальной дисфункции.
Таким образом, нарушения микроциркуляции у больных с тяжелыми пневмониями на фоне гриппа A/H1N1 носят выраженный характер и коррелируют с тяжестью заболевания, что, по-видимому, является ранним предиктором полиорганной недостаточности.
Выводы
1. Установлено, что у больных с пневмониями на фоне гриппа A/H1N1, не нуждающихся в респираторной поддержке, в 1,2 раза снижался показатель микроциркуляции (ПМ) относительно контрольной группы.
2. Установлено, что у пациентов с тяжелым течением гриппа A/H1N1 без респираторной поддержки (Кv) уменьшался в 1,6 раза, а у больных требующих проведения ИВЛ – возрастал в 1,5 раза по сравнению со здоровыми.
3. Установлено, что у больных находящихся на ИВЛ, в отличии от пациентов, не требующих респираторной поддержки, уменьшались максимальные амплитуды колебаний кровотока в эндотелиальном, нейрогенном, миогенном, дыхательном и пульсовом диапазонах.
