Введение. Физическое развитие - результат взаимодействия генетических факторов и факторов внешней среды, является существенным объективным критерием состояния здоровья ребенка. Недостаточное питание, дефекты ухода или воспитания, неблагополучие окружающей среды задерживают процессы роста и развития [1, 2].
У детей раннего возраста, перенесших перинатальные поражения ЦНС гипоксически-ишемического генеза, отмечаются нарушения темпов физического развития, преимущественно касающиеся массы тела [3]. Однако, у таких детей могут наблюдаться отклонения физического развития по типу снижения и массы, и длины тела с формированием микросоматотипа в раннем возрасте и астенического типа конституции в подростковом возрасте [11, 13]. Любые отклонения физического развития от нормы свидетельствуют об относительном неблагополучии в состоянии здоровья ребенка [2, 9, 13].
Перинатальные поражения ЦНС существенно влияют на функционирование и развитие органов и систем в раннем возрасте, так как наличие патологического очага в головном мозге нарушает состояние равновесия в подчиненных системах, в первую очередь в вегетативной нервной и эндокринной, что повышает возможность развития нарушений физического развития в ответ на любое внешнее воздействие [7, 9, 13].
Публикаций о том, какова может быть взаимосвязь физического развития с функциональным состоянием гипофизарно-тиреоидной системы, гипоталамо-гипофизарно-надпочечниковой системы у детей раннего возраста, перенесших перинатальные поражения ЦНС, недостаточно.
Цель исследования: изучить особенности отдельных показателей гипоталамо-гипофизарно-надпочечниковой и гипофизарно-тиреоидной систем у детей раннего возраста, перенесших перинатальные поражения ЦНС гипоксически-ишемического генеза, в зависимости от физического развития.
Материалы и методы. Под наблюдением находилось 448 детей в возрасте от 1 года до 3 лет, перенесших перинатальные поражения ЦНС гипоксически-ишемического генеза легкой и средней степени тяжести.
Физическое развитие оценивалось по унифицированной методике с использованием местных возрастнополовых нормативов [11]. В зависимости от физического развития были выделены следующие группы: I группу составили дети с нормальным физическим развитием, II группу - дети с дефицитом массы тела, III группу составили дети с низким ростом, IV группу – с сочетанием низкого роста и дефицита массы тела.
Определяли концентрацию адренокортикотропного гормона (АКТГ) в плазме крови, соматотропного гормона (СТГ), тиреотропного гормона (ТТГ), трийодтиронина (Т3), тироксина (Т4), кортизола в сыворотке крови методом твердофазного хемилюминесцентного иммунологического анализа на приборе «Immulite» реактивами фирмы «DPC» (США); концентрацию кортиколиберина (КЛ) в сыворотке крови – методом иммуноферментного анализа на приборе «Rider-EL 880» (США) реактивами фирмы «Peninsula Laboratories» (Канада).
Статистическая обработка материала проводилась с использованием программ MS Exсel XP и Statistica 6.0. Вычислялась средняя арифметическая величина (М), среднее квадратичное отклонение (σ), средняя ошибка (m). Проводилась оценка достоверности различий статистических показателей в сравниваемых группах (р) по критерию Фишера - Стьюдента (t). Различия считались статистически достоверными при значениях р<0,05. Выявление взаимосвязи между изучаемыми показателями осуществлялось путем расчета коэффициента парной корреляции (r).
Результаты исследования и их обсуждение. Нами были изучены отдельные гормоны гипоталамо-гипофизарно-надпочечниковой системы, являющиеся стрессреализующими гормонами (кортиколиберин (КЛ), адренокорткотропный гормон (АКТГ), кортизол), повышение которых способствует сдвигу метаболизма в сторону катаболических процессов, то есть процессы распада и высвобождения энергии начинают преобладать над анаболическими [12] (табл. 1).
Таблица 1. Показатели гипоталамо-гипофизарно-надпочечниковой системы у детей раннего возраста в зависимости от физического развития (M±m)

Примечание. Достоверность различий между I и II (р1-2), I и III (р1-3), I и IV (р1-4), III и IV (р1-4) : . – р<0,05; .. – р<0,02; ... – р<0,001
Установили, что уровень кортиколиберина (КЛ) в плазме крови у детей II и III групп достоверно не отличался от аналогичного показателя I группы (0,95±0,24 и 0,93±0,24 nmol/L, 0,94±0,19 и 0,93±0,24 nmol/L соответственно). Содержание КЛ у детей IV группы было значительно ниже, чем у детей I группы (0,60±0,11 и 0,93±0,24 nmol/L, р<0,05 соответственно).
Уровень АКТГ у детей III, IV и I групп достоверно не различался (18,51±2,77 и 17,80±1,10 pg/ml, 16,45±1,29 и 17,80±1,10 pg/ml соответственно). У детей II группы содержание АКТГ было более высоким, по сравнению со сверстниками I группы (25,28±3,53 и 17,80±1,10 pg/ml, р<0,02).
Известно, что АКТГ стимулирует синтез кортизола в корковом слое надпочечников и тормозит связывание кортизола с белком, обеспечивающим его выведение, т. е. не только стимулирует образование кортизола, но и «удлиняет жизнь» этого кортикостероида [12].
Кортизол имеет большое значение в развитии ребенка, так как стимулирует катаболизм белков в мышцах и коже, глюконеогенез, синтез гликогена и веществ, влияющих на возбудимость нейронов [10, 11].
У детей III и I групп уровень кортизола достоверно не различался (14,26±1,29 и 13,03±0,67 mg/dl). У детей II и IV группы концентрация кортизола была значительно выше аналогичного показателя I группы (17,78±1,30 и 13,03±0,67 mg/dl, р<0,001; 21,23±1,45 и 13,03±0,67 mg/dl, р<0,001 соответственно). Надо отметить, что концентрация кортизола выше верхней границы физиологической нормы (для мальчиков – 4,9–16,8 mg/dl, для девочек – 5,5–18,9 mg/dl) чаще диагностировалась у детей II и IV группы, в отличие от детей I группы (21,2 и 5,2%, р<0,05; 28,0 и 5,2%, р<0,01 соответственно).
Выявленные изменения концентрации КЛ, АКТГ, кортизола, относящихся к стрессреализующим гормонам, свидетельствуют о том, что у детей раннего возраста с дефицитом массы тела, а также с сочетанием дефицита массы тела и низкого роста гипоталамо-гипофизарно-надпочечниковая система находится в состоянии большей функциональной активности, чем у детей с нормальным физическим развитием, что, вероятно, обусловлено действием стрессовых факторов.
Соматотропный гормон (СТГ) – анаболический, стресслимитирующий гормон, он стимулирует синтез белков, усиливает липолиз и гликогеногенез [4, 8]. Средние значения СТГ у обследованных II, III и I групп достоверно не различались (2,24±0,24 и 2,37±0,24 ng/ml; 1,63±0,20 и 2,37±0,24 ng/ml, соответственно) (табл. 2). У детей IV группы уровень СТГ был достоверно ниже по сравнению с аналогичными показателями как I группы, так и II группы (1,54±0,12 и 2,37±0,24 ng/ml р<0,01; 1,54±0,12 и 2,24±0,24 ng/ml р<0,01).
Расстройства, вызванные гипосекрецией этого гормона, включают в себя остановку развития и недостижение потенциала роста [2, 6, 12], что и наблюдалось у большинства детей IV группы. Кроме того, у 16,0 % детей IV группы снижение СТГ сочеталось с повышенной концентрацией кортизола, а длительно повышенная продукция кортизола приводит к подавлению выработки СТГ [14].
Таблица 2. Показатели гипофизарно-тиреоидной системы у детей раннего возраста в зависимости от физического развития (M±m)
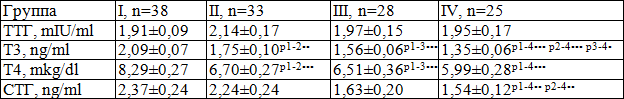
Примечание. Достоверность различий между I и II (р1-2), I и III (р1-3), I и IV (р1-4) группами: . – р<0,02; .. – р<0,01; ... – р<0,001
Гормон роста проявляет свое биологическое действие лишь в синергизме с другими факторами, среди которых большая роль принадлежит тиреоидным гормонам [4, 6].
Тиреоидные гормоны обеспечивают синтез структурных белков, гормона роста, ускорение обменных процессов и являются необходимым условием для нормального роста и дифференцировки клеток нервной системы, нормального физического развития ребенка, являются стресслимитирующими гормонами [5].
Тиреотропный гормон гипофиза играет центральную роль в регуляции роста и функционирования щитовидной железы. Он стимулирует синтез тиреоидных гормонов [5]. По принципу обратной связи Т3 и Т4 подавляют биосинтез и секрецию ТТГ. Наоборот, при снижении выработки этих гормонов секреция ТТГ гипофизом усиливается [7, 11].
Установлено, что у детей II, III, IV и I группы уровень ТТГ достоверно не различался (2,14±0,17 и 1,91±0,09 mIU/ml; 1,97±0,15 и 1,91±0,09 mIU/ml; 1,95±0,17 и 1,91±0,09 mIU/ml соответственно) (табл. 2).
Содержание Т3 у детей II, III и IV групп находилось на достоверно более низком уровне, по сравнению с детьми I группы (1,75±0,10 и 2,09±0,07 ng/ml р<0,01; 1,56±0,06 и 2,09±0,07 ng/ml р<0,001; 1,35±0,06 и 2,09±0,07 ng/ml р<0,001 соответственно). Кроме того, у детей IV группы концентрация Т3 была значительно меньше, чем у их сверстников из II и III групп (р<0,001; р<0,02 соответственно).
Уровень Т4 у обследованных II, III и IV групп был достоверно ниже, чем у детей I группы (6,70±0,27 и 8,29±0,27 mkg/dl, р<0,001; 6,51±0,36 и 8,29±0,27 mkg/dl, р<0,001; 5,99±0,28 и 8,29±0,27 mkg/dl, р<0,001 соответственно).
Надо отметить, что средние значения Т3 и Т4 во всех обследуемых группах детей находились в пределах возрастной нормы.
Следовательно, более низкий уровень гормонов щитовидной железы у детей с дефицитом массы тела, низкой длиной тела и их сочетанием, по сравнению с детьми с нормальным физическим развитием, свидетельствует о более низкой функциональной активности щитовидной железы.
Выводы. Суммируя выше изложенное, можно заключить следующее: дети с отклонениями физического развития - с дефицитом массы тела и его сочетанием с низким ростом, характеризуются напряжением гипоталамо-гипофизар-но-надпочечниковой системы и снижением функциональной активности гипофизарно-тиреоидной системы, что свидетельствует о нейроэндокринной дизрегуляции, повышенной стресс-реактивности, снижении адаптационного потенциала и обуславливает необходимость дифференцированного подхода к профилактике и коррекции отклонений физического развития у этих детей.
