Введение. В настоящее время существуют определенные противоречия, касающиеся влияния бессимптомной гипогликемии, возникшей в неонатальный период, на возникновение отдаленных психоневрологических расстройств, особенно это касается бессимптомной гипогликемии, то есть не имеющей выраженных клинических проявлений [3]. Несмотря на недостаточность клинических доказательств того, что гипогликемия приводит к неврологическим нарушениям, экспериментальных работ, указывающих, что выраженная и/или длительная гипогликемия коррелирует с неврологическими повреждениями, достаточно много. Например, в литературном обзоре Auer R.N. и Siesio B.[7] указывается, что кора головного мозга, гиппокамп и хвостатое ядро - те области, на которые преимущественно влияет экспериментальная гипогликемия. Конечно, у конкретного ребенка, особенно с бессимптомной гипогликемией, достаточно сложно с уверенностью утверждать о повреждении мозга, тем более что установлены компенсаторные механизмы, препятствующие развитию повреждений ткани центральной нервной системы (ЦНС). Прежде всего к этим механизмам относится использование альтернативных субстратов энергии. Исследования Amiel S.A. [8] показали, что, как и у взрослых, при гипогликемической коме нейроны головного мозга новорожденных в повышенном количестве потребляют лактат. К защитным механизмам при гипогликемиях также относят увеличение скорости мозгового кровотока. Особенно значительно она увеличивается у недоношенных новорожденных при концентрации глюкозы менее 1,7 ммоль/л [9]. Несмотря на то, что повреждающий эффект гипогликемии известен давно, до сих пор нет единого мнения о степени повреждающего действия гипогликемии на мозг. Повышенную склонность к развитию гипогликемии у недоношенных отмечают вследствие малых запасов гликогена в печени и недостаточной зрелости глюконеогенеза. Гомеостаз глюкозы у здоровых доношенных новорожденных устанавливается в течение 5-7 дней жизни; недоношенным для этого может потребоваться 1-2 недели [5]. Примерно у половины новорожденных с выявленной лабораторно гипогликемией отсутствуют какие-либо клинические проявления, или наблюдается моносимптомность, атипичная клиника. Причину этого видят в том, что мозг новорожденного в 40 раз более активно, чем мозг взрослого утилизирует кетоновые тела, за счет которых он может черпать до 15- 30% энергетических потребностей. Считают, что у детей с бессимптомной гипогликемией имеется более выраженная транзиторная физиологическая гиперкетонемия. Вероятно, имеют значения и особенности уровней контринсулярных гормонов в крови (глюкагона, глюкокортикоидов, соматостатина, гормона роста, трийодтиронина) [7]. Непосредственной причиной развития гипогликемии является несоответствие между высокими потребностями в энергетических субстратах и недостаточным питанием на фоне низких запасов гликогена и подкожного жира у недоношенных новорожденных. Более редкой причиной развития является гиперинсулинизм. Следует учитывать, что такие дефекты ухода, как недостаточное питание и гипотермия, способствуют развитию гипогликемии, также как и резкая отмена массивной и длительно проводившейся инфузии декстрозы. Опасность гипогликемии заключается в генерализованном нарушении метаболических процессов вследствие дефицита энергии, что в дальнейшем может приводить к неврологическим нарушениям. Гипогликемия чрезвычайно опасна в раннем неонатальном периоде для недоношенных детей еще и тем, что, вызывая компенсаторное повышение мозгового кровотока, она может способствовать возникновению и прогрессированию внутрижелудочковых кровоизлияний [5].
Цель исследования: установить влияние бессимптомной гипогликемии на неврологический статус у недоношенных новорожденных с гипоксическим поражением центральной нервной системы в неонатальном периоде и в динамике до 1 года.
Материалы и методы. За период с 2009 – 2011 г. под наблюдением находились 110 недоношенных детей с рождения до 1 года жизни с гипоксически - ишемической энцефалопатией (ГИЭ) различной степени тяжести. Диагноз ГИЭ был выставлен согласно классификации перинатальных поражений нервной системы у новорожденных, разработанной Российской ассоциацией специалистов перинатальной медицины. Обследование детей проводилось на базе МЛПУ РД №4 г. Томска (главный врач Л.А. Агаркова), отделения реанимации и интенсивной терапии, патологии новорожденных и II этапа выхаживания недоношенных, поликлинического отделения №1, №2 МЛПУ ДГБ №1 г. Томска (главный врач В.А. Карташов).
Дети были разделены на следующие группы: в контрольную группу вошли 25 доношенных новорожденных, имеющих II группу здоровья.
Первую группу составили 30 недоношенных новорожденных со сроком гестации 32-36 недель с выявленной бессимптомной гипогликемией; вторую группу составили 19 новорожденных со сроком гестации 26-31 недель с выявленной бессимптомной гипогликемией; третью группу составили 61 недоношенный новорожденный без выявленной бессимптомной гипогликемии со сроком гестации 26-36 недель. Все дети имели гипоксическое поражение центральной нервной системы различной степени тяжести (среднетяжелое и тяжелое). Исследуемые группы детей были сопоставимы по данному критерию.
Преобладающим видом вскармливания с рождения и до 1 месяца у детей в III исследуемой группе явилось естественное вскармливание - 49 (80,3%). В I и II группах дети в основном получали искусственное вскармливание адаптированной молочной смесью 20 (61,6%) и 17 (89,4%) соответственно, на смешанном вскармливании во всех группах регистрировалось равное количество детей 6 (10%). Исследовали пуповинную кровь, взятую после рождения ребенка и кровь на 3-5сутки, 7-10 сутки жизни, взятую из периферической вены объемом 1-2 мл утром, натощак, до проведения инфузионной терапии. Определение гликемического профиля (6.00, 12.00, 00.00, 3.00) проводилось глюкометром фирмы OneTouch и соответствующими тест – полосками. Критерием неонатальной гипогликемии считали снижение уровня глюкозы в крови ниже 2,3 ммоль/л (в сыворотке) или ниже 2,6 ммоль/л (в плазме) [7]. Если концентрация глюкозы крови у новорожденного ребенка была ниже 2,6 ммоль/л, то согласно рекомендациям экспертов ВОЗ: новорожденный получал питание (грудное вскармливание, либо кормление из бутылочки или через зонд); измерение глюкозы крови проводилось повторно через 1 час и перед следующим кормлением (через 3 часа). Если концентрация глюкозы менее 2,6 ммоль/л, то глюкозу в дозе вводили внутривенно вначале 0,2 г/кг/мин (2 мл 10% раствора в течение 1 минуты), а затем в дозе 6-8 мг/кг/мин (3,6 - 4,8 мл/кг/ч 10% раствора глюкозы). Контрольный анализ на гликемию повторяли через 1 час [9].
Обследование новорожденных детей исследуемых и контрольной группы проводилось в несколько этапов. На I этапе (родильный дом) проводился сбор и оценка биологического, акушерско-гинекологического анамнеза у матерей, сбор данных об истории течения беременности и родов. Оценивали общее состояния ребенка при рождении, гестационный возраст, пол, антропометрические показатели, оценку по шкале Апгар и необходимый объем реанимационных мероприятий. На II этапе (отделение реанимации и интенсивной терапии, отделение патологии и II этап выхаживания недоношенных) оценивали динамику симптомов и синдромов заболевания, проводили лабораторные и инструментальные методы исследования. На III этапе (амбулаторно-поликлиническом) оценивали динамику течения заболевания, общее состояние ребенка в возрасте до 1 года с оценкой нервно-психического статуса, двигательных, речевых функций согласно метода Л.Т. Журбы [3]. На всех этапах исследования проводилась оценка физического развития (масса тела, рост) согласно диаграммам роста для недоношенных детей с учетом постконцептуального возраста [1].
На каждом этапе всем новорожденным проводилась нейросонография и допплерография сосудов головного мозга (7-10 дней и 1 мес.), рентгенография черепа, шейного отдела позвоночника и органов грудной клетки.
Осмотр узкими специалистами (окулист, хирург, отоларинголог) проводили на II и III этапе согласно стандартам. По показаниям на II этапе наблюдения с лечебно-диагностической целью проводилась люмбальная пункция по общепринятой методике.
В декретированные сроки проводились стандартные лабораторные исследования: общий анализ крови, биохимический анализ крови (определение белка, билирубина и его фракций, глюкозы, аминотрансфераз, щелочной фосфатазы, С- реактивного белка, кальция, фосфора, калия, натрия), общий анализ мочи, копрологическое исследование. Все дети были проконсультированы неврологом и эндокринологом.
Статистическую обработку полученных результатов проводили с помощью пакетов Statistiсa 6, Miсrosoft Exel 2007.
Проверка нормальности распределения выборок проводилась с помощью W-критерия Шапиро-Уилки. Для каждого показателя в группах наблюдений вычислялись: среднее значение (М) и среднюю ошибку средней величины (m). Для сравнительной оценки частот в группах был использован критерий χ2. В случае, когда значение в одной из ячеек таблицы частот было менее 5, сравнение проводилось с помощью одностороннего точного критерия Фишера. Достоверность различия для выборок между двумя средними оценивалась по U-критерию Манна-Уитни. Различия между средними величинами в сравниваемых группах считались достоверными при р≤0,05.
Результаты исследования и их обсуждение. Проведенный анализ показал, что среди соматической патологии у матерей в исследуемых группах ведущей являлась патология сердечно-сосудистой системы (от 10,5% - до 36%), частота встречаемости заболеваний крови (анемия, тромбофилия) в группе с выявленной гипогликемией имела более высокий процент 26,6% по сравнению с группой без гипогликемии 16,3%. Миопия выявлялась только в группе детей со сроком гестации 36-32 недели с выявленной гипогликемией 13,3%. Гинекологические заболевания регистрировались во всех исследуемых группах примерно с одинаковой частотой: в I группе 33,3%, во II группе 42,1%, III группе 26,2%. В большинстве случаев беременность протекала на фоне угрозы прерывания: в I группе (60%), III группе (32,7%), гестоза различной степени тяжести (р<0,001). Родоразрешение путем кесарево сечения в исследуемых группах преобладало над срочными родами, основным из показаний к которому являлась отслойка нормально расположенной плаценты (р<0,001). Срочные роды чаще регистрировались у женщин в группе контроля (68%).
Диагноз симптоматической гипогликемии недоношенным детям I и II групп не был поставлен, так как симптомы гипогликемии (нистагм, снижение тонуса глазных мышц; срыгивания, анорексия, вялость, тремор, судороги, апноэ, приступы тахипноэ, склонность к гипотермии, бледность кожных покровов и др.) разнообразны и неспецифичны и могут развиваться также у новорожденных с нормогликемией на фоне гипоксически - ишемической энцефалопатии. Поэтому уровень глюкозы в сыворотке крови определяли лабораторным методом. Ведущим в клинической картине ГИЭ у них являлся синдром возбуждения. Чаще всего данный синдром встречался в группе новорожденных со сроком гестации 31-26 недель с выявленной бессимптомной гипогликемией 16 (84,2%), по сравнению с группой недоношенных детей без выявленной гипогликемии 33 (54,09%). Синдром угнетения с одинаковой частотой встречался в I и II исследуемых группах 20 (33%), гипертензионный и синдром двигательных нарушений преобладали в I группе 10 (33,3%). Судорожный синдром преобладал в группе недоношенных со сроком гестациии 31-26 недель с выявленной бессимптомной гипогликемией 31,5%; синдром вегето-висцеральных нарушений с одинаковой частотой (5,2-6,6%) выявлялись во всех исследуемых группах. Нарушение обмена глюкозы (гипогликемия) было выявлено у 49 (44,5%) исследуемых недоношенных новорожденных с гипоксическим поражением центральной нервной системы (табл. 1). Чаще всего гипогликемия регистрировалась в 1-е, 3-5 сутки после рождения (р<0,001). Средние значения уровня глюкозы в крови составили 1,7- 2,3 ммоль/л.
Таблица 1. Содержание глюкозы в капиллярной крови у новорожденных исследуемых групп в течение первых 10 дней жизни, М±m

Примечание: здесь и далее достоверность различий групп недоношенных новорожденных (I–III) по сравнению с группой контроля: ▪р<0,05, ▪▪р< 0,01, ▪▪▪р<0,001.
По данным литературы, несмотря на отсутствие симптоматики гипогликемии у новорожденных детей в данных группах происходит усиленная выработка катехоламинов, что приводит к снижению перистальтики кишечника, перевариванию лактозы, а, соответственно, снижению образования глюкозы, поэтому необходим тщательный мониторинг и своевременная коррекция данного состояния. Концентрация глюкозы у новорожденного в крови вены пуповины составляет от 60 - 80% от концентрации в венозной крови матери. Сразу после рождения ее концентрация снижается, а через 2-3 часа после рождения начинает повышаться и стабилизироваться, что обусловлено «выбросом» глюкозы печенью. Доказано, что у новорожденного ребенка активируется не только гликогенолиз, но и глюконеогенез. Но многие патологические процессы (гипоксия, гипотермия, инфекционные процессы и др.) могут нарушать механизмы адаптации новорожденного. Соответственно, у детей в этих группах необходимо мониторировать концентрацию глюкозы в крови [9].
Динамика показателей допплерографического исследования у недоношенных новорожденных в исследуемых группах в раннем неонатальном периоде выявило, что наиболее низкие показатели скорости мозгового кровотока у недоношенных новорожденных со сроком гестации 27-31 неделя (II группа) с бессимптомной гипогликемией (табл. 2).
Таблица 2. Показатели допплерографии у недоношенных новорожденных, M±m
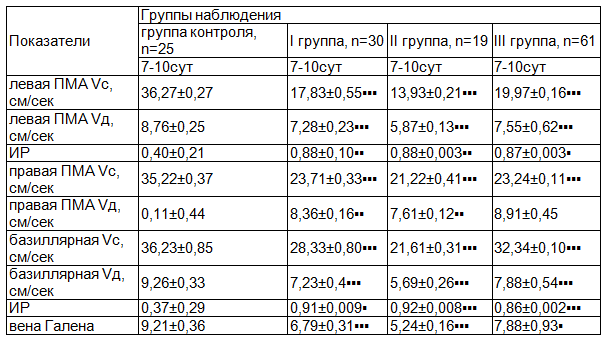
Показатели мозгового кровотока по данным допплерографии у недоношенных новорожденных исследуемых групп оказались достоверно ниже соответствующих показателей у детей группы контроля. Так, систолическая скорость кровотока передней мозговой артерии см/сек в I группе составила 17,83±0,55, во II группе 13,9±3 0,21, что в 2,7 раза ниже контрольных значений 36,27±0,27 (р<0,001); диастолическая скорость кровотока также была достоверно снижена в исследуемых группах (р<0,001). По сравнению с контрольными данными, показатели кровотока по базиллярной артерии (систолическая и диастолическая); венозный отток по вене Галена в данных группах оказались достоверно снижены в 1,2 раза (р<0,001).
В неонатальном периоде у недоношенных новорожденных с ГИЭ регистрировался высокий уровень нейронспецифической енолазы в сыворотке крови (табл. 3) на фоне нарушения мозгового кровотока (снижение скорости кровотока в магистральных артериях сосудов головного мозга и скорости венозного оттока), что отражало степень тяжести гипоксического поражения ЦНС (р<0,001). Наиболее выраженные признаки нарушения мозгового кровотока выявлялись в группах детей с перенесенной бессимптомной гипогликемией (табл. 2).
Таблица 3. Содержание нейронспецифической енолазы в сыворотке крови, M±m

Полученные данные исследования уровня гормонов щитовидной железы выявили наличие транзиторного гипотиреоза у недоношенных детей исследуемых I и II групп в неонатальном периоде, который проявлялся повышенным уровнем ТТГ и сниженными и/или нормальными показателями FТ3, FТ4 в сыворотке крови при отсутствии патологических изменений по данным ультразвукового исследования щитовидной железы (табл. 4).
Таблица 4. Содержание ТТГ, FТ3, FТ4 в сыворотке крови у недоношенных новорожденных с ГИЭ, M±m

По данным литературы, у недоношенных детей транзиторный неонатальный гипотиреоз (ТНГ) диагностируется в возрасте до 2 месяцев у 62% при сроках гестации 28-32 недели и у 23% при сроках гестации 33-36 недель [4]. Наиболее частые причины ТНГ – недостаточная функциональная активность гипоталамо-гипофизарно-тиреоидной системы у глубоконедоношенных детей, нарушение синтеза и периферического метаболизма тиреоидных гормонов при гипоксии, внутричерепных кровоизлияниях, респираторном дистресс-синдроме, анемии. Стойкая недостаточность тиреоидных гормонов приводит к уменьшению количества нейронов, недоразвитию зрительных и слуховых анализаторов, нарушению миелинизации нервных волокон. Кроме того, в нейронах мозга, синапсах снижается образование моноаминов, нейропептидов, нейромедиаторов и других биологически активных веществ, снижено количество рецепторов к катехоламинам, что сопровождается угнетением функции ЦНС [6].
Изучение показателей нервно-психического развития недоношенных новорожденных с гипоксическим поражением ЦНС на протяжении первого года жизни проводилось с учетом постконцептуального возраста методом количественной оценки двигательных, речевых и психических функций в возрасте 1-го, 6, 9 и 12 месяцев согласно метода Л.Т. Журбы. Проведенный анализ показал, что в течение первого года жизни в I и II группе с выявленной бессимптомной гипогликемией отмечалось достоверное снижение показателей количественной оценки (в возрасте одного месяца 24,90±0,26, девятого месяца (24,53±0,57) по сравнению с группой контроля (р<0,001), что соответствовало задержке нервно-психического развития детей в данных группах. В возрасте 1 года у детей второй исследуемой группы показатели количественной оценки составили 26,95±0,346 баллов (р<0,001), что достоверно ниже аналогичных показателей в других группах и соответствовало группе риска (24-26 баллов).
Выводы. Таким образом, бессимптомная гипогликемия (при уровне глюкозы крови менее 2,6 ммоль/л), регистрирующаяся при рождении и сохраняющаяся более 3-5 суток жизни на фоне транзиторного гипотиреоза у недоношенных новорожденных с гипоксическим поражением центральной нервной системы, оказывает неблагоприятное влияние на неврологический статус, усугубляя тяжесть неврологических нарушений в неонатальном периоде. В течение первого года жизни у детей в I и II группе с выявленной бессимптомной гипогликемией отмечалось достоверное снижение показателей количественной оценки (в возрасте одного месяца 24,90±0,26, девятого месяца 24,53±0,57) по сравнению с группой сравнения (р<0,001), что соответствовало задержке нервно-психического развития детей в данных группах. В возрасте 1 года у детей с ЭНМТ при рождении со сроком гестации 27-29 недель и перенесенной бессимптомной гипогликемией в неонатальном периоде (II исследуемой группы) показатели количественной оценки составили 26,95±0,346 баллов (р<0,001), что достоверно ниже аналогичных показателей в других группах и соответствовало группе риска (24-26 баллов).
