Врожденные пороки сердца (ВПС) составляют в среднем около 35% всех врожденных пороков развития, и занимают первое место среди причин младенческой смертности (45-46%) в этой группе [1]. Большинство авторов сходятся во мнении, что частота ВПС варьирует от 19 до 75 на 1000 родившихся живыми [3, 11-14]. В структуре ВПС, а это более 90 вариантов и около 200 различных их сочетаний, около 50-60 % пороков относятся к порокам с обогащением малого круга кровообращения. Естественное течение таких пороков сопровождается развитием легочной гипертензии, сердечной недостаточности и других осложнений [10]. Не менее 30% новорожденных имеют критические пороки сердца, которые в 70-80% случаев требуют неотложной помощи по жизненным показаниям в первые часы и дни жизни [7].
Пороки сердца могут быть одиночными врожденными дефектами или появляться в сложных сочетаниях. У новорожденных наблюдаются более 35 известных ВПС, однако менее десяти из них являются общими [2]. Наиболее распространенными являются пороки так называемой «большой шестерки»: дефект межжелудочковой перегородки, открытый артериальный проток, транспозиция магистральных артерий, дефект межпредсердной перегородки, тетрада Фалло, коарктация аорты. Сюда можно добавить свободную группу стеноза и атрезии легочной артерии. Вместе они составляют более 66% всех врожденных пороков сердца [9].
Среди инструментальных методов исследования наиболее информативна и доступна эхокардиография (ЭхоКГ), позволяющая поставить топический диагноз порока. Современное эхокардиографическое оборудование является малоинвазивным, обеспечивает высококачественную визуализацию сердечных структур, позволяет детально оценить внутрисердечную гемодинамику, параметры контрактильной, насосной и релаксационной способности сердца [4]. эхокардиография является «первичным диагностическим звеном», на основании которого планируется дальнейший алгоритм обследования пациента, тактика и объем хирургического лечения [8].
Несмотря на достигнутые успехи в современной медицине, недостаточно сведений об особенностях адаптации сердечно-сосудистой системы и всего организма новорожденных детей в неонатальном периоде к изменяющимся гемодинамическим условиям при ВПС.
Поскольку в структуре врожденных пороков сердца, по данным разных авторов, на пороки с обогащением малого круга кровообращения (открытый артериальный проток, дефект межжелудочковой перегородки, дефект межпредсердной перегородки и др.) приходится от половины до двух третей всех сердечных аномалий [5, 6], нами была предпринята попытка изучить эхокардиографические показатели у детей именно с этими пороками.
Цель исследования: изучить особенности клинико-функциональных нарушений со стороны сердечно-сосудистой системы у новорожденных при врожденных пороках сердца с обогащением малого круга кровообращения в периоде адаптации.
Материалы и методы. В настоящей работе обследовано 50 новорожденных детей с врожденными пороками сердца с обогащением малого круга кровообращения: открытое овальное окно (ООО), открытый артериальный проток (ОАП), дефект межпредсердной перегородки (ДМПП), дефект межжелудочковой перегородки (ДМЖП), транспозиция магистральных сосудов (ТМС), тотальный аномальный дренаж легочных вен (ТАДЛВ), полный открытый атриовентрикулярный канал (ОАВК), общий артериальный ствол (ОАС).
Исследования проводились на базе РСНПМЦ Акушерства и гинекологии и Городской детской клинической больницы №5. Все дети были разделены на 2 группы. В первую группу вошли 20 недоношенных новорожденных, во вторую группу были включены 30 доношенных новорожденных детей. Среди новорожденных 1-й группы было 14 детей с часто встречающимися (ООО, ОАП, ДМПП, ДМЖП) и 6 детей с критическими врожденными пороками сердца (ТМС, ТАДЛВ, ОАВК, ОАС), а во 2-й группе 16 детей с функционирующими фетальными коммуникациями и дефектами межпредсердной и/или межжелудочковой перегородки и 14 детей с критическими врожденными пороками сердца.
Проведено клиническое обследование и эхокардиографическое исследование сердца новорожденных. ЭхоКГ выполнялось на ультразвуковом аппарате «PHILIPS HD 15» производства «Филипс Ультрасаунд, Инк.» в М- и В-режимах с использованием секторного датчика с фазированной решеткой S8-3 по общепринятой методике.
Полученные данные статистически обрабатывались на персональном компьютере Pentium-4 по программам, разработанным в пакете прикладных программ EXCEL с использованием библиотеки статистических функций с вычислением среднеарифметической (М), среднего квадратичного отклонения (s), стандартной ошибки (m), относительных величин (частота, %), критерия Стьюдента (t) с вычислением вероятности ошибки (Р). Различия средних величин считали достоверными при уровне значимости Р<0,05, с учетом указаний по статистической обработке данных клинических и лабораторных исследований.
Результаты и их обсуждение. При распределении обследованных новорожденных детей по полу, оказалось среди недоношенных детей количество мальчиков и девочек было одинаково и составило по 50%. Среди доношенных новорожденных с ВПС мальчиков было больше, их число составило 60%, а девочек 40%. Всего в общей картине среди новорожденных детей с ВПС больше было мальчиков 28 (56%), чем девочек 22 (44%).
Вместе с тем, нами был проведен анализ частоты рождения детей с ВПС при различных сроках гестации с учетом половой принадлежности (табл. 1).
Таблица 1. Общая характеристика новорожденных детей по сроку гестации
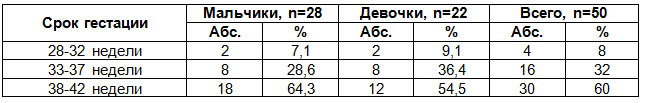
Детей с гестационным возрастом от 28-32 недель среди мальчиков родилось 2 (7,1%), а среди девочек - 2 (9,1%). При сроке гестации 33-37 недель среди мальчиков родилось около трети, что составило 8 (28,6%), а среди девочек в этом сроке гестации рождалось более трети - 8 (36,4%) новорожденных. Число детей с гестационным возрастом от 38-42 недель среди мальчиков составило 18 (64,3%), что было больше, чем среди девочек - 12 (54,5%).
Результаты данного исследования показывают также, что среди всех детей с ВПС с малым гестационным возрастом 28-32 недель рождается 8% из них, при сроке гестации 33-37 недель рождается примерно треть всех новорожденных с ВПС, что составляет 32%. Среди общего числа детей с ВПС 60% новорожденных рождается при сроке гестации 38-42 недели.
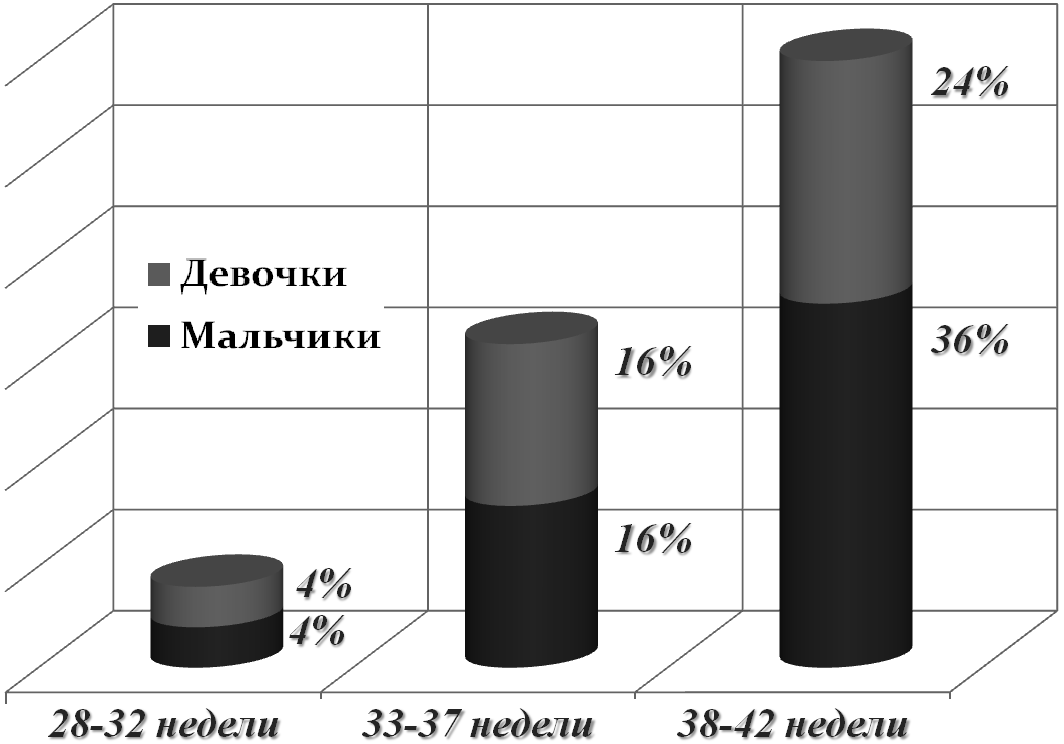
Рис. 1. Общая характеристика новорожденных с ВПС по гестационному возрасту.
Нами также было проанализировано состояние новорожденных детей с ВПС при рождении (табл. 2).
Таблица 2. Сравнительная оценка состояния новорожденных с ВПС при рождении по шкале Апгар
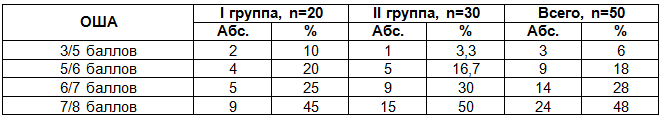
Результаты наших исследований показали, что среди недоношенных детей 30% новорожденных с ВПС рождаются с низкими оценками по шкале Апгар. Из них: с оценкой 3/5 баллов – 10%, с оценкой 5/6 баллов – 20%. Среди доношенных детей с низкими оценками рождается 20%. Из них: 3/5 балла – 3,3%, 5/6 баллов – 16,7%.
В общей картине среди всех детей почти четверть детей рождается с низкими оценками по шкале Апгар (24%). Около трети детей с ВПС рождается с оценкой по шкале Апгар 6/7 баллов (28%), чуть меньше половины новорожденных детей рождается с оценками по шкале Апгар 7/8 баллов (48%).
На первом этапе функционального исследования сердечно-сосудистой системы нами были проанализированы размеры анатомических дефектов при некоторых видах ВПС с обогащением малого круга кровообращения у доношенных и недоношенных новорожденных, так как величины таковых во многом определяют степень гемодинамических нарушений (табл. 3).
Таблица 3. Размеры анатомических дефектов при некоторых видах ВПС
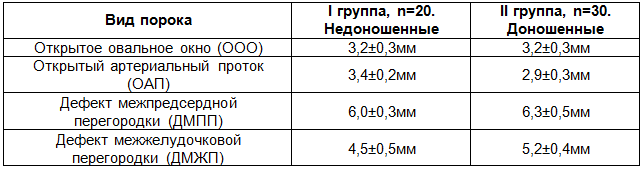
У недоношенных новорожденных детей средние размеры анатомических дефектов при ООО (3,2±0,3мм), ОАП (3,4±0,2мм), ДМПП (6,0±0,3мм), ДМЖП (4,5±0,5мм) не имели достоверных различий с доношенными детьми (соответственно 3,2±0,3мм, 2,9±0,3мм, 6,3±0,5мм, 5,2±0,4мм). Это означало, что с учетом анатомо-физиологических особенностей недоношенных детей, размеры указанных дефектов у них были относительно больше, чем у доношенных новорожденных, что значительно усугубляло их клиническое состояние.
Данные ЭхоКГ были проанализированы у недоношенных - I группа и доношенных - II группа новорожденных детей, каждая группа была разделена на подгруппы: Iа, Iб, IIа, IIб. В подгруппы Iа и IIа были включены новорожденные дети с часто встречающимися пороками сердца: ООО, ОАП, ДМПП, ДМЖП.
В подгруппы Iб и IIб были включены новорожденные дети с критическими пороками и смешанными мальформациями: ТМС, ТАДЛВ, полный ОАВК, ОАС. Результаты данных ЭхоКГ у новорожденных представлены в табл. 4.
Таблица 4. Сравнительная характеристика данных эхокардиографии у новорожденных детей с ВПС в группах наблюдения
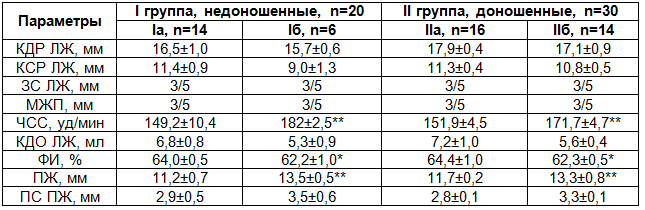
Примечание: * - достоверность различий данных между группами Р<0,05, ** - Р<0,01.
Одним из показателей, характеризующих гемодинамические нарушения у новорожденных детей, с ВПС является изменение конечного диастолического размера левого желудочка (КДР ЛЖ). В нашем исследовании было выявлено, что данный показатель у доношенных новорожденных в обеих подгруппах не имел существенных различий и составил во IIа подгруппе 17,9±0,4 мм, а во IIб подгруппе 17,1±0,9 мм.
У недоношенных детей конечный диастолический размер левого желудочка был несколько меньше, причем, если у детей Iа подгруппы он составил 16,5±1,0 мм, то у новорожденных детей Iб подгруппы, с критическими ВПС, КДР ЛЖ составил 15,7±0,6 мм.
Гемодинамические нарушения у новорожденных детей с ВПС с обогащением малого круга кровообращения могут проявляться уменьшением конечного систолического размера. Конечный систолический размер левого желудочка (КСР ЛЖ) у новорожденных детей Iа и IIа подгрупп не имел существенных различий и был равен соответственно 11,4±0,9 мм и 11,3±0,4 мм. Однако у новорожденных детей с критическими пороками происходило некоторое уменьшение данного показателя, более выраженное у недоношенных детей. Так, у новорожденных Iб подгруппы КСР ЛЖ составило 9,0±1,3 мм, а у детей IIб подгруппы 10,8±0,5мм.
Такие показатели, как толщина задней стенки левого желудочка (ЗС ЛЖ) и межжелудочковой перегородки (МЖП) у всех наблюдаемых новорожденных не имели различий и составляли 3/5 мм.
Анализ частоты сердечных сокращений (ЧСС) показал, что у новорожденных с критическими ВПС, особенно у недоношенных детей, частота сердечных сокращений достоверно выше, чем при часто встречающихся пороках. Так, у недоношенных детей Iа подгруппы ЧСС составила в среднем 149,2±10,4 уд/мин, а в Iб подгруппе - 182±2,5 уд/мин. У доношенных новорожденных IIа подгруппы ЧСС составила 151,9±4,5 уд/мин, а у детей IIа подгруппы ЧСС было равно 171,7±4,7 уд/мин.
Конечный диастолический объем левого желудочка (КДО ЛЖ) у новорожденных детей Iа и IIа подгрупп существенно не различался и соответственно был равен 6,0±2,5 мм и 7,2±1,0 мм. У новорожденных детей Iб и IIб подгрупп данный показатель был несколько ниже и составил соответственно 5,3±0,9 мм и 5,6±0,4 мм.
Фракция изгнания (ФИ) является важным показателем сократительной способности миокарда. У новорожденных детей Iа и IIа подгрупп данный показатель составлял соответственно 64,0±0,5 мм и 64,4±1,0 мм. Было выявлено, что у новорожденных с критическими ВПС как у недоношенных, так и у доношенных данный показатель достоверно уменьшался и составил соответственно 62,2±1,0 мм и 62,3±0,5 мм.
По данным ЭхоКГ у наблюдаемых детей Iа подгруппы размер правого желудочка (ПЖ) составил 11,2±0,7, а у детей IIа подгруппы 11,7±0,2 мм. Среди детей с критическими пороками данный показатель был достоверно выше и составил соответственно 13,5±0,5 мм и 13,3±0,8 мм. Толщина передней стенки правого желудочка (ПС ПЖ) также у детей Iб и IIб группы была несколько больше и составила 3,5±0,6 мм и 3,3±0,1 мм, тогда как в Iа и IIа эти значения были равны 2,9±0,5 мм и 2,8±0,1мм.
Заключение. Таким образом, нами было установлено, что у новорожденных детей при критических ВПС с обогащением малого круга кровообращения на фоне резко выраженной тахикардии (Р<0,001) отмечается тенденция к достоверному увеличению правого желудочка (Р<0,01), уменьшению конечного систолического размера левого желудочка, к уменьшению конечного диастолического объема левого желудочка, а также происходит достоверное уменьшение фракции изгнания (Р<0,05). Указанные изменения могут расцениваться неонатологами как признаки ухудшения состояния новорожденных детей при критических ВПС.
