Введение. Частота задержки внутриутробного развития (ЗВУР) широко варьирует по данным литературы, так зарубежные авторы называют 5-7% детей с ЗВУР у здоровых матерей и до 25% у матерей с отягощенным анамнезом [1,2]; по данным отечественных авторов имеет место увеличение числа новорожденных с ЗВУР за счет недоношенных детей, при этом при симметричной форме ЗВУР имеется не только отставание роста, массы тела, но и выраженная полиорганная недостаточность, что затрудняет их постнатальную адаптацию и определяет высокую частоту соматической патологии и нарушений психомоторного развития [3-5]. Проводя сравнительную характеристику недоношенных детей с ЗВУР разного гестационного возраста (ГВ), авторы получили статистически достоверные различия по показателям массы тела при рождении, увеличению числа патологических состояний и снижению процента прохождения теста (акустического ответа) на оба уха у детей с 32 по 37 неделю гестации, к данным детей без ЗВУР [6]. ЗВУР плода, являясь фактором недоразвития легких, существенно увеличивает риск развития бронхолегочной дисплазии (БЛД), т.к. процессы, ограничивающие темпы роста плода также замедляют развитие и созревание его легочной ткани. Новорожденные с ЗВУР имели более высокий риск развития БЛД при отсутствии постнатальных факторов риска, таких, как развитие инфекционного процесса, открытого артериального протока, респираторных нарушений [7,8].
Постнатальная гипотрофия у недоношенных детей с ЗВУР связана не только с БЛД, получены доказательства прямой взаимосвязи физического и нервно-психического развития с белково-энергетическим и микроэлементным составом питательного субстрата [9,10]. Изучая особенности гормональной регуляции постнатального роста у детей, родившихся с ЗВУР, было показано, что «ростовой скачок» у детей с асимметричным вариантом ЗВУР обеспечивается за счет ускоренных темпов роста в первые 3 месяца жизни. Дети с симметричным вариантом ЗВУР имеют ускоренный рост и после 3-месячного возраста. При этом у них отмечались наиболее высокие значения инсулиноподобный фактор роста -1, соматотропный гормон (СТГ) и иммунореактивного инсулина в крови в возрасте 3-х месяцев, вероятно необходимых для интенсивных темпов роста. Авторы предполагают, что выявленные нарушения смогут служить основой для развития нарушений углеводного обмена в дальнейшей жизни [11].
Цель: изучить особенности течения неонатального периода и показатели физического развития у недоношенных детей с ЗВУР, родившихся с гестационным возрастом (ГВ) 32-36 недель.
Материалы и методы. Всего наблюдали 79 недоношенных детей, родившихся с ГВ 32-36 недель в Государственном Бюджетном Учреждении Здравоохранения Тверской области (ГБУЗ ТО) Областном клиническом перинатальном центре им. Е.М. Бакуниной г. Твери. Основную группу составили 36 недоношенных детей с ЗВУР (1-я группа), группа сравнения - 43 ребенка без ЗВУР (2 группа). По вариантам ЗВУР недоношенные дети основной группы представлены следующим образом: 17 (47,2%) детей имели симметричный, а 19 (58,3%) детей - асимметричный вариант ЗВУР.
Статистическая обработка полученных данных выполнялась общепринятыми методами вариационной статистики на персональном компьютере с использованием программы Microsoft Excel 2007 и пакета программ Statistica 6.0. Достоверность результатов оценивали по критерию Стьюдента (t). Различие считали достоверным при p<0,05.
Таблица 1. Характеристика антропометрических показателей недоношенных детей с ГВ 32-36 недель (M±m)
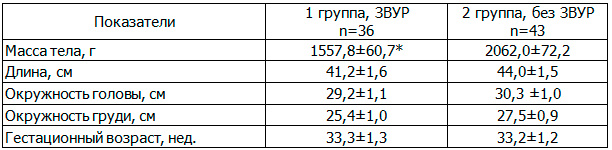
Здесь и в табл. 2: * - различия между группами достоверно (p<0,05).
Соответствие массы тела и роста ребенка при рождении его гестационному возрасту, а также дальнейшая динамика антропометрических показателей до 50 недели постконцептуального возраста (ПКВ) определялись на основании шкалы Фентона Т.Р. с учетом пола ребенка [12]. Оценка физического развития после 50 недели ПКВ проводилась в соответствии с таблицами роста детей [14]. Оценка антропометрических показателей у недоношенных детей проводилась с учетом скорригированного возраста (СВ) в 3, 6 и 12 месяцев.
В работе использовался анализ клинических методов исследования, который включал в себя подробный анализ анамнестических данных, результаты физикального обследования. Проводилось динамическое общеклиническое наблюдение за недоношенными детьми и мониторный контроль жизненно важных функций, включающий измерение артериального давления, частоты сердечных сокращений, показателей сатурации с помощью много функциональных мониторов Phillips 3046А (Германия), достижения оптимальных параметров вентиляции. За период наблюдения проводилось комплексное клинико-лабораторное (общеклинические анализы крови, мочи, биохимическое исследование крови) обследование. Всем детям проведен комплекс инструментальных методов обследования (рентгенография органов грудной клетки, нейросонография, эхокардиография сердца). Степень тяжести БЛД определяли в соответствии с критериями, предложенными в [13].
Результаты и обсуждение. В анамнезе матерей, родивших детей 1-й группы, выявлены следующие достоверные отличия, которые появляются во время беременности: фетоплацентарная недостаточность различных степеней тяжести - 83,3%, во 2-й группе - 32,5% (р=0,026); преэклампсия - 36,1%, во 2-й группе - 2,3% (р=0,003). У матерей 2-й группы достоверно чаще (44,1%) встречались угрозы прерывания беременности против 22,2% у матерей 1-й группы (p=0,006).
После оказания первичных реанимационных мероприятий в родильном зале, 25 (69,4%) детей 1-й группы после рождения были переведены в отделение реанимации и интенсивной терапии по тяжести состояния, обусловленного в основном респираторными нарушениями, в группе сравнения таких детей было 23 (53,5%). Только у детей 1-й группы диагностирован респираторный дистресс синдром (РДС) тяжелой степени - 8 (22,2%), которого не было во 2-ой группе (р=0,010). Искусственная вентиляция легких (ИВЛ) проводилась 9 (25,0%) детям 1-й группы на фоне эндотрахеального введения препарата эндогенного сурфактанта, длительность ИВЛ была от 8 часов до 13 суток (в среднем 4,25 дней), в то время как во 2-й группе проведение ИВЛ не потребовалось. Респираторная поддержка методом спонтанное дыхание с постоянно положительным давлением в дыхательных путях (СРАР) проведена 16 (44,4%) детям 1-й группы, средняя продолжительность составила 3,25 суток. Недоношенным детям 2-й группы проводилась респираторная поддержка только методом СРАР, средняя продолжительность составила менее 3-х суток. Кроме того, в раннем неонатальном периоде 7 (19,4%) недоношенных детей с ЗВУР развили полиорганную недостаточность с синдромами: нарушения сознания, судорожным, отечным, геморрагическим, непереносимостью энтерального питания, которых не было в группе сравнения.
При проведении нейросонографии в раннем неонатальном периоде только у недоношенных детей с ЗВУР выявлены внутрижелудочковое кровоизлияние (ВЖК) 1-2 степени - 5 (13,8%) детей, низкая дифференцировка борозд по поверхности полушарий - 11 детей (30,5%), повышенная эхогенность перивентрикулярных областей - 19 детей (52,8%). При ультразвуковом исследовании органов брюшной полости и почек выявлены диффузные изменения паренхимы почек у 6 (16,7%) недоношенных с ЗВУР (р=0,032), что также не отмечено в группе сравнения. Выявленные изменения у недоношенных детей с ЗВУР могут свидетельствовать о перенесённой гипоксии. Эхокардиография сердца у недоношенных детей показала, что наиболее часто в обеих группах отмечалось открытое овальное окно: в 1-й группе - у 5 (13,9%) детей, во 2-й - у 10 (23,2%) без достоверных различий (p=0,554).
Таблица 2. Показатели клинического анализа крови недоношенных детей с ГВ 32-36 недель в динамике (М±м)
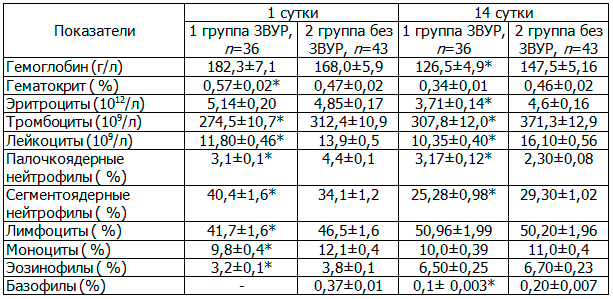
Проведенные исследования (табл. 2) выявили достоверные различия по показателям в раннем неонатальном периоде: у недоношенных детей 1-й группы отмечено повышение уровня гематокрита на 17,6%, снижения количества тромбоцитов на 12,1% и уровня лейкоцитов на 15,2% к данным 2-й группы (все р<0,05). Кроме того, выявлены статистически значимые различия в лейкоцитарной формуле, а показатели находились в пределах референтных значений.
При сравнении показателей периферической крови в динамике в возрасте 14 дней у детей 1-й группы отмечаются более низкие показатели гемоглобина (на 14,2%), эритроцитов (на 19,4%), количества лейкоцитов (на 35,8%) и тромбоцитов на 17,2% (все р<0,05) к данным 2-й группы. Данные лейкоцитарной формулы не различаются и соответствуют нормам (преобладание лимфоцитов).
Таблица 3. Характеристики биохимических показателей крови недоношенных детей в 2-х группах на 5-е сутки жизни (M±m)
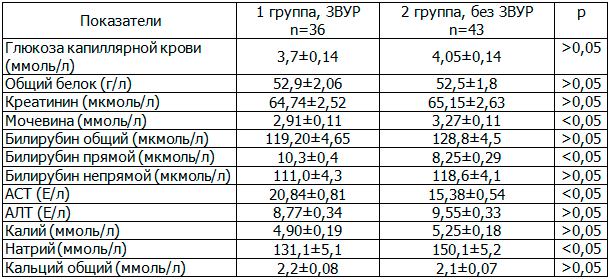
Исследование биохимических показателей в раннем неонатальном периоде (табл. 3) показало, что у детей 1-й группы имелись следующие достоверные различия (все р<0,05): снижение уровня мочевины на 11,1% и натрия на 12,7% в сыворотке крови. Уровень прямого билирубина на 20% и аспартатаминотрансфераза (АСТ) на 26,2% достоверно выше (р<0,05), чем у детей группы сравнения, что можно связать с непереносимостью энтерального питания детей, имеющих полиорганную недостаточность.
Таблица 4. Заболеваемость недоношенных детей с ГВ 32-36 недель в неонатальном периоде (n и %)
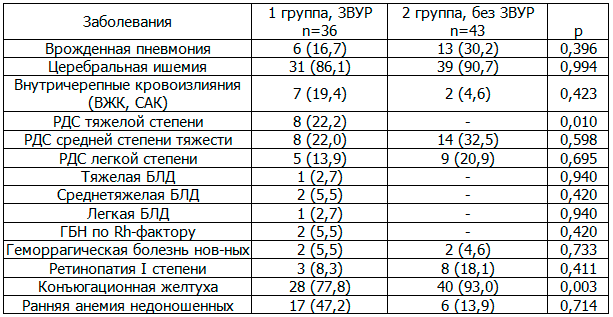
Проведенный анализ заболеваемости (табл. 4) в неонатальном периоде показал, что статистически значимо у недоношенных детей с ЗВУР выявлен РДС тяжёлой степени (р=0,010) и снижение частоты коньюгационной желтухи на 15,2% (p=0,003). У недоношенных детей обеих групп наиболее частым диагнозом была церебральная ишемия 2 степени - у 86,1% детей в 1-й и 90,7% случаев во 2-й группах соответственно. Внутричерепные кровоизлияния на 14,8% чаще выявлены в основной группе, но достоверных различий не получено; 2 ребёнка группы сравнения имели субарахноидальные кровоизлияния. Нужно отметить, что у детей основной группы в качестве основного диагноза встречалась бронхолегочная дисплазия, всего - 4 ребенка выписаны с различной тяжестью БЛД, тогда как у детей группы сравнения такого диагноза не зарегистрировано. Инфекционная патология была представлена врожденной пневмонией, которой на 13,5% больше у недоношенных детей без ЗВУР, значимых различий не получено.
В возрасте 1 месяца жизни средняя масса тела у недоношенных детей 1-й группы (1871,9±83,7 г) остается достоверно ниже (р<0,05), чем во 2-й группе (2218,1±77,6 г), как и при рождении; по остальным показателям достоверных различий получено не было.
К моменту выписки из перинатального центра (ПКВ - 39,8±1,8 недели) все дети с ЗВУР (основной группы) имели показатели массы тела менее 10-й центили (100%), в то время как у недоношенных детей без ЗВУР (группы сравнения) - 9,3% (ПКВ - 35,8±1,25 недели), (p<0,001). Все дети выписаны домой в удовлетворительном состоянии, хорошо сосали из соски, масса тела детей основной группы при выписке составила 2329,2±104,8 г, в то время как в группе сравнения - 2246,9±78,6 г. Небольшая разница в массе тела при выписке детей из перинатального центра связана с более ранней выпиской недоношенных детей без ЗВУР. В дальнейшем после выписки из перинатального центра дети наблюдались до 12 месяцев СВ.
Достоверных различий по показателям массы тела с 3-х до 12 месяцев скорригированного возраста нет. При этом видно, что недоношенные дети основной группы, родившиеся с ЗВУР, на первом году жизни имели меньшую массу во всех представленных возрастах.
Динамика изменения массы тела детей 2-х групп, родившихся с ГВ 32-36 недель, до 12 месяцев СВ представлена на рис. 1.
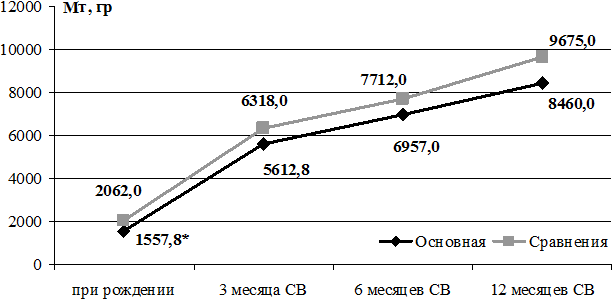
Рис. 1. Динамика изменения массы тела детей 2-х групп с ГВ 32-36 недель при рождении до 12 месяцев скорригированного возраста.
Динамика изменения длины тела детей 2-х групп, родившихся с ГВ 32-36 недель, до 12 месяцев СВ представлена на рис. 2.
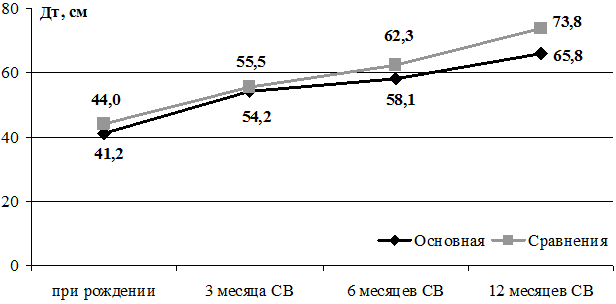
Рис. 2. Динамика изменения длины тела детей 2-х групп с ГВ 32-36 недель при рождении до 12 месяцев скорригированного возраста.
Достоверных различий по показателям длины тела с рождения до 12 месяцев СВ не получено. Обращает на себя внимание факт быстрого роста недоношенных детей основной группы к 3-м месяцам СВ, прибавка в среднем по группе составила 13 см, что соответствует концепции «догоняющего роста» у детей с ЗВУР, наиболее выраженную в этом возрасте. В дальнейшем наблюдается значительное снижение скорости роста в этой группе. Всего за время наблюдения прибавка массы тела к 12 месяцам СВ в основной группе составила 6902,2 г, а в группе сравнения - 7613,0 г; длина тела увеличилась на 24,6 см и 29,3 см соответственно, окружность головы - на 17,1 см и 18,0 см соответственно, окружность груди - на 21,6 см и 25,5 см соответственно.
Выводы
- В анамнезе матерей, родивших недоношенных детей с ЗВУР и ГВ 32-36 недель, выявлены факторы риска: фетоплацентарная недостаточность различных степеней тяжести - 83,3%, в группе сравнения - 32,5% (р=0,026); преэклампсия - 36,1%, в группе сравнения - 2,3% (р=0,003).
- Недоношенные дети с ЗВУР и ГВ 32-36 недель имели осложненное течение ранней неонатальной адаптации, обусловленное в основном респираторными нарушениями, что потребовало оказания специализированной медицинской помощи в условиях ОРИТ (69,4% детей), проведения ИВЛ различной длительности (25% детей) на фоне эндотрахеального введения препарата эндогенного сурфактанта; 19,4% детей развили полиорганную недостаточность.
- Среди заболеваний неонатального периода только у недоношенных детей с ЗВУР отмечался РДС тяжелой степени, более низкая частота конъюгационной желтухи, а 4 ребенка выписаны домой с диагнозом БЛД различной степени тяжести. Наиболее частым диагнозом у недоношенных детей 2-х групп была церебральная ишемия.
- Недоношенные дети с ЗВУР имели значимые изменения показателей красной крови в возрасте 1 суток: повышение уровня гематокрита (на 17,6%), снижения количества тромбоцитов (на 12,1%) и уровня лейкоцитов (на 15,2%); при динамическом наблюдении к 14 дню жизни - снижение гемоглобина (на 14,2 %), эритроцитов (на 19,4 %), количества лейкоцитов (на 35,8%) и тромбоцитов (на 17,2 %). В возрасте 5 дней отмечались метаболические расстройства - снижение уровня мочевины (на 11,1%) и натрия (на 12,7%), повышение прямого билирубина (на 20%) и АСТ (на 26,2%),
- Недоношенные дети с ЗВУР и ГВ 32-36 недель при выписке из перинатального центра в 100% имели постнатальную гипотрофию при более длительном стационарном лечении (ПКВ - 39,8±1,8 недели), но при наблюдении в динамике не имели достоверных различий в показателях физического развития до 12 месяцев скорригированного возраста.
