Актуальность. В настоящее время немаловажную роль исследователи отводят дислипидемии, которая является патогенетическим звеном ускорения развития атеросклероза сердечно-сосудистых осложнений у больных хроническим гломерулонефритом [8-11].
При прогрессировании хронического гломерулонефрита (ХГН) дислипидемия способствует нарушению функции эндотелия клубочков, отложению липидных комплексов в мезангии и прогрессированию гломерулярного склероза [11]. Кроме того, длительная циркуляция в крови липопротеидов низкой плотности (ЛПНП) приводит к их повышенному окислению, в результате чего, липопротеиды низкой плотности приобретают антигенные свойства и стимулируют образование липидсодержащих иммунных комплексов, повреждающих почечную ткань [2, 3].
Воспалительные реакции приводят к активации процессов перекисного окисления липидов, что нарушает структурно-функциональное состояние мембран клеток эндотелия и мезангия клубочка [5-7]. Нарушение эндотелиальной функции связано в том числе, и с активацией нитрат-редуктазы (NR), результатом которого является усиленная деградация оксида азота (NO) и снижение его концентрации. При этом накопление стабильных метаболитов оксида азота в мезангии клубочков нитритов и нитратов оказывает токсический эффект [4]. Однако клинических исследований посвященных вкладу изменений метаболизма оксида азота в патогенез нефротического синдрома у больных хроническим гломерулонефритом раннее не проводилось.
Цель исследования: оценить особенности липидного спектра крови и показателей метаболизма оксида азота у больных хроническим гломерулонефритом с нефротическим синдромом.
Материалы и методы исследования: в исследование было включено 100 больных ХГН с нефротическим синдромом (ХГН с НС). Клинически были представлены нефротической (НФГН - 59 больных – 59%) и смешанной (СФГН - 41 больной – 41%) формами.
Диагноз верифицировался на основании клинико-лабораторных и инструментальных данных. Критериями включения был нефротический синдром, обусловленный ХГН. Критериями исключения были больные, у которых нефротический синдром был обусловлен другой патологией (сахарный диабет, диффузные заболевания соединительной ткани, амилоидоз), больные с сопутствующей патологией, с органной недостаточностью, в том числе и с хронической почечной недостаточностью. В качестве группы сравнения обследованы 20 здоровых добровольцев, сопоставимых по половозрастному составу и антропометрическим данным.
В обследование входило: общий анализ крови, общий анализ мочи, моча по Нечипоренко, суточная протеинурия, биохимический анализ крови (общий белок, мочевина, креатинин, билирубин, трансаминазы, общий холестерин и его фракции, триглицериды, коэффициент атерогенности, альбумин и его фракции), контроль артериального давления, параметры метаболизма NO (NO, NO2, NO3, нитрат редуктаза), ультразвуковое исследование (УЗИ) почек.
Для определения метаболизма оксида азота в венозной крови определялись концентрация монооксида азота - полярографическим методом закрытым платиновым электродом Кларка на полярографе LP-7 (NO), его стабильных метаболитов с использованием реактива Грейса (NO2, NO3) и активность нитратредуктазы (NR) - по методу Вавилова Т.П. и Петрович Ю.А. [1]. Забор крови проводился утром натощак из кубитальной вены. Для нейтрализации влияния белка на показатели метаболизма оксида азота, белок осаждали добавлением 30% ZnSO4 (0,05мл/мл крови) с последующим центрифугированием 30 мин. при скорости 15000 об/мин).
Результаты исследования. Как показало первичное обследование, больные ХГН с НС отличались от группы здоровых лиц достоверно более высоким уровнем артериального давления (АД) (p<0,001), что объясняется включением в исследование больных со смешанной формой ХГН.
Подтверждением этого положения является анализ уровня АД в зависимости от клинической формы ХГН.
Выявлено, что систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД) у больных нефротической формой ХГН было сопоставимо с параметрами, характерными для здоровых лиц, в то время как у больных смешанной формой ХГН уровень САД и ДАД был достоверно выше, чем в контрольной группе (p<0,001) и в группе больных с нефротической формой ХГН (p<0,001) (рис. 1).
Больные ХГН достоверно отличались от здоровых лиц следующим: более высоким уровнем СОЭ (p<0,001), что отражает активный воспалительный процесс; снижением общего белка крови (p<0,001) со смещением белкового спектра в пользу крупномолекулярных глобулинов. Потеря альбумина связана с выраженной протеинурией (p<0,001), являющейся характерной патогенетической чертой нефротического синдрома и в настоящем исследовании служащей одним из критериев включения больных в исследование.
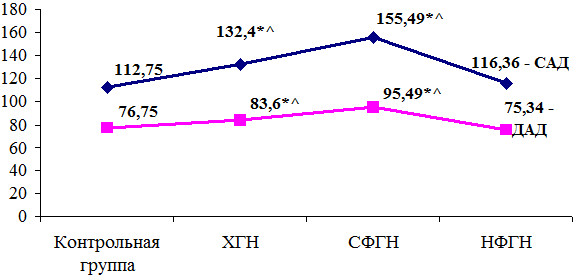
Рис. 1. Характеристика АД больных ХГН с нефротическим синдромом в зависимости от клинической формы и КГ: * - p<0,001 достоверность различия между больными СФГН и НФГН с показателями КГ; ^ - p<0,001 достоверность различия между больными СФГН и НФГН
Также для НС при ХГН характерны увеличение удельного веса мочи в доазотемической стадии (p<0,001 по сравнению с контрольной группой) в связи с протеинурией, гематурией, лейкоцитурией и цилиндрурией.
Указанные изменения отражают процессы гломерулярного поражения почек. Поскольку в исследование не включались больные с ХПН, уровень мочевины и креатинина крови в группах ХГН и контрольной были сопоставимы.
При этом у больных ХГН уровень гемоглобина крови был достоверно снижен по сравнению с контролем, что, вероятно, является отражением эритропоэтин-синтезирующей функции почек (ренальная анемия) и может служить одним из начальных признаков нарушенной почечной функции и ранним прогностическим признаком ХПН. Между собой больные с нефротической и смешанной формами ХГН по уровню СОЭ, гемоглобина, суточной протеинурии, гематурии, лейкоцитурии, протеинемии не отличались (табл. 1).
Анализ липидного спектра крови больных ХГН показал, что у них были значительно повышены как Хс крови (p<0,001), так и ТГ (p<0,001). Также у больных ХГН по сравнению с КГ оказались повышены все атерогенные фракции липопротеидов (ЛПНП, ЛПОНП, p<0,001) и снижено содержание антиатерогенных ЛПВП (p<0,001). Указанные изменения привели к достоверному увеличению коэффициента атерогенности (КА), отражающего соотношение атерогенных и антиатерогенных фракций липопротеидов крови (p<0,001).
Таблица 1. Сравнительная клинико-лабораторная характеристика больных ХГН с нефротическим синдромом в зависимости от клинической формы
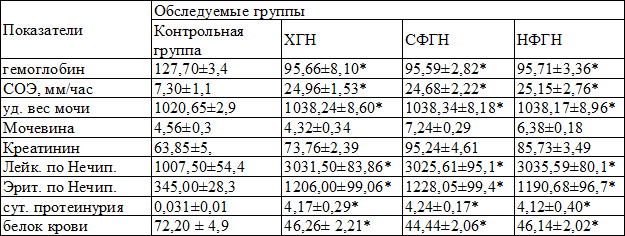
Примечание: * - p<0,001 достоверность различия между больными СФГН и НФГН и показателями контрольной группы
Распределение больных в зависимости от клинической формы заболевания не выявило различий в содержании общего холестерина (Хс), триглициридов (ТГ) и атерогенных ЛП (ЛПНП и ЛПОНП) между группами, при этом как в группе с нефротической, так и смешанной формой ХГН указанные показатели были достоверно выше, чем в контрольной группе (p<0,001 для всех показателей) (табл. 2).
Таблица 2. Характеристика липидного спектра крови у больных ХГН с нефротическим синдромом
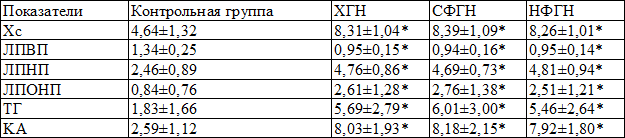
Примечание: * - p<0,001 достоверность различия больных ХГН с показателями контрольной группы
Концентрация ЛПВП также была сопоставимой у больных с обеими клиническими формами ХГН, хотя в обеих группах концентрация ЛПВП была ниже, чем в контрольной группе (p<0,001 между больными смешанной и нефротической формами ХГН и контролем).
В результате КА у больных обеими формами ХГН был достоверно выше, чем в контрольной группе (p<0,001), при недостоверном различии между клиническими формами ХГН: в группе больных смешанной формой ХГН КА был несколько выше, чем в группе больных нефротической формой ХГН.
Таким образом, исследование липидного спектра у больных ХГН выявило достоверное увеличение атерогенности липидного спектра крови, как за счет холестерин-содержащих, так и за счет триглицерид-содержащих ЛП, при несколько более выраженных нарушениях у больных, у которых нефротический синдром сочетается с гипертонической формой.
Белковый спектр крови больных ХГН отличался выраженным смещением спектра со снижением относительного содержания альбуминов (p<0,001 по сравнению с контрольной группой) и гаммаглобулинов (p<0,01) в пользу альфа-1, альфа-2 и бетаглобулинов (p<0,001 для всех трех показателей по сравнению с контролем) (табл.3).
Таблица 3. Характеристика белкового спектра крови у больных ХГН с нефротическим синдромом
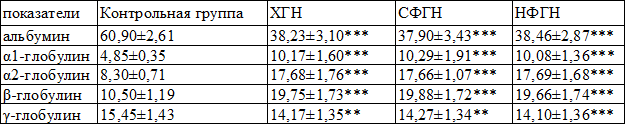
Примечание: ** - p<0,01, *** - p<0,001 достоверность различия между больными СФГН и НФГН с показателями контрольной группы
Распределение больных по клиническим формам ХГН не выявило достоверного отличия в соотношении белковых фракций в зависимости от наличия гипертонической формы при достоверной разнице показателей в обеих группах больных и КГ (p<0,001 для всех белковых фракций и обеих клинических форм).
Исследование метаболизма NO выявило, что у больных ХГН активность NR значительно выше, чем у представителей контрольной группы (p<0,001), при этом у больных смешанной формой ХГН активность NR достоверно превышала показатель, обнаруженный в группе больных нефротической формой ХГН (p<0,001). Увеличенная активность NR привела к увеличению скорости деградиции монооксида азота, что было подтверждено снижением концентрации свободного монооксида азота в плазме крови больных ХГН (p<0,001) и увеличением концентрации стабильных продуктов его метаболизма (NO2 и NO3, p<0,001) (табл. 4).
Закономерное более выраженное увеличение стабильных метаболитов NO на фоне снижения свободной исходной фракции отмечалось в группе больных со смешанной формой по сравнению с нефотической формой ХГН (p<0,001 для всех трех показателей).
Таблица 4. Характеристика показателей метаболизма NO у больных ХГН с нефротическим синдромом
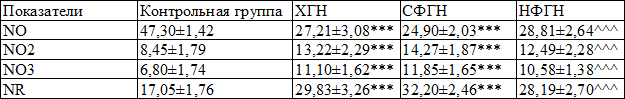
Примечание: *** - p<0,001 достоверность различия больных СФГН и НФГН с показателями КГ; ^^^ - p<0,001 достоверность различия между больными СФГН и НФГН
Таким образом, первичное обследование больных ХГН выявило значительное нарушение функции почек в обеих исследуемых группах больных. Липидный спектр у больных ХГН был значительно смещен в пользу атерогенных фракций и снижения ЛПВП, что привело к увеличению КА, несколько более выражено в группе больных смешанной формой ХГН. Белковый спектр крови продемонстрировал гипопротеинемию и смещение в пользу альфа и бетаглобулинов со значительным снижением концентрации альбумина крови, что и определяет клиническую картину НС.
Активность NR была значительно увеличена у больных ХГН с максимальным значением в группе больных со смешанной формой, что привело к снижению концентрации свободного NO и увеличению токсичных стабильных метаболитов – нитратов и нитритов, также максимально у больных со смешанной формой ХГН.
Выводы
1. У больных хроническим гломерулонефритом развивается дисбаланс в метаболизме NO за счёт активации нитрат редуктазы с одновременным снижением концентрации NO и увеличением его стабильных метаболитов NO2 и NO3 в переферической крови с более выраженными сдвигами при смешанной форме хронического гломерулонефрита.
2. Для нефротического синдрома при хроническом гломерулонефрите характерно нарушение липидного спектра крови в пользу неблагоприятных в прогностическом плане атерогенных фракций.
