Введение. При тяжелой закрытой черепно-мозговой травме (ЧМТ) отек-набухание головного мозга представляет особый клинический интерес. Так, эти явления связаны с нарушением целостности гематоэнцефалического барьера [1]. Основным внутричерепным фактором вторичных поражений являются также нарушения цереброваскулярной гемодинамики и возникновение реперфузии мозговой ткани. Непосредственно с сосудистым фактором при формировании тяжелой закрытой ЧМТ связан такой патогенетический механизм как нарушение ликвородинамики. Известно, что цереброспинальная жидкость из подоболочечных щелей оттекает в лимфатическую систему [2]. Но в головном мозге нет лимфатических сосудов, а необходимость в дренажной системе для мозга существует. Согласно работам [3], морфофункциональной составляющей гематоэнцефалического барьера является лимфодренажный аппарат центральной нервной системы (ЦНС). В развитии современной лимфологии признана инновационная концепция «лимфатического региона» [2, 3], к которому относят лимфатические сосуды и узлы; несосудистые пути микроциркуляции, названные прелимфатиками: перицеллюлярные, периаксиальные, периваскулярные, периневральные пространства и тканевые щели твердой оболочки мозга. Считают, что лимфатические узлы: глубокие и поверхностные шейные – регионарные для головного мозга [5]. На этом основании предложен принципиально новый метод регионарной экстракраниальной непрямой стимуляции (РЭНС) лимфодренажного механизма ЦНС [5]. Этот метод уменьшает отек головного и спинного мозга и исчезают кровоизлияния в веществе мозга [6, 7], тем не менее, его эффективность в терапии ЧМТ остается до конца не вполне изученной. Это определяет в нейрохирургии актуальность исследований тяжелой закрытой ЧМТ с привлечением новых теоретико-методологических подходов из других областей медицины.
Цель исследования – экспериментально изучить динамику морфофункциональных изменений структур головного мозга при тяжелой закрытой ЧМТ в условиях дегидратационной терапии и РЭНС лимфодренажного механизма ЦНС.
Материал и методы исследования. В моделировании тяжелой закрытой ЧМТ использована модель «жидкостно-перкуссионная травмы мозга» (fluid-рercussion brain injury) [8] на 148 кроликах породы «шиншилла» 5-месячного возраста, среднего веса в 2,5-3,0 кг, распределенных в 4 группы. Эксперименты проведены в соответствии с: «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. № 755) и «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18.03. 1986 года. В группах № 2-4 проведено базисное лечение тяжелой закрытой ЧМТ: внутривенное капельное введение витаминов группы В и антибиотиков I и II группы цефозолинового ряда, гемостатиков. В группе № 3 (сравнения) ежедневно проведена наряду с базисным лечением дегидратация (салуретиком: фуросемидом – 1 г/кг и и осмодиуретиком: маннитолом из расчета 0,1 мг на килограмм живого веса). А в группе (основной) № 4 на фоне базисного лечения и дегидратации ежедневно проведена РЭНС лимфодренажного механизма ЦНС: лекарственная смесь: 4,0 мл 0,25% или 0,5% раствора новокаина, 4 мг раствора гидрокортизона и 64 единиц лидазы вводится в нейро-лимфатические точки параокципитальной зоны [5]. Первое введение лекарственных препаратов осуществлено через 2 часа после моделирования тяжелой закрытой ЧМТ, а через 4 часа оценено их действие. Повторное введение лекарственных препаратов осуществлено через 12 часов от начала моделирования тяжелой закрытой ЧМТ (или через 10 часов после первого введения). Из эксперимента животные выведены путем передозировки 2,0 мл 1% тиопентала натрия через 4, 8, 12, 16, 20, 24, 36, 48 и 72 часа. Интактная – группа № 1. Проведены общегистологический анализ и морфометрия тканевых структур на светооптических микроскопах в соответствии с общепринятыми требованиями [9]. Серийные срезы сделаны у 5 животных. На каждом срезе количество измеренных щелей твердой мозговой оболочки равно 50. Сравнительно-сопоставительный анализ динамики структурных изменений головного мозга подопытных животных во времени при моделированной тяжелой закрытой ЧМТ в условиях дегидратационной терапии и РЭНС лимфодренажного механизма ЦНС представлена на рисунках 1-10. Статистический анализ осуществлен на персональном компьютере Pentium IV с использованием электронных таблиц Excel 2010 и статистического пакета SPSS for Windows 10.0.5.
Результаты и обсуждение. В группах № 2 и 3 через 12 часов после моделирования тяжелой закрытой ЧМТ морфологическая картина головного мозга характеризуется наличием обширных подоболочечных кровоизлияний (рис. 1). В то время как в основной группе № 4 (рис. 2) эритроциты в виде тонкого слоя плотно прилегают к внутренней поверхности твердой мозговой оболочки. Через 24 часа наблюдения структурные изменения головного мозга остаются в группе № 2 на уровне предыдущего времени эксперимента и были обнаружены внутримозговые очаги кровоизлияний, кроме того наблюдаются кровоизлияние в перифокальной зоне (рис. 3). В группе № 3 отмечены очаги кровоизлияний перифокальной зоне, однако, уже более мелкие по сравнению обнаруженными в группе № 2 (рис. 4).
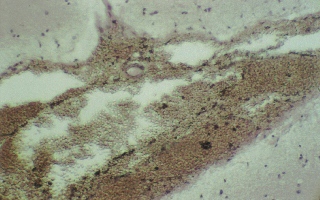
Рис. 1 (микрофото). Структура подоболочечного пространства через 12 часов моделирования тяжелой закрытой ЧМТ в группе № 3. Окраска – гематоксилин и эозин. Увеличение х230
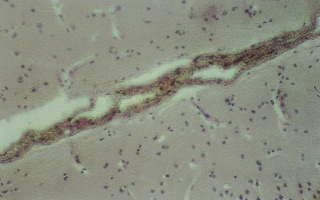
Рис. 2 (микрофото). Структура подоболочечного пространства через 12 часов моделироваия тяжелой закрытой ЧМТ в группе № 4. Окраска – гематоксилин и эозин. Увеличение х230
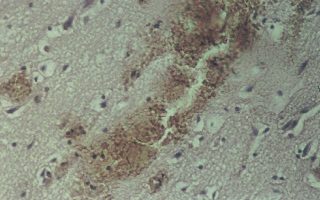
Рис. 3 (микрофото). Внутримозговые очаги кровоизлияний через 24 часа моделирования тяжелой закрытой ЧМТ в группе № 2. Окраска – гематоксилин и эозин. Увеличение х230
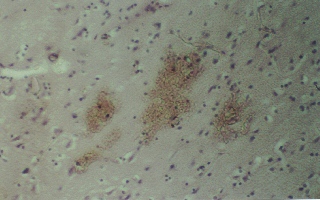
Рис. 4 (микрофото). Внутримозговые очаги кровоизлияний через 24 часа моделирования тяжелой закрытой ЧМТ в группе № 3. Окраска – гематоксилин и эозин. Увеличение х230
Морфологическая картина в группе № 4, в которой проведена РЭНС лимфодренажного механизма ЦНС, к этому времени значительно отличается от предыдущих: подоболочечные пространства свободны от форменных элементов крови (рис. 5), а единичные перифокальные кровоизлияния находятся в стадии инволюции (рис. 6). Через 48 часов в группе № 2 морфологическая картина головного мозга мало чем отличается от предыдущих наблюдений. По истечении 72 часов возникает некоторая тенденция к восстановлению структуры, однако при этом в зоне некротических изменений перифокально наблюдаются артерии и вены с наличием тромбов в просветах (рис. 7). Замечен паравазальный отек, тромбы в просветах кровеносных сосудов. В группе № 3 через 48 часов подоболочечные кровоизлияния не обнаружены. Однако в веществе мозговой ткани появляется большое количество участков паравазального и перицеллюлярного отека. Следует отметить, что при этом сформовавшийся перицеллюлярный отек обнаружен и по истечении 3 суток наблюдения (рис. 8).
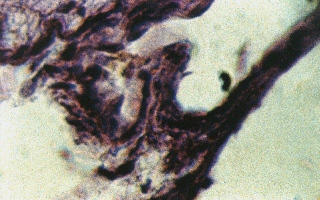
Рис. 5 (микрофото). Структура подоболочечного пространства через 24 часа моделирования тяжелой закрытой ЧМТ в группе № 4. Окраска – гематоксилин и эозин. Увеличение х230
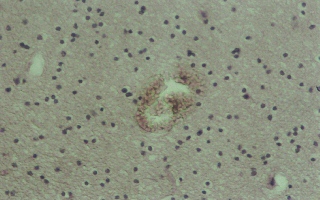
Рис. 6 (микрофото). Внутримозговой очаг кровоизлияния через 24 часа моделирования тяжелой закрытой ЧМТ в группе № 4. Окраска – гематоксилин и эозин. Увеличение х230
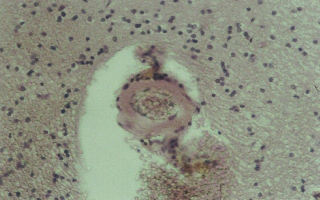
Рис. 7 (микрофото). Паравазальный отек, тромбы в просветах кровеносных сосудов через 72 часа моделирования тяжелой закрытой ЧМТ в группе № 2. Окраска – гематоксилин и эозин. Увеличение х230
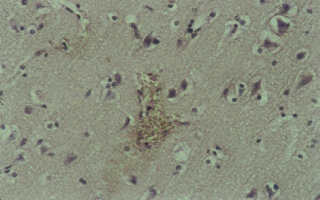
Рис. 8 (микрофото). Перицеллюлярный отек в веществе мозговой ткани через 72 часа моделирования тяжелой закрытой ЧМТ в группе № 3. Окраска – гематоксилин и эозин. Увеличение х230
В группе № 4 (основной) через 48 часов структурная организация оболочек головного мозга близка к норме, за исключением наличия эритростаза в единичных артериях твердой мозговой оболочки (рис. 9). При этом в перифокальной зоне наблюдается выраженная тенденция к нормализации структуры мозговой ткани (рис. 10). Как видно из рисунка 10, паравазальный отек не выражен, наблюдается явный регресс зоны некроза и очага бывшего кровоизлияния. Отмеченная выше динамика разных структурных изменений головного мозга при моделированной тяжелой закрытой ЧМТ и в условиях РЭНС лимфодренажного механизма ЦНС подтверждена и далее при морфометрии лимфатических щелей твердой мозговой оболочки, перицеллюлярных пространств клеток коры головного мозга, а также периваскулярных пространств. Полученные результаты позволяют сделать заключение о том, что под воздействием дегидратации при тяжелой закрытой черепно-мозговой травме через 48 часа от начала эксперимента происходит расширение площади паравазальных пространств и лимфатичепослеских щелей твердой мозговой оболочки, что не приводит к нормализации площади перицеллюлярных пространств, а к 72-ми часам дальнейшее сужение их площади способствует задержке жидкости в коре головного мозга. Тогда как метод РЭНС лимфодренажного механизма ЦНС приводит к увеличению площади периваскулярного пространства и лимфатических щелей твердой мозговой оболочки через 48 часов способствует восстановлению экстра- и интракраниального лимфатического дренажа головного мозга.
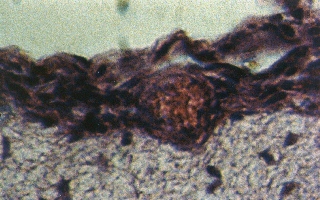
Рис. 9 (микрофото). Структура подоболочечного пространства через 48 часа моделирования тяжелой закрытой ЧМТ в группе № 4. Окраска – гематоксилин и эозин. Увеличение х230
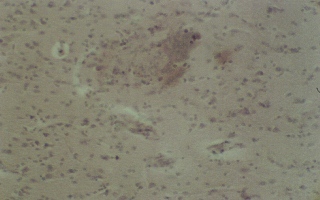
Рис. 10 (микрофото). Структура подоболочечного пространства через 48 часа моделирования тяжелой закрытой ЧМТ в группе № 4. Окраска – гематоксилин и эозин. Увеличение х230
Вывод. Таким образом, проведенные исследования, полученные экспериментальные факты и информация констатируют о высокой эффективности РЭНС лимфодренажного механизма ЦНС при моделированной тяжелой закрытой ЧМТ. Поэтому метод рекомендован к широкому использованию в нейрохирургических клиниках.
