Введение. На сегодняшний день тромболитическая терапия представляет собой одно из немногих лечебных мероприятий эффективность которого при остром нарушении мозгового кровообращения по ишемическому типу (ОНМК) с позиций доказательной медицины является неоспоримым [7]. При фармакологическом восстановлении проходимости инфаркт-зависимого церебрального сосуда важно достижение его полной реканализации. Это обусловлено тем, что сохранение остаточных явлений стенозирования, может полностью нивелировать преимущества этого метода, цель которого, прежде всего, направлена на уменьшение размеров некроза и сохранения жизнеспособности клеток. По данным литературы [9], реперфузия при ОНМК наиболее эффективна в первые минуты развития сосудистой катастрофы и в течение последующих 3 часов. В дальнейшем при ее применении значительно возрастает риск не только реперфузионного повреждения, но и геморрагических осложнений. Учитывая сложность диагностики и проведения реканализации, становится очевидным, что успешный тромболизис возможен в немногих случаях и только в крупных специализированных клиниках [12]. Однако даже ранняя реканализация поврежденного сосуда далеко не всегда оправдывает ожидания врачей, поскольку часто после восстановления его проходимости возможно возникновение постреперфузионных повреждений нейронов [8]. Это приводит к тому, что нормализация нарушенных функций головного мозга происходит только спустя несколько часов или даже суток после реперфузии, а в отдельных случаях поздний тромболизис сопровождается еще большим поражением нервной ткани [11].
В связи с этим, по мнению специалистов [10,5] схему лечения таких больных целесообразно дополнять препаратами с нейроцитопротекторными свойствами, что позволяет продлить период "терапевтического окна" и создает защиту от реперфузионного повреждения. На сегодняшний день сформированы ключевые принципы и патогенетически обоснована целесообразность включения препаратов этой группы в состав интенсивной терапии инсульта [6]. Неудачи, которые связаны с разработкой и внедрением церебропротекторов в состав базисной терапии острой церебральной недостаточности можно объяснить целым комплексом причин. Одной из основных является несоответствие картины модельного ОНМК у некоторых животных, которые традиционно используют для этой цели с клиническим течением инсульта у человека. Именно поэтому, стратегия тестирования перспективных нейропротекторов с целью «прикрытия» тромболитической терапии и нивелирования последствий поздней реканализации требует усовершенствования и некоторых изменений. Во-первых, необходимо создать экспериментальную модель церебральной ишемии-реперфузии, которая бы максимально отражала те изменения, которые имеют место при формировании постреперфузийного синдрома. Во-вторых, выяснить, как в этих условиях происходит реализация различных типов клеточной смерти (нейроапоптоз и нейронекроз). Ответ на последний вопрос позволит проводить целенаправленный отбор новых соединений для глубокого изучения возможных механизмов их церебропротекторного действия. Особое стратегическое значение это приобретает в случае, если такие вещества способны влиять на первые этапы «ишемического каскада», что дает возможность предположить наличие у них модулирующего действия на реализацию различных типов нейрональной смерти в постреперфузионный период инсульта. Внедрение в широкую экспериментальную практику новых моделей острой церебральной ишемии, позволило бы более детально оценить эффективность потенциальных нейропротекторов. Что в будущем, безусловно, сможет повысить эффективность и безопасность тромболитической терапии.
Цель работы. Охарактеризовать особенности нейрональной смерти на модели церебральной ишемии-реперфузии и дать оценку ее возможного использования для доклинического исследования потенциальных нейропротекторов.
Материалы и методы. Для изучения особенностей реализации различных типов нейрональной смерти в постереперфузионный период ОНМК нами в качестве лабораторных животных были выбраны монгольские песчанки (гербелы). Эти грызуны считаются наиболее репрезентативными лабораторными животными для моделирования острой ишемии головного мозга, поскольку (в отличие от крыс) имеют разобщенный вилизиевый круг кровообращения. Это позволяет воссоздать церебральную ишемию наиболее приближенную к клиническим условиям, что, безусловно способствует объективной оценке особенностей патогенеза и нейропротекторной активности новых биологически активных веществ [2]. В качестве модели ОНМК была выбрана модель односторонней каротидной окклюзии, которую выполняли под пропофоловым наркозом (60 мг/ кг внутрибрюшинно). Поскольку тромболитическую терапию желательно проводить в пределах «золотого часа» ОНМК, у части животных через 60 мин после перевязки сонной артерии проводили реперфузию (снимали лигатуру). Исследование было проведено на 52 половозрелых гербелах массой 42-53 г, разбитых на 3 группы. Первая группа – животные, которым выполняли необратимую каротидную окклюзию. Вторая – гербелы, которым через 60 мин после моделирования патологии проводили реканализацию каротидной артерии. Для нивелирования влияния пропофола и хирургического вмешательства вместо интактных животных использовали ложно-оперированных гербел, которым выполняли все процедуры, кроме перевязки сонных артерий (третья группа).
Об активации процессов нейронекроза при необратимой ишемии и в постреперфузионном периоде инсульта судили по повышению активности маркера нейрональной деструкции - нейрон-специфической энолазы (NSЕ). Энолаза является одним из ключевых ферментов аэробного гликолиза. Её изофермент - gg-энолаза или NSЕ - содержится преимущественно в нейронах и нейроэндокринных клетках. При неврологических заболеваниях, в том числе и при ОНМК, отмечается выход нейрон-специфических ферментов и их изоферментов из поврежденных нейронов, что позволяет исследовать глубину и интенсивность структурно-функциональных нарушений биомембран в центральной нервной системе (ЦНС) на самых ранних этапах. Уровень NSE в сыворотке крови пациентов с ОНМК коррелирует с объемом инфаркта головного мозга [4]. Для определения уровня активности NSE на 4 сутки ОНМК, путем прямой визуальной пункции сагитального синуса, проводили забор крови (V=0,2-0,4 мл). Активность NSE измеряли методом твердофазного иммуноферментного анализа с использованием набора NSE EIA KIT (DAI, США) на приборе фирмы "Hipson" (Чехия). Известно, что процесс нейроапоптоза начинается с разрушения ядра клетки и повреждения дезоксирибонуклеиновой кислоты (ДНК), поэтому наличие фрагментированной ДНК является маркером апоптоза [14]. Уровень фрагментации ДНК в ядрах нейронов лобных долей коры головного мозга гербел на 4 сутки после ишемии-реперфузии исследовали методом проточной цитометрии [13]. Для получения суспензии ядер к ткани добавляли СуStain DNA фирмы Partec (Германия) согласно инструкции производителя. Использовали одноразовые фильтры CellTrics 50 мкм (Partec, Германия). Ядерные суспензии биоптатов коры лобных долей головного мозга гербел готовили сразу после забора материала и промывки холодным (+4-+8 оС) фосфатносолевым буфером рН 7,4 (Sigma). Исследования проводили на проточном цитометре «Partec РАS» фирмы Partec, Германия. Для возбуждения флуоресценции метки ядерной ДНК - диамидинофенилиндола - использовали ультрафиолетовую лампу. Из каждого образца ядерной суспензии проводился анализ 10 тыс. событий. Проточный анализ фрагментации ДНК выполнялся с помощью программного обеспечения FloMax (фирма Partec, Германия) путем выделения Sub-G1 участков на ДНК-гистограммах. Статистическую значимость различий оценивали за критерием Фишера (летальность) и по t-критерию Стьюдента.
Результаты. Полученные результаты, характеризующие особенности течения различных вариантов ОНМК (без и с последующей реперфузией) приведены в таблице. Примеры типичных ДНК-гистограмм клеток коры головного мозга гербел представлено на рис.1, 2.
Таблица 1. Соотношение показателя летальности животных с течением нейродеструктивных и нейроапоптотических процессов в головном мозге гербел с различными моделями инсульта на 4 сутки эксперимента
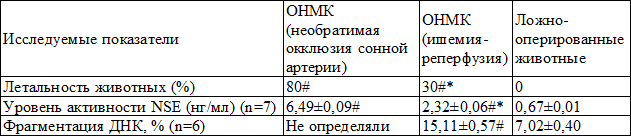
Примечания: 1. NSE – нейрон-специфическая энолаза; ОНМК - острое нарушение мозгового кровообращения; 2. статистически значимые различия (р <0,05): # - с показателем у ложно-оперированных животных, * - с показателем у гербел с необратимой окклюзией сонной артерии.
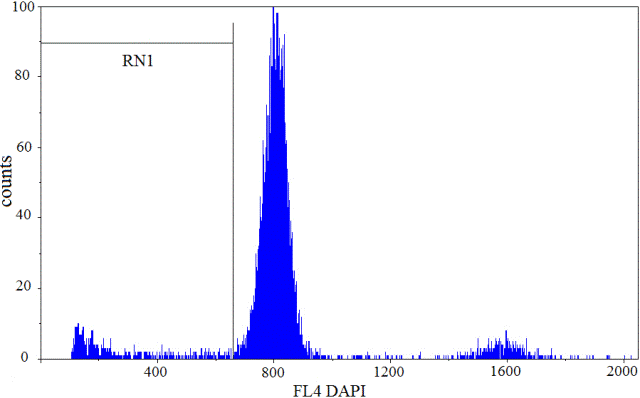
Рис. 1. Фрагментация ДНК в ядрах клеток коры головного мозга ложно-оперованной гербелы. Количество событий 10000
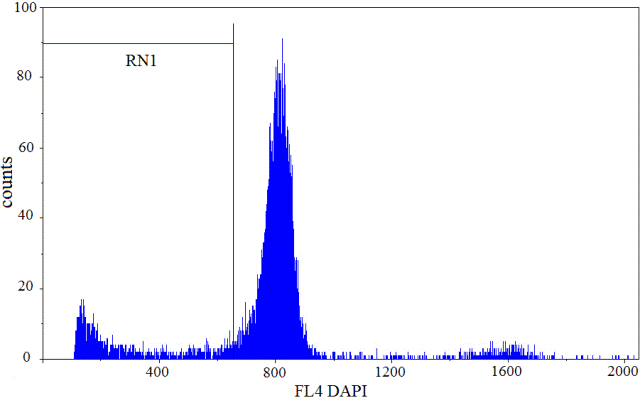
Рис. 2. Фрагментация ДНК в ядрах клеток коры головного мозга гербелы с ишемией-реперфузией. Количество событий 10000
Из данных, представленных в табл. 1, видно, что обе модели ОНМК (без и с последующей реперфузией) сопровождаются достоверным повышением активности NSE относительно ложно-оперированных животных в среднем соответственно в 9,7 и 3,5 раза. Однако, в случае модельной церебральной ишемии без реканализации сонной артерии активность исследуемого маркера была выше чем у гербел с ОНМК, которым проводили реперфузию в среднем в 2,8 раза (р <0,05). Анализ уровня фрагментации ДНК в ядрах нейронов лобных долей коры головного мозга гербел через 96 ч после моделирования церебральной 60-минутной ишемии-реперфузии показал, что он достоверно повысился в 2,15 раза. Интегративным показателем, который указывает на глубину ишемического поражения нервной ткани в условиях ОНМК, является летальность животных. Проведенное исследование показало, что необратимая односторонняя каротидная окклюзия сопровождается 80% летальностью гербел течение первых 4 суток наблюдения. Реканализация инфаркт-зависимого сосуда через 1 ч после его окклюзии уменьшает этот показатель на 50% (р<0,05).
Обсуждение результатов. Полученные результаты свидетельствуют о том, что необратимая односторонняя окклюзия общей сонной артерии у гербел приводит к активации в головном мозге деструктивно-дегенеративных процессов (нейронекроза). В пользу такого утверждения указывает почти десятикратное повышение титра маркера нейрональной деструкции, что свидетельствует о нарушении мембранной целостности нейронов. Последнее явление характеризует именно некротические изменения в нервной ткани. Такая динамика исследуемого фермента в острый период церебральной ишемии вполне соответствует клинической картине течения тяжелого инсульта у больных, которым не проводили реперфузионную терапию [4]. Полученные данные можно объяснить отсутствием кровоснабжения в ишемическом очаге, и, как следствие, блокадой синтеза аденозитрифосфорной кислоты (АТФ). Эти изменения обусловливают преимущественно некротический тип гибели нейронов, который в отличие от апоптотического пути является энергонезависимым процессом и для его инициации не нужна АТФ. Экспериментальная реперфузия также сопровождается достоверным увеличением активности NSE, однако ее титр был в 2,8 раза ниже, чем в первом случае. Эти изменения указывают на гораздо меньшую интенсификацию некротических процессов на фоне обратимой окклюзии каротидной артерии у гербел.
Реперфузия инфаркт-зависимого сосуда приводит к полному или частичному восстановлению кровоснабжения, что позволяет поддерживать синтез АТФ на минимальном уровне, достаточном для реализации процессов апоптоза. Как свидетельствуют литературные данные [6], такие условия, наряду с развитием оксидативного стресса, являются основой для формирования митохондриальной поры, через которую в цитоплазму с митохондрий выходит целый ряд апоптогенных факторов, в частности цитохром с. При условии одновременного, синхронного снижения количества антиапоптотических факторов, например таких, как антиапоптотический белок bcl-2, происходит инициация запрограммированных механизмов клеточной смерти (нейроапоптоз). Это нашло свое подтверждение при анализе уровня фрагментации ДНК в ядрах клеток коры головного мозга гербел с ОНМК после реканализации предварительно перевязанной сонной артерии. Исследуемый показатель на 4 сутки эксперимента вырос более чем вдвое (табл. 1). Такие изменения, по нашему мнению, указывают на процесс интенсивного формирования очага ишемической полутени (пенумбры) именно за счет нейронов, находящихся в состоянии апоптотической смерти. В группе животных с необратимой окклюзией сонной артерии исследования интенсивности нейроапоптоза не проводили, во-первых, за счет высокой летальности (80%), а во-вторых, из-за незначительного (по литературным данным) уровня фрагментации ДНК на стороне поражения [1].
Вместе с этим, реперфузия головного мозга сопровождалась существенным (двукратным) уменьшением летальности гербел. Это явление можно объяснить тем, что в условиях невосстановленного кровообращения происходит интенсивное образование очага ишемии, в основе которого лежат именно некротические процессы. При этом зона пенумбры, для формирования которой необходим минимальный кровоток, почти отсутствует, а если и формируется, то очень быстро трансформируется в ядро ишемии (апоптотический тип нейрональной смерти меняется на некротический). Последний представляет собой лавинообразный, хаотичный процесс деструкции клеток, который сопровождается развитием воспаления. Разрушение десмосом между отдельными нейронами позволяет свободным радикалам и вторичным мессенджерам свободно распространяться и поражать неповрежденные клетки, способствуя увеличению очага поражения и росту летальности. Именно поэтому апоптотическая гибель нейронов считается «меньшим злом» для головного мозга, несмотря на то, что общее количество клеток уменьшается [17]. Таким образом, результаты проведенного исследования свидетельствуют, что ранняя реперфузия инфаркт-зависимого сосуда наравне с одновременным ослаблением некротических процессов в тканях головного мозга приводит к активации нейроапоптоза, что сопровождается уменьшением летальности животных. Несмотря на это, многие исследователи придерживаются мнения, что патологически индуцированный апоптоз является основой для вторичного повреждения нейронов. Именно этим можно объяснить отрицательные результаты и осложнения, которые сопровождают поздний тромболизис. Следовательно, перспективным можно считать разработку нейропротекторов, которые позволяют одновременно тормозить как запрограммированные, так и незапрограммированные пути клеточной смерти, а также способствуют расширению границ терапевтического окна и профилактируют постреперфузионные осложнения [6].
Вывод. Анализируя особенности реализации различных механизмов нейрональной смерти, предложенную модель ишемии-реперфузии у гербел целесообразно использовать для изучения апоптозмодулирующих свойств у перспективных соединений с нейропротекторной активностью, а также для исследования эффективности различных церебропротекторов при проведении реканализации в условиях ОНМК.
