Цереброваскулярные заболевания остаются одной из острейших медико-социальных проблем, причиняющих огромный экономический ущерб обществу [10]. Особое место среди них занимает церебральный инсульт в связи с высокой летальностью, значительной инвалидизацией и социальной дезадаптацией пациентов [1, 2, 8]. При ишемическом поражении мозга в области очага инфаркта развивается воспалительная реакция, являющаяся результатом высвобождения в межклеточное пространство про- и противовоспалительных цитокинов, которые стимулируют высвобождение множества других вторичных медиаторов, утяжеляющих течение заболевания [3].Несмотря на значительные успехи в изучении патогенеза поражения мозга при ишемическом инсульте, данные о взаимосвязи проатерогенных медиаторов воспаления с факторами риска и степенью тяжести острого ишемического инсульта немногочисленны и противоречивы.
Целью исследования было определить факторы риска (ФР) развития атеросклероза, уровень цитокинов, липидный состав крови у пациентов с острым ИИ, проанализировать возможность корреляции этих параметров друг с другом и с выраженностью сосудистой патологии.
Материалы и методы. Проведено обследование 152 больных, в том числе 87 мужчины и 65 женщин в возрасте от 52 до 80 лет с диагнозом острого нарушения мозгового кровообращения (ОНМК) по ишемическому типу в каротидном и вертебро-базилярном бассейнах. В момент поступления состояние 77 больных было средней степени тяжести, у 75 – тяжелым. С первых суток больные получали комплексную максимально унифицированную адекватную тяжести заболевания терапию. Пациенты были разделены на группы: 1 группа – больные в возрасте до 60 лет, 2 группа – больные в возрасте старше 60 лет. Контрольную группу составили здоровые добровольцы, набранные методом случайной выборки.
В работах ряда исследователей определен спектр наиболее значимых маркеров, участвующих в запуске и реализации механизмов развития атеросклероза. К ним относят маркеры дислипопротеинемии, внутрисосудистого воспаления и эндотелиальной дисфункции [11,12]. Согласно этому в данной работе оценивали воспалительно-метаболический статус по содержанию липидов и цитокинов в периферической крови. Изучение липидного профиля и иммунологическое обследование проводилось до начала восстановительного лечения и на 20–21 день стандартной комплексной терапии. Уровень в периферической крови (IL-1, -6, -8, -10), фактора некроза опухоли-α (TNFα) определяли твердофазным иммуноферментным методом на автоматическом иммуноферментном анализаторе AXSYM (США), используя тест-системы и реагенты фирмы «Sigma», (США). У всех пациентов устанавливали содержание в крови общего холестерина (ОХС), триглицеридов (ТГ), ХС липопротеидов низкой плотности (ХС ЛПНП) и ХС липопротеиды высокой плотности (ХС ЛПВП) общепринятыми методами для обнаружения дислипидемии и типа нарушения липидного обмена. Оценивали состояние липидов крови согласно Российским рекомендациям VI пересмотра (2012): норма – ОХС≤ 4,0 ммоль/л; ХС ЛПНП≤1,8 ммоль/л; ХС ЛПВП>1,0 ммоль/л (у мужчин) и >1,2 ммоль/л (у женщин); ТГ<1,77 ммоль/л. Уровень ХС ЛПНП рассчитывается по формуле Фридвальда: ХС ЛПНП=ОХС - (ХС ЛПВП+ТГ/2,2). Все исследования поводилось на оборудовании, прошедшем метрологическую проверку и экспертизу. От пациентов получено согласие на участие в исследовании.
Статистическую обработку результатов исследования проводили с помощью пакета прикладных программ Statistica 8.0. Определяли среднюю арифметическую (М), ошибку (m), медиану (Me), использовали U-критерий Манна–Уитни, коэффициент ранговой корреляции Спирмена и угловой критерий Фишера. Учитывали минимальные (min) и максимальные (max) величины показателей. Для сравнения групп применяли критерий Стьюдента (t), для изучения зависимости между параметрами использовали корреляционный анализ Пирсона. Результаты и их обсуждение.
Полученные результаты и статистическая их обработка показали, что факторами риска у лиц в возрасте до 60 лет являются артериальная гипертензия, дислипидемия, курение у лиц мужского пола. У пациентов старше 60 лет не выявлены гендерные различия, основными триггерами у них являются артериальная гипертензия, дислипидемия, ожирение по абдоминальному типу (рис.1).
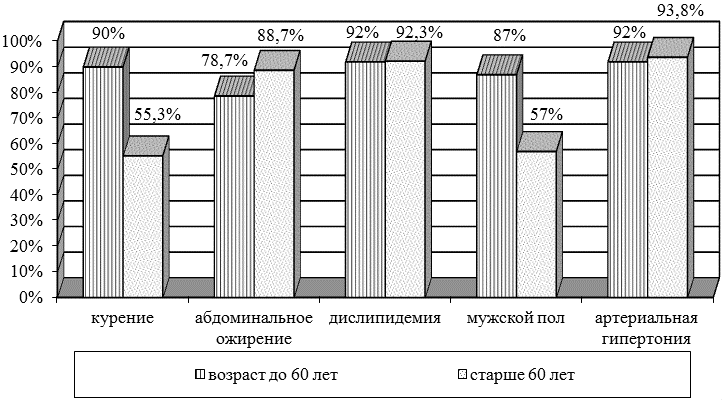
Рис. 1. Распространенность факторов риска развития атеросклероза у пациентов с ИИ.
Изучение липидного спектра показало, что у всех обследуемых были повышены уровни основных липидных фракций (табл. 1) в 1,4-2,8 раза. Уровень ОХС составил в среднем 6,74±0,37 ммоль/л (p<0,001), содержание ТГ – 1,78±0,04 ммоль/л, уровень ХС ЛПНП был повышен у 78% больных этой группы, что было в 2,8 раза выше, чем в группе сравнения (p<0,001). У лиц с ожирением этот показатель был выше на 78%. Используя тест Манна–Уитни определили значимое повышение средней концентрации ХС ЛПНП у пациентов 1 группы: от 3,72±0,92 до 4,65±0,54 ммоль/л (z=-2,405; p=0,011). Уровень ХС ЛПВП составил у всех больных при поступлении в среднем 0,97±0,06 ммоль/л. При этом у больных 2 группы отмечались более низкие значения этого показателя до - 0,91±0,02 ммоль/л. Концентрации ХС ЛПВП были сопоставимы с контрольными и отличались индивидуальными колебаниями: 1-я группа – от 0,9 до 1,3; 2 -я группа – от 0,56 до 0,95. Уровень глюкозы крови не превышал нормальных значений (ρ>0,05).
Следует отметить, что нарушения в липидном обмене не в полной мере отражают измененные метаболические процессы при острой ишемии мозга.
Таблица 1. Биохимический статус пациентов с острым нарушением мозгового кровообращения (M±m)
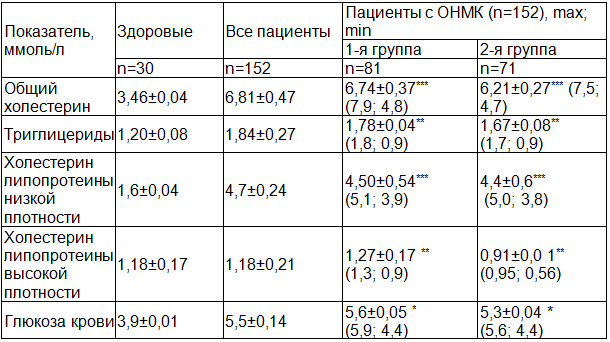
Примечание:* достоверные различия по сравнению с группой здоровых лиц.
Таблица 2. Уровень цитокинов в периферической крови пациентов с ОНМК
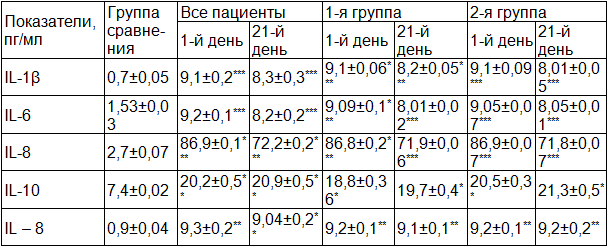
Примечание: *достоверные различия по сравнению с группой здоровых лиц, * - ρ<0,05, **ρ<0,01, ***ρ<0,001.
Таблица 3. Содержание цитокинов в периферической крови больных в зависимости от возраста и тяжести течения заболевания
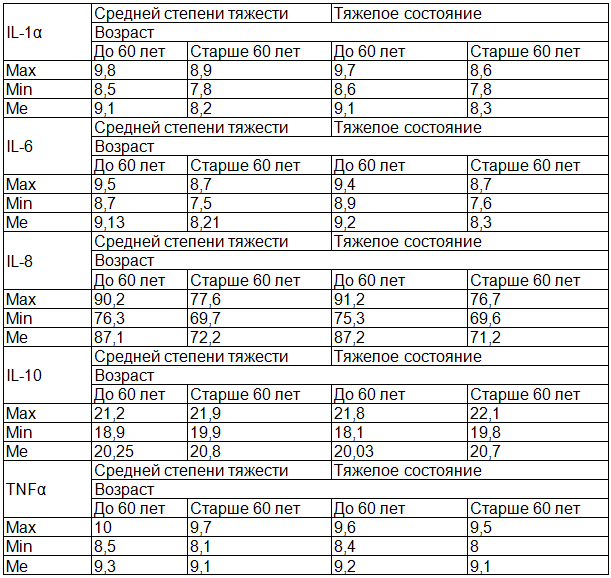
У больных ОНМК средний уровень IL-1β был повышен в 13 раз независимо от возрастных групп и полу по сравнению с группой здоровых лиц: соответственно 9,1±0,06, 9,1±0,09 при 0,7±0,05 в контроле (ρ<0,001). Анализ значений показателя в зависимости от степени тяжести заболевания и возраста показал, что уровень IL-1β в большей степени был повышен у больных 2-й группы (табл. 3).
В норме гематоэнцефалический барьер непроницаем для IL-1β. Однако при старении происходит избирательное повышение проницаемости через тканево-сосудистые каналы для сывороточного IL-1β. При развитии ишемии данные процессы нарастают, что способствует повреждению коры головного мозга [3,4].
Значения IL-1β существенно не изменялись и сохранялись повышенными в процессе лечения. Можно полагать, что повышенная продукция IL-1β, наблюдаемая у больных с ОНМК, приводит к активации транскрипционного фактора nF-kB в гладкомышечных клетках сосудов и прогрессированию воспалительно-фиброзных процессов в сосудистой стенке на фоне гиперхолестеринемии, что, возможно, и привело к сосудистой катастрофе, а в дальнейшем способствует развитию хронической церебральной недостаточности [15].
Уровень проатерогенных цитокинов IL-6 и IL-8 был также повышен соответсвенно в 5,9 раз (ρ<0,001) и в 39 раз (ρ<0,001) – (табл.2). В процессе лечения их количество незначительно снижалось, но продолжало оставаться высоким по сравнению с контрольной группой (ρ<0,001). Анализ уровня IL-6 у отдельных пациентов показал, что на его количество в большей степени влияет возраст больных, чем тяжесть течения заболевания (табл. 3). Выявлена четкая отрицательная корреляционная связь между показателем и уровнем общего холестерина (rs= -0,333). Кроме того rs= имел показательную взаимосвязь с наличием у больных одного из традиционных факторов риска ишемического инсульта – артериальной гипертензии (rs= -0,334). В ряде работ отмечено, что повышение содержания IL – 6 приводит к дневной сонливости, усталости, недостаточному снижению систолического артериального давления в ночное время [13], что повышает риск повторных сосудистых атак.
В первый день заболевания у больных обеих групп отмечался достоверно повышенный по сравнению с контролем уровень другого цитокина IL – 8 (табл. 2). Его содержание в сыворотке периферической крови более чем в 30 раз превышало значения в группе сравнения: соответственно 86,8±0,2 и 86,9±0,07 пг/мл (ρ<0,001). После проведенного лечения наблюдалось снижение данного показателя (ρ<0,001), но он продолжал оставаться высоким. Наиболее высокие значения IL-8 наблюдались у пациентов 1-й возрастной группы независимо от степени тяжести заболевания (табл. 3). Такое накопление IL–8 может стимулировать направленную миграцию нейтрофилов за счет индукции адгезивных молекул и активировать пролиферацию эндотелиоцитов и гладкомышечных клеток. При развитии ишемического очага IL–8 рекрутирует клетки воспалительного назначения в место ишемического повреждения и усиливает некробиотические изменения тканях [14]. Можно полагать, что IL–8 IL-6 способствуют развитию хронической церебральной ишемии после сосудистой катастрофы.
У больных с ОНМК было выявлено повышение еще одного провоспалительного цитокина - TNFα в 10 и более раз (табл. 2, табл. 3). Его уровень не зависел от возраста пациентов и тяжести течения заболевания и продолжал оставаться высоким и после проведенного комплексного лечения. Считают, что TNFα накапливаясь и в спинномозговой жидкости [14], вместе с IL1β играет важную роль инициализации воспалительных процессов, развивающихся после острой ишемии, усиливают синтез коллагена фибробластами, изменяют структуру сосудистой стенки, что способствует повышению артериального давления и развитию атеросклеротических повреждений сосудов. Взаимодействие TNFα с рецепторами эндотелия приводит к активации транскрипции (nK-kB, AP-1), которые являются регуляторами генов проатерогенных молекул, разрушению эндотелиального гликокаликса, развитию тканевого отека и тромбозу (20,5). Высокие концентрации IL1β, IL6, TNFα могут являются предикторами негативного течения заболевания, плохого восстановления утраченных функций.
Противовоспалительный цитокин IL10 был повышен уже в первые сутки заболевания: 20,2±0,5 пг/мл при 7,4±0,02 в контроле (ρ<0,01). Данный цитокин угнетает экспрессию молекул адгезии, особенно ICAM-1, участвующих в развитии местного воспаления, подавляет выработку провоспалительных медиаторов, синтез суперактивного аниона, NO и других активных форм кислорода [5,7].Уровень IL10 у обследованных пациентов сохранялся высоким и после лечения – на 21 сутки. Отличались более низкие значения показателя в 1-й возрастной группе: соответственно 18,8±0,36 и 20,5±0,3 пг/мл (ρ<0,01). При этом содержание этого цитокина в периферической крови превышало уровень его у здоровых лиц более чем на 10%. Это, по мнению Е.А. Кладовой [6], следует рассматривать как благоприятный диагностический критерий течения ишемического инсульта, который нивелирует когнитивные дефекты и развитие деменции.
Таким образом, полученные результаты свидетельствуют о значительных метаболических нарушениях у больных с резвившейся острой церебральной ишемией, включая и изменения в сети цитокинов. Гиперпродукция про-и противоспалительных медиаторов может влиять как на течение патологического процесса, так и служить предикторами проградиентного течения заболевания. Глубокий анализ особенностей продукции цитокинов позволит раскрыть патогенетические механизмы в развитии ишемического инсульта и выбрать стратегию коррекции факторов риска его развития.
