Введение. Хронические ишемические повреждения головного мозга занимают ведущее место среди цереброваскулярных заболеваний по показателям заболеваемости и смертности. Поэтому изучение новых патогенетических механизмов развития сосудистых заболеваний головного мозга, связанных с состоянием системы иммунитета и гемостаза сегодня особенно актуально [13].
Ткань мозга в силу разных причин может утрачивать естественную иммунологическую толерантность в связи с нарушением гематоэнцефалического барьера. Одним из ключевых факторов для активации адгезии лейкоцитов на клетках эндотелия и последующей их миграции через гематоэнцефалический барьер являются медиаторы воспаления и цитокины [1].
Функция медиаторов иммунного ответа во многом зависит от носительства различных аллельных вариантов генов цитокинов и рецепторов к ним [11,12]. Гены интерлейкинов обладают чрезвычайно высокой степенью полиморфизма, причем количество полиморфных участков в одном гене может достигать нескольких десятков и располагаться они могут как в кодирующих экзонах, так и интронах и, что особенно важно, в промоторных регуляторных зонах гена [12]. Генетически качественно или количественно измененные молекулы цитокинов влияют на иммунный ответ и развитие воспалительных реакций. Однако, несмотря на широкомасштабные работы по генетическому полиморфизму регуляторных молекул при различных инфекционных, сердечно-сосудистых, аутоиммунных, онкологических заболеваниях [6-8], исследования почти не коснулись цереброваскулярной патологии.
Цель исследования. Оценить феномен лимфоцитарно-тромбоцитарной адгезии (ЛТА) у здоровых и у больных хронической ишемией головного мозга (ХИГМ), осложненной когнитивной дисфункцией - носителей полиморфизма генов, кодирующих цитокины иммунного ответа.
Материалы и методы. Методом сплошной выборки в исследование были включены 195 больных хронической цереброваскулярной патологией с синдромом когнитивной дисфункции (62,5±4,95 лет), находившихся на стационарном лечении в лечебно-профилактических учреждениях (ЛПУ) г. Чита. В качестве критериев включения в группу использовались оценочные баллы со средними значениями: MMSE – 19,95±1,31; Хачински – 6,47±0,97; Гамильтон – 7,3±1,97. Контрольную группу составили 149 здоровых резидентов Забайкальского края соответствующего возраста (51±4,24 лет, р>0,05), не имеющих объективных признаков цереброваскулярной патологии.
Методами исследования послужили:
1. Полимеразная цепная реакция (ПЦР) на ДНК лейкоцитов крови для выявления полиморфизма IL-1b(T-31C), IL-2(T330G), IL-10(G-1082A), IL-10(C-819T), TNF(G-308A) (НПФ «Литех», Москва), с детекцией продукта амплификации в агарозном геле.
2. Подсчет лимфоцитарно-тромбоцитарных коагрегатов в цитратной крови (относительные и абсолютные значения), определение лимфоцитарно-тромбоцитарного индекса (ЛТИ) по оригинальной методике Ю.А. Витковского (1991) [4].
Статистическая обработка полученных результатов проводилась с использованием пакетов программ Microsoft Excel 2010, STATISTICA 6.1 (Stat Soft Inc., США). Для сравнения групп по качественному бинарному признаку применялся критерий χ2 (Пирсона). Для сравнения средних величин применялся критерий Манна-Уитни (U-тест) со стандартным отклонением (M±σ). Значения уровня p<0,05 рассматривались как статистически значимые.
Результаты и обсуждение. В результате молекулярно-генетического исследования обнаружены все искомые мутации в гомо- и гетерозиготном состоянии. Отклонение от равновесия Харди-Вайнберга выявлено для полиморфизма IL-1(T-31C) у больных хронической ишемией головного мозга с синдромом когнитивной дисфункции, полиморфизма IL-10 (G-1082A) в группе здоровых резидентов, преимущественно за счет разницы наблюдаемой и ожидаемой гомозиготности по мутантному аллелю. При сравнении частот в клинической и контрольной группах в носительстве изучаемых полиморфизмов наблюдались отчетливые различия по генотипу IL-1β-31СС с преобладанием последнего у больных ХИМ (р=0,03) и, соответственно, по аллелю IL-1β 31C у этих же исследуемых (р=0,006) (таблица 1). Исследования последних лет [7] показали, что у лиц, гомо- или гетерозиготных по высоко продуцирующему аллелю IL-1β, производится соответственно в 4 или 2 раза больше этого провоспалительного цитокина, чем у лиц гомозиготных по дикому аллелю этого гена [9]. Соответственно, можно предположить, что у носителей данного полиморфизма повышенная экспрессия IL-1β приведет к развитию каскада патологических реакций, проявляющихся в виде ишемического, аутоиммунного повреждения головного мозга, проявляющегося хронической церебральной ишемией.
Носительство других полиморфных вариантов генов цитокинов, изучаемых нами, не различалось в группах наблюдения, однако их влияние на развитие и течение патологического процесса весьма вероятно. Так, по данным литературы, полиморфизм гена IL-10 в позиции -1082A, -819Т, IL-2 в позиции -330G ассоциированы c низкой продукцией этих интерлейкинов, что приводит к относительному повышению продукции таких провоспалительных цитокинов, как IL-1, TNF-α [8]. Аллельный вариант TNF 308A повышает транскрипционную активность гена TNFα и, соответственно, продукцию тумор-некротического фактора [10]. Таким образом, генетически опосредованный дисбаланс цитокинов с увеличением концентрации провоспалительных интерлейкинов, влияет на основные физиологические механизмы и приводит к прокоагулянтным сдвигам и инициации воспаления.
Таблица 1. Частота аллелей и генотипов изучаемых полиморфизмов у больных ХИГМ и исследуемых контрольной группы
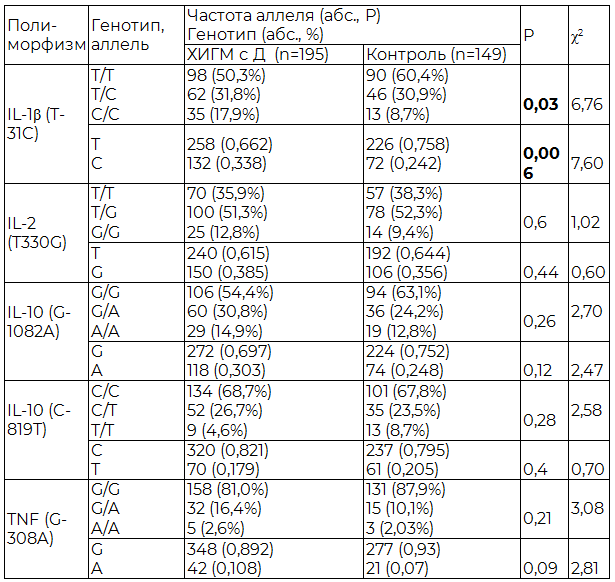
Примечание: жирным шрифтом помечена достоверная вариабельность носительства аллелей в группах.
Феномен лимфоцитарно-тромбоцитарной адгезии представляет собой не только одну из физиологических функций, но и является индикатором патофизиологических реакций, отражая взаимосвязь между процессами тромбообразования и воспаления. Ранее установлено [2,3,4,5], что про- и противовоспалительные цитокины являются регуляторами взаимодействия лимфоцитов и тромбоцитов (усиливают ЛТА интерлейкины TNF, IL-1β, IL-2, ингибируют IL-4, IL-10 [13]). В связи с этим, нами предпринята попытка выявить влияет ли носительство изучаемого полиморфизма генов интерлейкинов на образование агрегатов.
По данным нашего исследования у наблюдаемых клинической группы количество лимфоцитарно-тромбоцитарных агрегатов относительно резидентов контрольной группы значительно возрастало, причем число адгезированных тромбоцитов на лимфоците также увеличивалось (р<0,05) (табл. 2).
Таблица 2. Лимфоцитарно-тромбоцитарная адгезия и ЛТИ в крови у больных ХИГМ и здоровых резидентов, не имеющих объективных признаков цереброваскулярной патологии (M±SD)
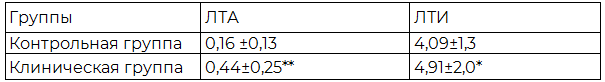
Примечание: (U- тест)- **- р<0,001 при сравнении в группах здоровых исследуемых и больных ХИГМ.
У здоровых испытуемых при изучении ЛТА в зависимости от носительства того или иного генотипа изучаемого полиморфизма отмечено, что у здоровых, имеющих мутантные аллели степень адгезии имела тенденцию к снижению, кроме носительства TNF 308A - по сравнению с носителями дикого аллеля адгезия незначительно увеличивалась (р>0,05). Лимфоцитарно-тромбоцитарный индекс был несколько больше у обладателей минорного аллеля практически всех изучаемых полиморфизмов (р>0,05). Вероятно, это связано с генетически обусловленной активацией способности тромбоцитов адгезироваться на лимфоцитах, в связи с цитокиновым дисбалансом в сторону повышения провоспалительных цитокинов.
Среди больных хронической ишемией мозга – носителей патологических аллелей практически всех рассматриваемых полиморфизмов ЛТА имела тенденцию к увеличению (р>0,05). Максимальное количество адгезированных тромбоцитов на одном лимфоците наблюдалось у носителей IL-10 819Т - 5,09±2,03. У пациентов имеющих TNF308A аллель регистрировалось снижение как ЛТА, так и ЛТИ. Возможно, это связано с быстрой адгезией in vivo и обнаружением малоактивных лимфоцитов и тромбоцитов in vitro.
Двойное носительство мутантных аллелей (мутантная гомозигота) показывает в обеих группах наблюдения ту же тенденцию: у здоровых испытуемых при наличии двух минорных аллелей ЛТИ сравнительно увеличивалось, а вот абсолютное значение агрегатов несколько снижалось (р>0,05) (табл. 3). Возможно, это вызвано влиянием полиморфизма изучаемых цитокинов в сторону значительного повышения образования высвобождаемых интерлейкинов, в частности IL-1β, TNFα и снижения противовоспалительных цитокинов, в частности IL-10, что способствует более быстрому образованию агрегатов, повышению проницаемости сосудистой стенке, и выходу коагрегатов в ткани [2,3,4,13].
Таблица 3. Лимфоцитарно-тромбоцитарная адгезия и ЛТИ у больных ХИГМ, осложненной когнитивной дисфункцией - носителей гомозиготных генотипов, (M±SD)
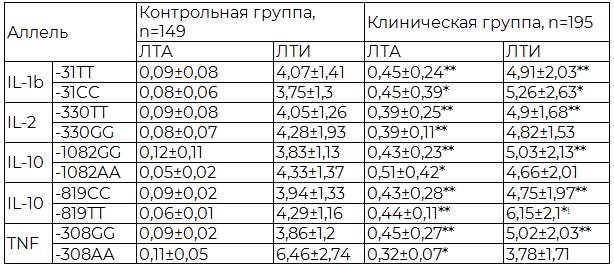
Примечание: (U- тест) - * p<0,05; ** p <0,001 - достоверность различий между группой больных ХИГМ, носителей изучаемых генотипов и группой здоровых исследуемых; ! p<0,05 - достоверность различий внутри группы больных ХИГМ.
Таким образом, наличие мутантных аллелей изучаемых полиморфизмов или их двойное носительство стимулирует образование лимфоцитарно-тромбоцитарных коагрегатов в крови как в норме, так и при изучаемой патологии и влияет, предположительно, на более быструю миграцию коагрегатов [5,12] в том числе и через гематоэнцефалический барьер в патологически измененные ткани мозга для ограничения и ликвидации зоны микронекроза (формирование очагов лейкоареоза).
Заключение. У больных хронической ишемией мозга с синдромом когнитивной дисфункции выявлены все варианты изучаемых полиморфизмов генов цитокинов, большинство которых в носительстве подчинено равновесию Харди-Вайнберга. Наличие мутантных аллелей полимофизма цитокинов или их двойное носительство повышает образование лимфоцитарно-тромбоцитарных коагрегатов в крови как в норме, так и при изучаемой патологии, и влияет, предположительно на более быструю миграцию коагрегатов через гематоэнцефалический барьер в патологически измененные ткани для ограничения и ликвидации зоны микронекроза (формирование очагов лейкоареоза), что в конечном итоге способствуют развитию стойких и прогрессирующих когнитивных нарушений, быстро достигающих стадии деменции.
