Актуальность проблемы. Актуальность изучения феномена эпилепсии определяется его клинической, социальной, экономической и научной значимостью [6, 7]. Клиническая гетерогенность данного явления отражена в классификации эпилептических приступов и эпилепсии как нозологической формы, при этом различные формы заболевания характеризуются особенностями течения и реакции на терапию [18]. Эпилептический приступ представляет собой системную реакцию организма; показано, что пароксизмальный характер реакции предопределяется свойствами нервной системы [3]. Интегративный характер организации физиологических механизмов феномена эпилепсии и его клиническая гетерогенность определяет актуальность изучения взаимоотношений физиологических параметров у больных эпилепсией и прогнозирования на их основе характера течения заболевания [22].
Учитывая системный характер целенаправленного поведения [15] в качестве значимых для решения задачи прогнозирования показателей должны быть использованы параметры деятельности сенсорных систем (механизмы афферентации) [4], характеристики активности ассоциативных структур головного мозга [15, 24], показатели активности моторных (эфферентных) механизмов, а также характеристики результативности деятельности и изменения гомеостатических показателей («физиологические траты») при её реализации [5, 8, 20, 23].
Цель исследования: провести оценку прогностической значимости характеристик физиологических механизмов целенаправленной деятельности у больных эпилепсией для определения особенностей течения заболевания.
Материалы и методы. Обследовано 50 больных эпилепсией; из них 22 мужчины и 28 женщин, средний возраст составил 31,3 года. В исследование включены пациенты с симптоматической (19 человек), криптогенной (30 человек) и идиопатической (1 пациент) формами эпилепсии. Критериями разделения пациентов на группы являлись число простых парциальных, сложных парциальных (СПП) и генерализованных приступов (ГСП) за 1 месяц; число антиконвульсантов, принимаемых пациентами для контроля за приступами, эффективность контроля за приступами (1 балл – отсутствие приступов, 2 балла – уменьшение числа приступов или изменение их структуры, 3 балла – неэффективный контроль), уровень когнитивных нарушений (0 – отсутствие когнитивных и эмоциональных нарушений; 1 – минимальные или умеренные когнитивные и эмоциональные (депрессивные, тревожные) расстройства, 2 – выраженные когнитивные нарушения, психотические расстройства) и социальной адаптации (1 балл – удовлетворительная социальная адаптированность, 2 балла – проблемы с социальной адаптацией (потеря или смена работы, семейные проблемы из-за приступов); 3 балла – социальная дизадаптация (инвалидизация, ограничение социальных контактов, выраженная дизадаптация в быту).
Статистическая обработка данных проводились при помощи пакета программ Statistica 6.0. Разделение пациентов на подгруппы осуществлялось методом кластерного анализа [9] с определением числа подгрупп методом иерархического анализа. Метод k-средних был использован для анализа различий между кластерами и идентификации их элементов. Дисперсионный анализ с использованием непараметрического критерия Краскела-Уоллиса (H) применялся для оценки различий показателей между кластерами. Для описательной характеристики подгрупп пациентов применялись средние значения параметров, медиана, верхний и нижний квартиль [12].
Моделирование целенаправленной деятельности осуществлялось при помощи теста Платонова-Шульте с использованием программы «Физиотест». Оценивалось среднее время выполнения пробы, среднее время выбора одного числа, число ошибок [10]. Для косвенной оценки изменений газового гомеостаза во время деятельности до проведения теста и во время его выполнения проводилась капнография при помощи прибора «КП-01» производства ОАО «Еламед», Россия. Определялась частота дыхания, парциальное давление углекислого газа в выдыхаемом воздухе (РET CO2) [2, 19].
Регистрация экзогенных и когнитивных вызванных потенциалов проводилась при помощи программно-аппаратного комплекса «Нейро-МВП» фирмы «Нейрософт», г. Иваново для оценки активности корковых проекционных зон сенсорных систем и показателей функционирования ассоциативных зон коры головного мозга. Зрительные вызванные потенциалы (ЗВП) записывались при расположении активных электродов в отведениях О1, О2, Оz; референтного в отведении Сz, при подэлектродном импедансе не более 5 кОм; реверсивный шахматный паттерн предъявлялся с 17 дюймового монитора Samsung TFT с угловой величиной стимула 40 угловых минут. Оценивались показатели латентности (лат.) компонентов Р1, N1, P2, N2; межпиковая амплитуда (А) P1N1, N1P2, P2N2 [4]. Длиннолатентные слуховые вызванные потенциалы (СВП) регистрировались при бинауральной стимуляции с частотой 1 Гц, длительностью тона 50 мс, высотой тона 1500 Гц. Отводящие электроды располагались на голове пациента в отведениях С3, С4, Сz; референтные в точках А1 и А2, заземляющий на лбу. Верифицировались пики N1 (70-90 мс), P2 (150-200 мс), N2; оценивались межпиковые амплитуды (А) N1P2; P2N2 [4].
Регистрация потенциала Р300 проводилась при вероятностном появлении значимого стимула (30% вероятность, высота тона 2000 Гц) с активной реакцией пациента на его появление (нажатие на кнопку). Регистрация и усреднение ответа проводилось по отведениям Pz, Cz, Fz c референтными электродами на ушах (А1 и А2). Определялась латентность компонентов потенциала Р300 N2 и Р3; межпиковая амплитуда P2N2, N2P3. Условно негативная волна (CNV) оценивалась как психофизиологический коррелят уровня готовности к моторному ответу. Регистрация пробы проводилась эпохами до 2,5 секунд, в парадигме предупреждающего (тон высотой 2000 Гц, интенсивностью 80 Дб) и пускового стимулов (высота тона 1000 Гц, интенсивность 80 Дб). Регистрация проводилась с отведений Fz, Cz, Pz c расположением референтных электродов на ушах. Число усреднений составило 40. Оценивалась амплитуда компонента M1 и M2 от базовой линии, а также разница амплитуд M1 и M2 [4].
Анализ F-ответа проводился для оценки состояния мотонейронного пула спинного мозга, обеспечивающего реализацию эффекторного компонента деятельности [11]. Регистрацию проводили блоками по 40 кривых при стимуляции правого и левого срединного нервов в области запястья, с длительностью стимула 0,2 мс, величиной стимула 150% от моторного порога и периодической подачей стимула частотой 1 Гц Анализировались показатели латентности F-волны амплитуды F-волны (от пика до пика), площадь F-волны [11; 20].
Учитывая сложность отношений между физиологическими показателями в ходе реализации целенаправленной деятельности для моделирования нелинейных физиологических и клинико-физиологических взаимосвязей и решения прикладной задачи прогнозирования особенностей течения заболевания была использована технология искусственных нейронных сетей. Применение пакета программ Statistica Neural Networks 4.0 позволило осуществить решение задачи классификации исследуемых на кластеры на основе физиологических показателей и показателей результативности целенаправленной деятельности. В качестве показателей эффективности нейронной сети использовались уровень ошибки, производительность, а также результаты решения задачи классификации. Дополнительному анализу подвергались переменные значимые для прогноза (предикторы) [13].
Результаты исследования. Результаты иерархического кластерного анализа позволили на основании евклидовых расстояний выделить 3 кластера. В соответствии с предложенными критериями кластеризации методом K-средних были выделены и охарактеризованы 3 подгруппы испытуемых (рис. 1).
В кластер 1 вошло 12 человек, в кластер 2 - 27 человек, в кластер 3 - 11 человек.
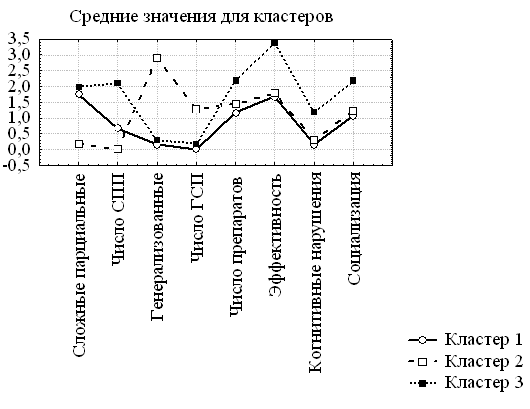
Рис. 1. Характеристика кластеров больных эпилепсией.
Методом дисперсионного анализа были выявлены достоверные различия между кластерами по изучаемым показателям (табл. 1).
Таблица 1. Результаты анализа различий показателей в кластерах

В кластер 1 вошли пациенты с преобладанием парциальных комплексных приступов, получающие 1 препарат, с удовлетворительной эффективностью лечения, минимальным уровнем психических нарушений и высокой социальной адаптированностью. Кластер 2 включает больных, сходных с пациентами кластера 1 по эффективности терапии, уровню психических нарушений и социализации, но с преобладанием генерализованных приступов. Пациенты кластера 3 характеризуются преобладанием сложных парциальных приступов, использованием от 2 до 3 препаратов для контроля за приступами, а также более высоким уровнем психических нарушений и социальной дизадаптацией.
При анализе различий по результативности моделируемой целенаправленной когнитивной деятельности были определены достоверные различия между кластерами (табл. 2).
Таблица 2. Результативность выполнения теста Платонова-Шульте в группе больных эпилепсией
При одинаковом уровне ошибок, пациенты в кластере 3 характеризуются достоверно большим средним временем выбора определённого числа в тесте.
В табл. 3 представлены изменения показателей газового гомеостаза, оцененные косвенно по уровню углекислоты в выдыхаемом воздухе.
Таблица 3. Уровень углекислоты в выдыхаемом возрасте в исходном состоянии и во время когнитивной нагрузки
Как следует из табл. 3, пациенты группы 3 в фоновом состоянии характеризуются более низким уровнем углекислоты в выдыхаемом воздухе; однако, статистически значимыми данные различия становятся во время реализации когнитивной деятельности.
Результаты дисперсионного анализа по показателям амплитуды и латентности экзогенных и эндогенных (когнитивных) вызванных потенциалов отражены в табл. 4.
Таблица 4. Показатели экзогенных и когнитивных вызванных потенциалов в кластерах
Выявлены достоверные различия между кластером 3 и кластерами 1 и 2 по амплитуде потенциала N75-P100 (сниженный уровень в кластере 3). При анализе различий по амплитуде длиннолатентного СВП потенциала N1P2 выявлен сниженный его уровень в кластере 3.
Обращает на себя внимание увеличенная латентность компонента Р3 и большая амплитуда потенциала N2 в лобных отведениях в кластере 3, увеличение амплитудных характеристик компонента Р3 в лобных отведениях, также более высокий уровень амплитуды компонента Р3 в отведении Р3 и волны ожидания у пациентов кластера 3.
Дополнительно были оценены показатели F-ответа, отражающие уровень возбудимости спинальных мотонейронов, участвующих в реализации исполнительного компонента целенаправленной деятельности (табл. 5).
Таблица 5. Показатели стимуляционной электронейромиографии с регистрацией F-ответа в кластерах
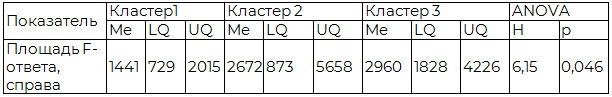
Определяются достоверно более низкий уровень площади F-ответа при стимуляции правого срединного нерва в группе 1.
Для моделирования сложных нелинейных отношений между нейрофизиологическими параметрами и их связи с клиническими характеристиками был построен набор из искусственных нейронных сетей. Оптимальными характеристиками обладала нейронная сеть с архитектурой многослойного персептрона (3 слоя промежуточных нейронов) с 14 входными элементами, 8 нейронами в скрытом слое и 1 выходным (номер кластера) (рис. 2).
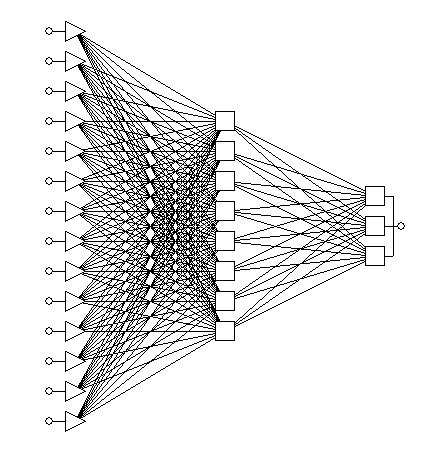
Рис. 2. Нейронная сеть (тип многослойный персептрон – MLP), число входных элементов 14, число нейронов в скрытом слое – 8, производительность 1,0, уровень ошибки 0,00982).
Показатели, используемые нейронной сетью в качестве входных переменных (в порядке убывания их прогностической значимости) включали в себя латентность Р3 Р300 в Pz, амплитуду N75P100 ЗВП в О1, амплитуду Р100N145 ЗВП в О1, амплитуду Р3 Р300 в Fz, амплитуду N1P2 длиннолатентного СВП в C3, среднее время выбора в тесте Платонова-Шульте, максимальную площадь F-ответа при стимуляции правого срединного нерва, уровень углекислоты в выдыхаемом воздухе в фоновом состоянии, среднее число ошибок в тесте Платонова-Шульте, амплитуду N2 Р300 в Fz, амплитуду M1-M2 в Pz, амплитуду Р3 Р300 в Pz, амплитуду N2 P300 в Cz, уровень углекислоты в выдыхаемом воздухе при когнитивной пробе.
В таблице 6 отражены результаты классификации выборки данной нейронной сетью. В обучающей выборке несоответствие результата классификации, определённого при обработке входных параметров, известному исходно номеру кластера, приводило к подстройке синаптических весов элементов искусственной нейронной сети (обучение). В тестовой выборке отражены результаты итогового обучения нейронной сети.
Таблица 6. Результаты работы нейронной сети
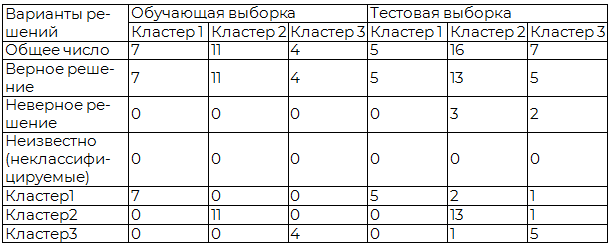
Как следует из таблицы 6, задача обучения была эффективно реализована в последовательных циклах обучения нейронной сети (отсутствует ошибки в обучающей выборке); в то же время в тестовой выборке были сделаны ошибки при распределении исследуемых к кластеру 2 (ошибочно отнесены 2 испытуемых кластера 1 и 1 пациент кластера 3), а также кластера 3 (по 1 из испытуемых кластера 1 и 2).
Обсуждение результатов. Успешное решение задачи кластеризации с выделением подгрупп, достоверно различающихся по предложенным характеристикам, отражает гетерогенность группы пациентов, в данном случае больных эпилепсией [6, 9]. Следует говорить об удовлетворительном контроле за приступами и относительно благоприятном типе течения заболевания у пациентов в кластерах 1 и 2, и о признаках фармакорезистентной эпилепсии у пациентов кластера 3 с более высоким уровнем когнитивных нарушений и социальной дизадаптацией.
Достоверно большее время выбора при моделировании когнитивной деятельности у пациентов кластера 3 отражает измененение процессов афферентации, планирования деятельности и моторные особенности [1, 10]. Более низкий уровень специфической афферентации в этой же группе больных с неблагоприятным течением может быть объяснён как эффектом большего числа антиконвульсантов, так и большей активностью ингибирующих антиэпилептических субсистем [4, 24]. Снижение амплитуды ранних компонентов вызванных потенциалов в кластере 3 сочетается с более высокой мощностью ответа в ассоциативных зонах коры при регистрации эндогенных вызванных потенциалов, что связано как с активацией ассоциативных зон коры при когнитивной деятельности, так и с недостаточностью габитуации ответа при повторном предъявлении стимула [1, 4].
Cмещение максимума ответа в лобные отведения в кластере 1 и 3 может отражать компенсаторное включение дополнительных зон коры при усложнении когнитивной задачи [16]. Увеличение амплитуды «волны ожидания» в кластере 3 по данным CNV указывает на недостаточность ингибирующих механизмов и на необходимость большей активации коры при подготовке к моторному ответу [17]. Снижение показателя площади F-ответа в кластере 1 по сравнению с кластерами 2 и 3 демонстрирует специфику функционирования моторных систем с меньшей перманентной активностью сегментарных спинальных механизмов моторного контроля у больных с хорошей эффективностью лечения [20].
Сниженный уровень углекислоты по данным капнографии у пациентов кластера 3 как в исходном состоянии (готовность к деятельности), так и во время реализации деятельности отражает изменение паттерна дыхания с развитием относительной гипервентиляции [2], что, при исключении патологии респираторной системы, позволяет связать данный феномен с большей активацией стресс-реализующих систем [2,3].
Физиологические субсистемы обеспечения реализации целенаправленной деятельности объединены сложной сетью иерархических, последовательных и циклических связей [5, 15]. Технология искусственных нейронных сетей позволила подтвердить валидность изучаемых физиологических показателей и ранжировать их в порядке значимости для решения задачи классификации пациентов по клиническим подгруппам [13]. Наиболее мощными предикторами оказались показатели специфической афферентации, активации ассоциативных зон коры в функционально значимых зонах; меньшей значимостью обладали показатели результативности деятельности, изменений газового гомеостаза во время целенаправленной деятельности. Распределение показателей по значимости может быть связано как со спецификой моделируемой когнитивной деятельности (психофизиологическое тестирование, связанное с распознаванием зрительных образов и концентрацией внимания) [10], так и с психофизиологическими особенностями исследуемой группы пациентов.
Выводы
1. Метод кластерного анализа на основе характеристик приступов, эффективности терапии, психических нарушений и уровня социализации позволяет выделить 3 подгруппы больных эпилепсией.
2. Группа больных с признаками фармакорезистентной эпилепсии (кластер 3) характеризуется замедлением времени выбора при когнитивной деятельности, более выраженным смещением параметров газового гомеостаза; сниженным уровнем биоэлектрогенеза в специфических корковых зонах сенсорных систем и более высокой активацией в ассоциативных зонах коры, а также меньшим контролем за сегментарным мотонейронным аппаратом спинного мозга.
3. Технология нейронных сетей позволяет классифицировать больных эпилепсией по кластерам на основе физиологических параметров и показателей эффективности деятельности, при этом более мощными предикторами прогноза являются показатели специфической афферентации и когнитивных вызванных потенциалов.
