Эпилептические припадки являются вторым по частоте клиническим проявлением опухолей головного мозга. Эпилептический синдром, имевший место до оперативного лечения, сохраняется в послеоперационном периоде практически у половины всех оперированных больных, являясь одной из основных причин утраты трудоспособности [1, 2].
Несмотря на значительные успехи в изучении эпилептогенеза за последнее десятилетие, теоретический и практический интерес к изучению клеточно-молекулярных механизмов развития симптоматической эпилепсии не ослабевает, а сама проблема не теряет своей актуальности. Большую роль в клеточно-молекулярных механизмах эпилептогенеза играют α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA) ионотропные глутаматные рецепторы. Через рецепторы и сопряженные с ними ионные каналы натрия и кальция реализуется ионотропный эффект глутамата, являющегося наиболее распространенным возбуждающим нейротрансмиттером нервной системы [3, 4,5].
При нарушениях физиологических механизмов выброса в синаптическую щель, транспорта и биохимической трансформации глутамата происходит активация и, при определенных патологических состояниях, последующая альтерация ионотропных глутаматных рецепторов, которая формирует электрофизиологическую базу для возникновение пароксизмального деполяризационного сдвига мембранного потенциала, являющегося нейрофизиологической основой эпилепсии, а также приводит к запуску механизмов некроза и апоптоза нейрона [6, 7].
Цель работы. Улучшение результатов лечения больных с симптоматической эпилепсией опухолевой этиологии на основании изучения особенностей альтерации AMPA рецепторов глутамата в патогенезе заболевания.
Материалы и методы. Обследовано 92 больных с глиомами полушарий большого мозга, проходивших обследование и лечение в клинике ИМЧ РАН. Мужчин было 53 (57,6 %), женщин 39 (42,4 %). Возраст больных варьировал от 19 до 84 лет. Исследуемую группу составили 58 (63%) больных, в клинической картине заболевания которых регистрировались эпилептические припадки, контрольную - 34 (37%) больных, у которых эпилептических припадков не наблюдалось. Распределение больных по полу и возрасту представлено в табл. 1. Распределение больных по локализации опухолей в контрольной и исследуемой группах представлено в табл. 2.
Таблица 1. Распределение больных с глиомами полушарий большого мозга в контрольной и исследуемой группах по полу и возрасту
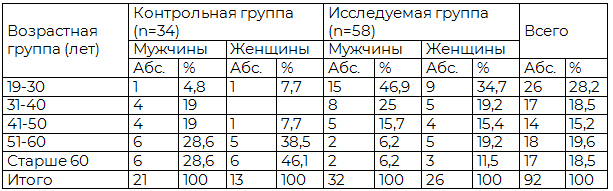
Таблица 2. Распределение больных с глиомами полушарий большого мозга в контрольной и исследуемой группах по локализации опухоли
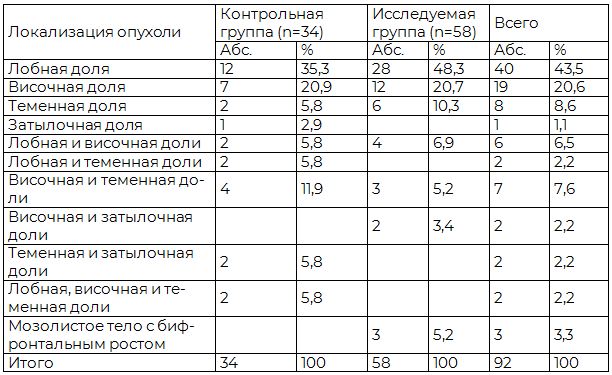
В общей серии наблюдений у 4 (4,3%) больных была выявлена пилоцитарная астроцитома, у 22 (23,9%) - фибриллярно-протоплазматическая, у 24 (26,1%) - анапластическая, у 30 (32,6%) - глиобластома, у 3 (3,3%) - олигодендроглиома, у 1 (1,1%) - анапластическая олигодендроглиома, у 7 (7,6%) –олигоастроцитома, у 1 (1,1%) – анапластическая олигоастроцитома. Распределение больных по степени злокачественности опухоли в контрольной и исследуемой группах представлено в табл. 3.
Таблица 3. Распределение больных с глиомами полушарий большого мозга в контрольной и исследуемой группах по гистологическому типу и степени злокачественности опухоли
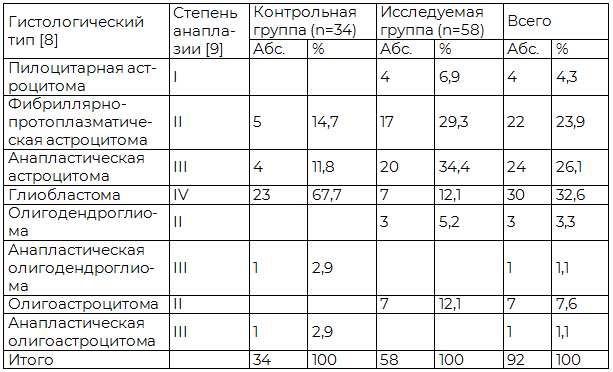
В контрольной группе преобладали больные с глиомами III и IV степеней анаплазии – 29 (85,3%) (p<0,05). В исследуемой группе соотношение больных с глиомами I–II и III-IV степеней анаплазии достоверно не разнилось – соответственно 31 (53,4%) и 27 (46,6%) больных.
В фазе клинической компенсации находилось 30 (32,6%) больных, в фазе клинической субкомпенсации – 38 (41,3%) больных, в фазе умеренной клинической декомпенсации – 22 (23,9%) больных, в фазе грубой клинической декомпенсации – 2 (2,2%) больных [10]. Достоверных различий по уровню компенсации заболевания в сравниваемых группах не выявлено.
Больные обследованы в рамках диагностического комплекса, включающего оценку соматического и неврологического статуса (n=92) , КТ (n=50), МРТ с МР ангиографией (n=42), ЭЭГ (n=92), ПЭТ с 18-FDG и 11C-метионином (n=32). В качестве оценки степени альтерации AMPA рецепторов глутамата использован иммуноферментный метод полуколичественного определения уровня аутоантител в периферической крови (ААТ) к GluR1 субъединице AMPA рецепторов (GluR1)[11, 12]. В качестве антигена для определения уровня ААТ в сыворотке крови использовали синтетические пептиды, соответствующие N концевой последовательности аминокислот субъединицы GluR1 АМРА, полученые методом твердофазного синтеза на NPS-400 полуавтоматическом синтезаторе (Neosystem Laboratory, Франция). Образованный комплекс антиген-антитело выявлялся с помощью вторых антител, меченных пероксидазой хрена. Реакцию оценивали спектрофотометрически при фиксированной длине волны 490 нм. Уровень аутоантител выражали в процентах отношения оптической плотности исследуемого образца и оптической плотности образца контрольной группы. Нормальный диапазон ААТ определен в 75-110 % [11, 12]. Статистическая обработка полученных данных произведена на платформе прикладной лицензионной программы Statistica 10.0. Перед проведением статистического анализа выборки проведена проверка полученных данных на нормальность распределения по критерию Колмогорова-Смирнова. Вычисляли выборочное среднее (M), среднеквадратичное отклонение (σ), стандартную ошибку среднего (m). Для установления достоверности различий использовали t критерий Стъюдента. Различия считали статистически значимыми при р < 0,05.
Результаты и обсуждение. При анализе уровней ААТ к GluR1 выявлено повышение среднего уровня этого показателя на 38-58,6% в зависимости от локализации опухоли. При этом отмечалась устойчивая тенденция к увеличению у больных уровня ААТ к GluR1 при локализации опухоли в лобной доле как при сравнительном анализе в группах по признаку локализации опухоли в пределах 1 доли, так и в группах по признаку локализации в пределах 2 долей (p<0,05). Сравнительная оценка уровней AAT к GluR1 субъединице AMPA рецепторов глутамата у больных исследуемой группы в зависимости от локализации опухоли представлена в табл. 4.
Таблица 4. Сравнительная оценка уровней AAT к GluR1 субъединице AMPA рецепторов глутамата у больных исследуемой группы в зависимости от локализации опухоли (n=58)
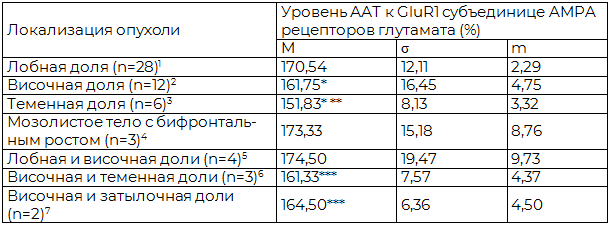
Примечания: 1,2,3 – условные обозначения групп сравнения при локализации опухоли в пределах 1 доли; 4,5,6,7 – условные обозначения групп сравнения при локализации опухоли в пределах 2 долей; * - разница достоверна по сравнению с 1 (p<0,05); ** - разница достоверна по сравнению с 2 (p<0,05), *** - разница достоверна по сравнению с 5 (p<0,05).
Средний уровень ААТ к (GluR1) в исследуемой группе больных (n=58) был выше верхней границы нормы на 51,4%.
У больных с супратенториальными глиомами II степени анаплазии контрольной группы (n=5) средний уровень ААТ к GluR1 не выходил за пределы диапазона нормальных значений.
У больных с супратенториальными глиомами III-IV степени анаплазии контрольной группы (n=29) средний уровень ААТ к GluR1 превышал верхнюю границу нормы на 48,5%. Сравнительная оценка уровней AAT к GluR1 субъединице AMPA рецепторов глутамата у больных с супратенториальными глиомами I-II и III-IV степеней анаплазии контрольной и исследуемой групп представлена в табл. 5.
Таблица 5. Сравнительная оценка уровней AAT к GluR1 субъединице AMPA рецепторов глутамата у больных с супратенториальными глиомами II и III-IV степеней анаплазии контрольной и исследуемой групп (n=92)
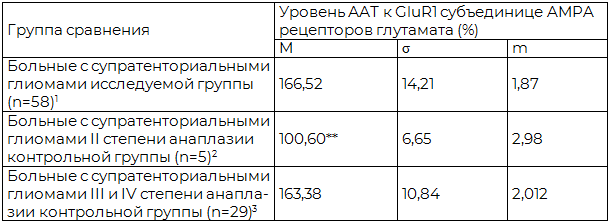
Примечания: 1,2,3 – условные обозначения групп сравнения; * - достоверно по сравнению с 1, 2 (p<0,05); ** - достоверно по сравнению с 1,3 (p<0,05).
Заключение. Проведенные в последние годы высокотехнологичные патоморфологические исследования опухолей головного мозга показали, что глиальные опухоли, по мере увеличения их степени анаплазии, начинают самостоятельно вырабатывать глутамат, обуславливая эффект эксайтотоксичности в анатомических пределах перитуморозной зоны [13, 14]. Подобные особенности бластоматозного роста формируют специфику клинической картины заболевания, в том числе и наличие эпилептического синдрома у данной категории больных. Реализация эффекта эксайтотоксичности в процессе бластоматозного роста через активацию и последующую альтерацию ионотропных рецепторов глутамата носит стадийный характер и зависит от степени анаплазии опухоли и ее локализации.
В условиях отсутствия достоверных различий в степени злокачественности опухоли и степени клинической компенсации заболевания, при воздействии опухоли на лобную и височную доли регистрируется максимальный уровень ААТ к GluR1 субъединице AMPA рецепторов глутамата, что может отражать неравномерное распределение глутаматных рецепторов этого типа с увеличением плотности их распределения в данных отделах головного мозга.
При глиомах I-II степени анаплазии альтерация AMPA рецепторов глутамата развивается с латентным периодом, при этом нарастание уровня ААТ к GluR1, как критерия повреждения AMPA рецепторов, коррелирует с наличием в клинической картине заболевания эпилептических припадков. По мере увеличения степени анаплазии отмечается нарастание уровня ААТ к GluR1. У больных с супратенториальными глиомами III и IV степени анаплазии контрольной группы (n=29) уровень ААТ к GluR1 составил 163,38+2,01%. При высоком уровне ААТ к GluR1 эпилептических припадков у больных этой группы зарегистрировано не было. Значительное повышение уровня ААТ к GluR1 субъединице AMPA рецепторов глутамата у больных со злокачественными глиомами отражает запуск механизмов некроза клеточных структур перифокальной зоны, реализуемых через глутамат-кальциевый каскад [7, 15, 16], который по темпу развития опережает потенциальную ирритацию мозговых структур с клиническими проявлениями в виде эпилептических припадков.
