Введение. Последствия острой фокальной ишемии, степень ее повреждающего действия определяются, прежде всего, тяжестью и длительностью снижения мозгового кровотока. Не него влияют, как правило, диаметр сосуда и степень его окклюзии, состояние коллатеральных сосудистых сетей, скорость реканализации и реперфузии. Кроме этого, размер инфаркта мозга зависит от состояния зоны пенумбры и, несколько от селективной чувствительности ее нейронов к ишемии, а в большей мере от восстановления кровотока на уровне микроциркуляции [5]. В последние годы всё более широко исследуется роль взаимодействия между форменными элементами крови в нарушении реологии и развитии сосудистых катастроф. Установлено, что лейкоциты, эритроциты и тромбоциты способны взаимодействовать, образуя лейкоцитарно-эритроцитарные (ЛЭА), эритроцитарно-тромбоцитарные (ЭТА) и лейкоцитарно-тромбоцитарные агрегаты (ЛейТА) [7,9]. Исследованиями последних лет показано, что количество межклеточных агрегатов в десятки раз может возрастать при неотложных состояниях углубляя расстройства в системе гемостаза, которые более выражены на уровне сосудов мелкого и среднего диаметра [2,4]. Однако прогностическая роль этого феномена практически не изучалась. Решение данной проблемы имеет не только теоретическое, но и важное практическое значение, так как дает возможность врачу еще один способ объективно оценить тяжесть патологического процесса, с большой долей вероятности прогнозировать развитие осложнений и, следовательно, предпринимать меры для их предотвращения.
Цель. Оценить клинико-прогностическое значение и степень агрегационной активности форменных элементов в периферической крови у больных ишемическим инсультом различной степени тяжести и различным реабилитационным потенциалом в будущем.
Материалы и методы. Методом сплошной выборки в процесс исследования были включены 178 больных ишемическим инсультом в возрасте 60,9±11,2 лет. Все наблюдаемые нами пациенты находились на стационарном лечении в отделение неврологии и блоке интенсивной терапии Краевой клинической больницы г. Чита в период с 2009 по 2013 г. и были госпитализированы в первые сутки от начала заболевания. В большинстве случаев, диагноз острого нарушения мозгового кровообращения (ОНМК) был подтверждён нейровизуализационными методами исследования – 96,2% случаев.
В контрольную группу были включены 108 человек (62 женщины и 46 мужчин), проживающих в городе Чита и считающих себя относительно здоровыми, средний возраст которых составил 39,5±14,3 лет. Критериями исключения из этой группы являлись: беременность; острые заболевания и хронические в стадии обострения; злокачественные новообразования; гематологические заболевания; цереброваскулярная патология.
Все больные по степени тяжести заболевания (согласно шкале NIHDSS) были разделены на три группы:
1-я группа (38 человек) включала пациентов с легким течением заболевания - до 5 баллов,
2-я (98 человек) - больных, у которых регистрировалась средняя степень тяжести инсульта - от 5 до 10 баллов,
3-я группа (42 человека) – пациентов с тяжелым инсультом с оценкой более 10 баллов (35 человек), а также в данную группу были включены умершие в острый период заболевания (7 человек).
Выжившие к 21 суткам по уровню бытовой активности и повседневной жизнедеятельности (шкала Бартела) также были разделены на три группы:
Группа А (112 человек) включала больных с оценкой нарушения функций от 100 до 70 баллов – легкой социальной зависимостью;
Группа В (44 человек) - пациенты, у которых нарушение функций оценивалось от 70 до 50 баллов – умеренной социальной зависимостью;
Группа С (22 человек) – больных с оценкой нарушения функций менее 50 баллов – выраженной социальной зависимостью.
Исследование общего анализа крови проводили на автоматическом гематологическом анализаторе (Pentra 120, Франция) в момент поступления пациентов. В мазке крови, окрашенном азуром и эозином унифицированным методом Романовского, определяли ЛЭА, ЭТА и ЛейТА по методу, разработанному Д.И. Бельченко [1]. У части больных межклеточная адгезия исследовалась методом проточной цитофлюорометрии на анализаторе Cytomics FC 500 («Beckman Coulter», США) по оригинальной методике. Для этого венозную кровь забирали в пробирку «Vacuette» (Austria), содержащую 3,8% цитрата натрия объемом 4,5 мл. Для выявления субпопуляций клеток периферической крови были использованы моноклональные антитела различной специфичности к антигенам CD41, CD62P, CD45, CD14, CD235a (рис. 1, 2). Регистрировали суммарно не менее 1000000 событий. Данные анализировали с помощью программы CXP Cytometer («Beckman Coulter», США).
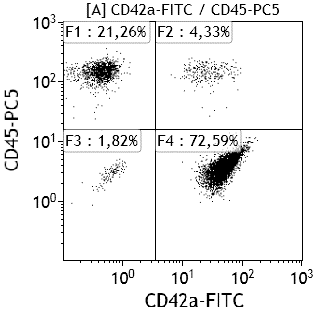
Рис. 1. Лейкоцитарно-тромбоцитарная адгезия (квадрат F2 CD45+CD42a+).
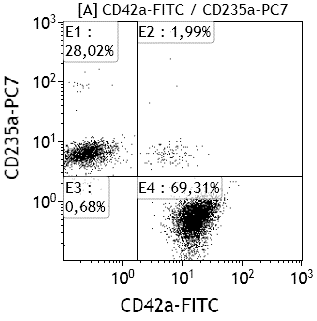
Рис. 2. Эритроцитарно-тромбоцитарная адгезия (квадрат Е2 CD235a+CD42a+).
Статистическую обработку полученных данных проводили с помощью программ Microsoft Excel 2003, Statistica 6,1 (StatSoftInc., USA). Перед началом анализа вариационные ряды тестировались на нормальность методом асимметрии и эксцессов. Для описательной статистики вычисляли медиану, 25 и 75 процентили. При сравнении двух несвязанных групп использовался критерий Манна-Уитни. Статистически значимыми считали различия при р<0,05.
Результаты и обсуждение. В ходе исследования методом световой микроскопии в крови больных инсультом зарегистрировано многократное увеличение межклеточных агрегатов в сравнении с этими же показателями у наблюдаемых контрольной группы. Так степень ЛейТА возрастала в 4,4, а количество ЭТА увеличивалось в 2,5 раза. При использовании проточной цитофлюорометрии обнаружены все интересующие нас агрегаты и выявлена та же тенденция – у больных ишемическим инсультом образование ЛейТА, ЭТА идет значительно интенсивнее, чем в крови здоровых людей. Причем данные, полученные методом световой микроскопии и проточной цитофлюорометрии, оказались сопоставимы (p>0,05) с некоторой разницей: сравнительно больше абсолютное значение ЛейТА при микроскопии и ЭТА при проточной цитофлюорометрии (табл. 1).
Таблица 1. Сравнительная оценка агрегационной активности форменных элементов крови, полученной методом проточной цитофотометрии и световой микроскопии
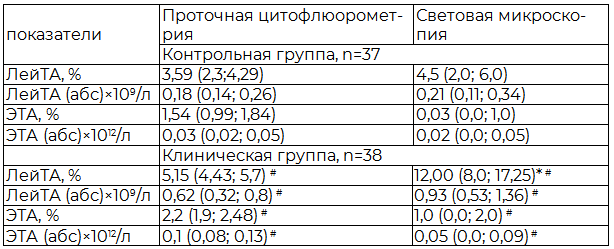
Примечание: (U-тест) * - р<0,05 – достоверность различий между различными методами исследования; # - р<0,05 – достоверность различий между клинической и контрольной группами.
Известно, что адгезия лейкоцитов является важнейшей функцией, обеспечивающей их взаимодействие с эндотелием и другими клетками крови [7]. В физиологических условиях тромбоциты и лейкоциты агрегируют между собой в незначительном количестве [6]. Однако при острых сосудистых катастрофах из-за выброса большого количества цитокинов на фоне эндотелиальной дисфункции происходит активация тромбоцитов, моноцитов и гранулоцитов периферической крови, причем, чем обширнее повреждение органов-мишеней, тем большее количество клеток вступает во взаимодействие [9]. В нашем исследовании количество ЛейТА в первые сутки заболевания у больных ишемическим инсультом более чем в 5 раз превышало аналогичный показатель в контрольной группе, причем, чем тяжелее протекал инсульт, тем большее число коагрегатов было зарегистрировано: 1,44×109/л при легком течении и 1,64×109/л при тяжелом течении ОНМК (р<0,05) (табл. 2).
Таблица 2. Показатели ЛЭА, ЛейТА и ЭТА в крови у пациентов в 1 сутки от начала заболевания в зависимости от степени тяжести ишемического инсульта (Me; 25-й; 75-й процентили)
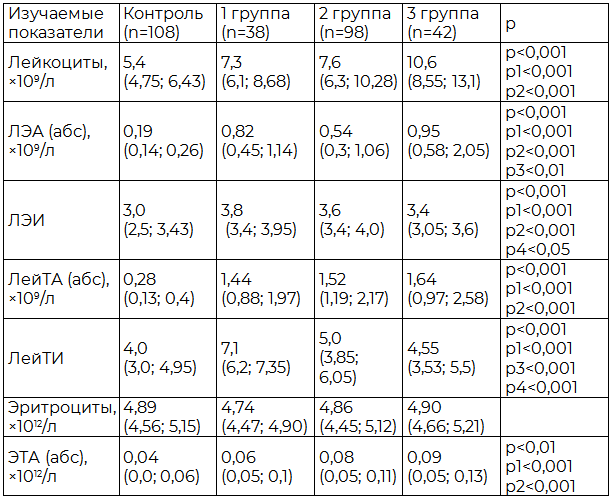
Примечание: (U-тест) статистическая значимость различий: р – между группой контроля и 1 группой, р1 – между группой контроля и 2 группой, р2 – между группой контроля и 3 группой, р3 – между 1 и 2 группой; р4 – между 1 и 3 группой.
При оценке этого же показателя в контексте степени социальной адаптации к 18-21 дню от начала инсульта, отмечена та же тенденция: у пациентов с минимальной социальной и бытовой зависимостью к 21 суткам от начала заболевания в первые сутки зарегистрировано наименьшее количество ЛейТА – 1,23×109/л.
У больных которые к концу острого периода болезни имели выраженную неврологическую симптоматику, делавшую их глубоко социально зависимыми, число агрегатов было более значительным - 1,57×109/л, р<0,05 (табл. 3). Также в процессе исследования выявлено, что при ОНМК в сравнении с контролем количество адгезированных тромбоцитов к одному лейкоциту несколько больше (р<0,05).
Отмечена некоторая особенность взаимодействия: чем тяжелее инсульт и минимальный реабилитационный потенциал в будущем, тем меньшее количество тромбоцитов присоединялось к одному лейкоциту, то есть индекс адгезии падал в сравнении с данными у пациентов с легким течением инсульта (табл. 2, 3).
Таблица 3. Показатели ЛЭА, ЛейТА и ЭТА в крови в первые сутки заболевания у больных ишемическим инсультом с разным исходом заболевания (Me; 25-й; 75-й процентили)
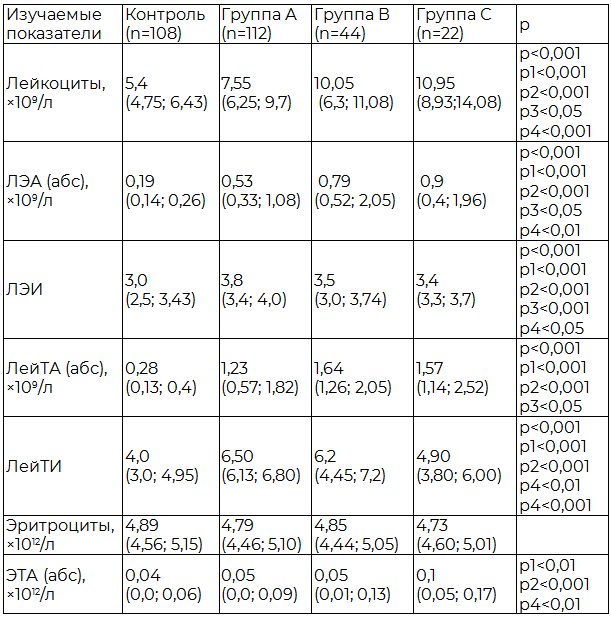
Примечание: (U-тест) статистическая значимость различий: р – между группой контроля и группой А, р1 – между группой контроля и группой В, р2 – между группой контроля и группой С, р3 – между группой А и группой В; р4 – между группой А и группой С.
Образование лейкоцитарно-тромбоцитарных агрегатов (ЛейТА) является важным звеном механизма, обеспечивающего миграцию белых клеток крови в зону повреждения и развитие там иммунных и репаративных процессов [7]. Кроме этого, лейкоцитарно-тромбоцитарная агрегация объединяет тромбообразование и воспаление – два компонента ответа организма на повреждение. Однако не следует забывать, что агрегация тромбоцитов и нейтрофилов, образование микротромбов наряду с набуханием клеток эндотелия и вазоконстрикцией вызывают резкое снижение перфузии микрососудов реперфузируемой зоны, вплоть до ее прекращения: «феномен невозобновления кровотока» (no-reflow) [4]. По мнению авторов, способность присоединять тромбоциты зависит в большинстве случаев от функциональной активности лейкоцитов, так нестимулированные нейтрофилы препятствуют и подавляют стимуляцию кровяных пластинок [4,7]. Однако, прежде всего, следует отметить, что интенсивность адгезии тромбоцитов к лейкоцитам коррелирует со сдвигами в системе гемостаза и тяжестью сосудистых заболеваний. Кооперация между тромбоцитами и нейтрофилами – самыми многочисленными участниками ЛейТА, регулируется хемокинами, цитокинами, факторами роста и производными радикалов кислорода, концентрация которых значительно увеличена при мозговом инсульте. Интересным представляется то, что лейкоциты, преимущественно нейтрофилы и моноциты, не только присоединяют к себе тромбоциты, но и фагоцитируют их. Можно предположить, что подобный механизм является одной из приспособительных реакций, направленных на ликвидацию сладжей при развитии ДВС-синдрома [7]. В нашем исследовании факт уменьшения количества адгезированных тромбоцитов (депрессия) с утяжелением инсульта можно объяснить этим феноменом, а также более быстрым выходом из кровотока в ткани наиболее активированных лейкоцитов, а значит и адгезирующих большое количество тромбоцитов.
Одним из свойств лейкоцитов является не только способность адгезировать на своей поверхности кровяные пластинки, но и образовывать агрегаты с эритроцитами (ЛЭА). Установлено, что у здоровых людей в капиллярной крови содержание ЛЭА в среднем соответствует 0,75±0,11% (по отношению к общему числу лейкоцитов), у больных эссенциальной гипертонической болезнью оно составляет 15,0±0,8%, а при сахарном диабете 2 типа до 31,5±1,07% [9]. В десятки раз может возрастать содержание агрегатов при неотложных состояниях, когда в процессе образования ЛЭА участвует от 8 до 30% всех лейкоцитов [2]. Одновременно с адгезией может происходить и экзоцитарная дегрануляция лейкоцитов [11], приводящая к освобождению литических ферментов и активных форм кислорода, обладающих деструктивными свойствами и способных осуществить экзоцитарный лизис клеток-мишеней [3]. Не вызывает сомнения, что вступать во взаимодействие с эритроцитами способны лишь активированные лейкоциты экспрессирующие тканевой фактор [6]. За последние годы показано, что резкое увеличение в крови ЛЭА является неблагоприятным признаком, способствующим нарушению микроциркуляции, так как агрегаты капиллярной крови представляют собой плотные соединения нейтрофилов или моноцитов с тремя и более эритроцитами. При этом ЛЭА, образуемые нейтрофилами, имеют диаметр 23-27 мкм, а моноцитами – даже 26-35 мкм, что более чем в 2-3 раза шире самого широкого капилляра [2]. В ходе нашего исследования образование ЛЭА у больных ОНМК в сравнении со здоровыми увеличивалось в 3-5 раз, причем, чем легче протекал ишемический инсульт, тем меньшее количество агрегатов нами зарегистрировано (табл. 2). Та же тенденция была отмечена и при оценке социальной адаптации больных к концу 3 недели заболевания – чем хуже прогноз заболевания, тем большее количество ЛЭА формируется в первые сутки болезни (табл. 3). Снижение количества присоединенных эритроцитов к одному лейкоциту при тяжелом течении инсульта, вероятно, связано с высоким потреблением высокоадгезирующих лейкоцитов, а также большим их диаметром и, соответственно, неспособностью проходить узкие капилляры.
В активации тромбоцитарного звена гемостаза существенную роль играет взаимодействие эритроцитов с тромбоцитами и образование эритроцитарно-тромбоцитарных агрегатов [8]. Исследованиями установлено, что в норме в венозной крови лишь незначительное число тромбоцитов способно присоединяться к эритроцитам. Свойство эритроцитов образовывать агрегаты зависит от гемодинамических, плазменных, электростатических, механических, мембранных и других причин [7,8,10]. Нативные эритроциты не взаимодействуют с другими циркулирующими клетками крови и сосудистой стенкой при нормальных условиях, что свидетельствует о недоступности их молекул адгезии к своему лиганду, но в условиях патологии, например у больных ишемической болезнью сердца (ИБС), эта реакция протекает особенно интенсивно с присоединением к эритроциту от 1 до 4 тромбоцитов [3,10]. Наличие ЭТА связано с высоким риском развития тромботических осложнений. Так, образование ЭТА приводит к дальнейшей активации тромбоцитов и увеличению проагрегантной активности внеклеточной среды в результате освобождения из этих клеток биологически активных субстанций, таких как тромбоксан А2 и АДФ. Кроме этого, активированные тромбоциты выделяют литические ферменты, протеазы, агрессивные белки, цитотоксические свободные радикалы. Это и приводит к деструкции эритроцитов в местах их контакта с тромбоцитарными агрегатами, то есть их экзоцитарному лизису, вызывая запуск прокоагулянтной активности красных кровяных телец [3]. Образование ЭТА также может приводить еще и к дополнительному повышению активации и агрегации свободных тромбоцитов и ухудшению реологии крови за счёт затруднительного прохождения таких структур через капилляры, а также способствовать атеротромботическому и пролиферативному процессам в сосудистой стенке [11]. В ходе нашего исследования выявленное количество ЭТА у больных инфарктом мозга незначительно превышало контрольные значения, как, скажем ЛейТА и ЛЭА, однако наблюдалась все та же тенденция – чем тяжелее протекал инсульт, тем больше агрегатов нами зарегистрировано без изменения количества эритроцитов в гемограмме (табл. 2).
Заключение. Таким образом, в ходе нашего исследования описанные методы определения агрегационной активности форменных элементов крови: первый рутинный, экономически выгодный и второй высокотехнологичный, но менее доступный в общеклинической практике показали практически одинаковую результативность. Зарегистрировано усиление степени межклеточного взаимодействия, приводящее к увеличению количества межклеточных агрегатов в кровотоке у больных ишемическим инсультом уже в первые сутки от начала заболевания. Отмечено клинико-прогностическое значение этого феномена – чем больше образуется агрегатов, тем тяжелее протекает инсульт и хуже социальная адаптация в будущем. Вероятно, чрезмерную генерацию межклеточных агрегатов в циркулирующей крови можно рассматривать наряду с прочими факторами, участвующими в развитии нарушений микроциркуляции и гемостаза, которые является одними из ведущих патогенетических механизмов ишемических инсультов и вторичных ишемических расстройств.
