Введение
В последнее время исследователей интересует вопрос о влиянии избыточного уровня глюкокортикоидов (глюкокортикоидная нейротоксичность) на функционирование нейронов головного мозга в условиях острого нарушения мозгового кровообращения (ОНМК) [1]. Нейроактивная роль стероидных гормонов связана с их воздействием на структуру и функции центральной нервной системы, психический статус, поведенческие реакции, обучение и память [2]. Действуя на ткани мозга через собственные внутриклеточные рецепторы, стероидные гормоны играют существенную роль в синаптической передаче нервных импульсов. Не исключена возможность образования стероидных гормонов клеточными структурами самого мозга (нейростероиды) с последующим их воздействием на реализацию процессов высшей нервной деятельности и поведения. Как свидетельствуют литературные источники, любые изменения в балансе глюкокортикоидов имеют морфогенетическое воздействие на функционирование нейронов головного мозга [1].
Закономерным финалом формирования стероидной нейротоксичности является инициация процессов нейроапоптоза. Известно, что последний начинается с разрушения ядра клетки и повреждения дезоксирибонуклеиновой кислоты (ДНК), поэтому наличие фрагментированной ДНК является маркером апоптоза [6]. Максимального пика нейроапоптоз достигает в тех участках головного мозга, которые имеют минимальное кровоснабжение, например в условиях ишемии-реперфузии (ИР). Реперфузия инфаркт-зависимого сосуда приводит к полному или частичному восстановлению кровоснабжения, что позволяет поддерживать синтез АТФ на уровне, достаточном для реализации процессов апоптоза.
Уменьшение уровня стероидов в структурах головного мозга в условиях церебральной ишемии коррелирует с торможением процессов нейроапотоза и сопровождается сохранением цитоархитектоники нервной ткани [1, 2].
Дополнительным фактором, который значительно усугубляет течение ОНМК, является развитие цереброкардиального синдрома. Известно, что сердце и головной мозг являются взаимосвязанными органами-мишенями сосудистой патологии, клинические варианты которой (ишемическая болезнь сердца и церебральный инсульт) являются лидерами в структуре смертности многих стран [10]. Кроме высокой летальности, обе группы объединяет значительное количество общих факторов развития и подобность патогенетических механизмов. В условиях тяжелого ОНМК происходит поражение миокарда, которое связано, с одной стороны, с потерей центральных механизмов влияния мозга на трофику миокарда, а с другой– автономным гипоксическим поражением кардиомиоцитов.
Как основу для создания препарата с модулирующим воздействием на процессы формирования стероидной нейротоксичности, наше внимание привлекли производные 3,2'-спиро-пирроло-2-оксиндола, которые были синтезированы под руководством к.фарм.н., старшего научного сотрудника Института проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины Редькина Р.Г. По результатам виртуального скрининга, одно из этих веществ (соединение R-86), проявляет свойства ингибитора фермента 11-β-гидроксистероиддегидрогеназы 1-го типа (11β-HSD1), который в отличие от изоформы второго типа катализирует как 11β-дегидрирование, так и обратную окислительно-восстановительную реакцию, превращая более активный кортизон в кортизол и наоборот. Учитывая тот факт, что при этом соединение R-86 обладает антигипоксическими свойствами, способствует снижению летальности животных с ОНМК, уменьшает степень выраженности неврологического дефицита, а также наличие у него кардиопроекторных свойсв [3-5; 11], есть основания для углубленного изучения его модулирующего воздействия на уровень кортизола и активность нейроапоптоза как возможного механизма защитного действия на головной мозг и миокард в условиях ишемического инсульта.
Цель
Оценить корригирующее влияние соединения R-86 на динамику уровня кортизола в церебральном сосудистом бассейне, кардиогемодинамические изменения и степень фрагментации ДНК ядер нейронов при модельном инсульте как возможные проявления его нейро- и кардиоропротекторного действия.
Материалы и методы
Нейрокардиоротекторные свойства производного 3,2'-спиро-пирроло-2-оксиндола (соединение R-86) изучали у 77 крыс линии Вистар и 24 монгольських песчанках (гербелах) соответственно на моделях билатеральной каротидной окклюзии (БКО) и ишемии-реперфузии (ИР).
Анализируя литературу, освещающую особенности реализации различных механизмов нейрональной смерти при острой церебральной ишемии, и результаты собственных исследований, мы пришли к выводу, что именно модель ИР у гербел целесообразно использовать для изучения апоптоз-модулирующих свойств перспективных нейропротекторов, а также для исследования эффективности церебропротекторов при проведении реканализации в условиях ОНМК [5-7].
БКО выполняли под пропофоловым наркозом (60 мг/ кг внутрибрюшинно (в/б)), путем лигирования обеих внутренних сонных артерий у крыс, используя хирургический доступ на передней поверхности шеи разрезом через ее белую линию. ИР у гербел моделировали аналогично методике БКО с той лишь разницей, что лигирование внутренней сонной артерии длительностью 60 мин проводили на одной стороне. После снятия лигатуры кровоток через артерию восстанавливался самостоятельно через несколько секунд [5, 7].
В качестве препарата сравнения использовали цитиколин («Сомазина» Ferrer Snternational, S.A., Испания) в рекомендованной для доклинических исследований дозе 250 мг/кг в/б [8].
Экспериментальную терапию острой церебральной ишемии соединением R-86 и цитиколином начинали через 1 час после моделирования патологи, продолжая введение с частотой один раз в сутки в течение 21 дня при БКО и 4 дней в случае ИР.
Производное 3,2'-спиро-пирроло-2-оксиндола (соединение R-86) изучали в условно-эффективной дозе 10 мг/кг внутрижелудочно (в/ж) – доза, которая по результатам предыдущих исследований обеспечивает максимальный антигипоксический, церебро- и кардиопротекторный эффекты соединения R-86 [4; 5; 11].
Животным группы контрольной патологи вводили 0,9% раствор NаСІ из расчета 2 мл/кг в/б. Ложнооперированным животным выполняли все вмешательства (наркоз, разрез кожи, препарирование сосудов, подведение лигатур) за исключением перевязки сосудов, что нивелировало влияние наркоза и хирургической травмы.
Все животные были разделены на группы соответственно по 7 (крысы) и по 6 (гербелы) особей. В условиях БКО первая группа животных – интактные, вторая и третья – ложнооперированные крысы, которым вводили 0,9% р-р NаСІ и соединение R-86, четвертая, пятая и шестая – животные, которым на фоне модельного ОНМК вводили 0,9% р-р NаСІ (группа контрольной патологии), соединение R-86 и цитиколин. При ИР первая группа – ложнооперированные гербелы, вторая, третья и четвертая группы – животные, которым в постреперфузионном периоде вводили соответственно 0,9% р-р NаСІ (контрольная патология), соединение R-86 и цитиколин.
В соответствующие сроки (4 и 21 сутки ОНМК) для определения уровня кортизола у крыс путем пункции сагиттального синуса брали пробы крови (0,2-0,4 мл). Содержание кортизола измеряли методом твердофазного иммуноферментного анализа с использованием набора CORTISOL KIT (Германия) на приборе фирмы “Hipson” (Чехия).
Для выяснения влияния курсового введения соединения R-86 на синтез стероидов у животных без церебральной ишемии дополнительно изучали динамику его уровня у ложнооперированных крыс в аналогичные периоды.
Фрагментацию ДНК в ядрах нейронов лобных долей коры головного мозга гербел на 4 сутки после ишемии-реперфузии исследовали методом проточной цитометрии [6; 12]. Для получения суспензии ядер к ткани добавляли СуStain DNA фирмы Partec (Германия) согласно инструкции производителя. Использовали одноразовые фильтры CellTrics 50 мкм (Partec, Германия). Ядерные суспензии биоптатов коры лобных долей головного мозга гербел готовили сразу после забора материала и промывки холодным (+4..+8 оС) фосфатно-солевым буфером рН 7,4 (Sigma). Исследования проводили на проточном цитометре «Partec РАS» фирмы Partec, Германия. Для возбуждения флуоресценции метки ядерной ДНК – диамидинофенилиндола – использовали ультрафиолетовую лампу. Из каждого образца ядерной суспензии проводился анализ 10 тыс. событий. Проточный анализ фрагментации ДНК выполнялся с помощью программного обеспечения FloMax (фирма Partec, Германия) путем выделения Sub-G1 участков на ДНК-гистограммах.
Критериями развития кардиоцеребральной дисфункции и эффективности экспериментальной терапии гербел с ИР были изменения амплитуды сегмента ST, а также артериального и центального венозного давления (соответственно АД и ЦВД) и давления в левом желудочке (ДЛЖ), которые измеряли соответственно в бедренной артерии, правом и левом желудочках сердца с помощью флоуметра Transonik Animal Research Floowmeters Т-106 Sегіеs датчиком Ргеssure Тгаnsduсеr (USА) [9].
Все эксперименты проводили с разрешения этического комитета Винницкого национального медицинского университета им. Н.И. Пирогова, который на основании решения Ученого совета относительно гуманности и этичности проведения запланированных исследований по данной теме (протокол № 1 от 29.09.2011) постановил (протокол № 2 от 31.01.2013), что материалы рассматриваемой научной работы не противоречат приказу Министерства Здравоохранения Украины № 281 от 01.11.2000 «О гуманном обращении с животными».
Статистическую обработку результатов проводили с помощью программы Statistika 6.0. Использовали параметрический критерий t Стьюдента в случае нормального распределения данных, непараметрический критерий W Уайта – при его отсутствии. Различия считали статистически достоверными при р<0,05.
Результаты и их обсуждение
Оперативное вмешательство (наркоз, разрез кожи, препарирование сосудов, подведение лигатур) сопровождалось ростом уровня кортизола относительно интактных животных (им не выполняли никаких травматических манипуляций), о чем свидетельствовало сохранение его повышенного титра (в среднем на 33,6 %) даже на 4 сутки после операции (р<0,05). Этот эффект можно объяснить стрессовой реакцией животных на травму и представляет собой закономерное явление раннего послеоперационного периода.
В дальнейшем (21 сутки эксперимента), отмечалась нормализация уровня исследуемого гормона, и его содержание в крови не отличалось от такового у интактных крыс (табл.1).
Учитывая тот факт, что уровень кортизола определяли в плазме крови сагиттального синуса головного мозга, можно с определенной уверенностью утверждать о формировании стероидной нейротоксичности при модельной церебральной ишемии.
Таблица 1. Влияние производного 3,2'-спиро-пирроло-2-оксиндола (соединение R-86) и цитиколина на динамику уровня кортизола (нг/мл) в венозной крови сагиттального синуса головного мозга крыс с билатеральной каротидной окклюзией (M±m, n=7)
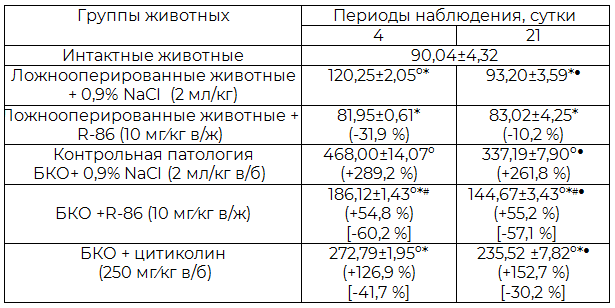
Примечания: БКО – билатеральная каротидная окклюзия; в/б – внутрибрюшинно; в/ж – внутрижелудочно; º - р<0,05 относительно интактных животных; * - р<0,05 относительно животных группы контрольной патологии в соответствующие сроки наблюдения; # - р<0,05 относительно цитиколина; ● - р<0,05 относительно 4 суток в соответствующей экспериментальной группе; в круглых скобках – динамика в процентах относительно группы ложнооперированных животных в соответствующий период наблюдения; в квадратных скобках – динамика в процентах относительно группы контрольной патологии в соответствующие сроки наблюдения.
Полученные данные сопоставляются с результатами других исследователей, которые изучали динамику уровня кортизола не только в различные периоды острой церебральной ишемии, но и при развитии нейродегенеративных заболеваний. Повышение уровня глюкокортикоидов имеет морфогенетическое воздействие на функционирование нейронов головного мозга. В частности, с высоким уровнем кортизола при ОНМК коррелирует уменьшение плотности нейронов гиппокампа, что сопровождается инициацией процессов нейроапоптоза, развитием тяжелого неврологического дефицита, нарушением мнестических функций и высокой летальностью [1, 2].
Курсовая терапия животных с ОНМК производным 3,2'-спиро-пирроло-2-оксиндола (соединение R-86) в дозе 10 мг/кг в/ж, подобно цитиколину (250 мг в/б), сопровождалось менее интенсивным увеличением уровня кортизола. Так, спустя 96 ч его содержание в плазме крови сагиттального синуса мозга крыс с БКО уменьшилось относительно группы контрольной патологии в среднем соответственно на 60,2% та 41,7%, а спустя 21 сутки соответственно на 57,1% та 30,2% (р<0,05).
Подобное действие исследуемых соединений может указывать на наличие у них позитивного модулирующего воздействия на развитие стероидной нейротоксичности. Причем, если у цитиколина подобный эффект развивается опосредованно и обусловлен нейроцитопротекторными свойствами, то у соединения R-86 он, по всей видимости, прямо связан со способностью угнетать активность фермента 11β-HSD1. Это предположение подтверждается и тем фактом, что по способности снижать уровень исследуемого гормона в остром и восстановительном периодах ОНМК соединение R-86 достоверно превышает цитиколин соответственно в 1,46 и 1,62 раза.
Корригирующее действие соединения R-86 на баланс стероидов в головном мозге животных с острой церебральной ишемией может указывать на способность предупреждать развитие деструктивных изменений в ишемизированном мозге, способствовать сохранению структурной целостности нейронов, и как следствие, уменьшать очаг ишемии и зону пенумбры.
Следует отметить, что подобный эффект производного 3,2'-спиро-пирроло-2-оксиндола одинаково проявился как в остром, так и восстановительном периоде ишемии. Антистероидный эффект соединения R-86 при ОНМК может быть одним из ведущих в реализации его церебропротекторных свойств. Важно также то, что исследуемое соединение снижает только повышенный уровень кортизола и его титр не отличается от физиологического даже при курсовой терапии.
Исследование апоптоз-модулирующего действия соединения R-86 в условиях модельной ИР у гербел показало, что в группе контрольной патологи фрагментация ДНК в ядрах нейронов лобных долей коры головного мозга через 96 ч после моделирования патологи достоверно увеличилась в 2,15 раза (табл. 2).
Это может свидетельствовать об интенсивном формировании очага ишемической полутени (пенумбры) за счет тех нейронов, которые пребывают в состоянии апоптотической смерти.
Таблица 2. Влияние производного 3,2'-спиро-пирроло-2-оксиндола (соединение R-86) и цитиколина на фрагментацию ДНК в ядрах нейронов лобных долей коры головного мозга гербел с острым нарушением мозгового кровообращения с последующей реперфузией (М±m, n=6)
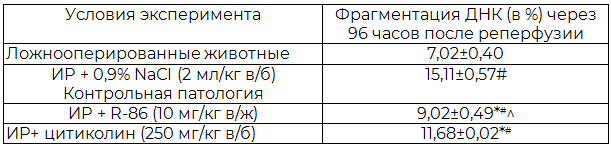
Примечания: ИР – ишемия-реперфузия; в/б – внутрибрюшинно; в/ж – внутрижелудочно * – р<0,05 относительно показателя ложнооперированных крыс; # – р<0,05 относительно показателя контрольной патологии; ^ – p<0,05 относительно показателя группы цитиколина.
Терапия гербел с острой церебральной ишемией производным 3,2'-спиро-пирроло-2-оксиндола достоверно лучше, чем лечение цитиколином, снижало фрагментацию ДНК ядер нейронов относительно группы контрольной патологии, что свидетельствует о наличии церебропротекторных свойств. По величине антиапоптотического действия соединение R-86 превосходит референс-препарат в среднем на 22,8% (p<0,05).
Редукция адаптационных возможностей головного мозга к воздействию ишемического фактора, ведет к прямой зависимости церебрального кровотока от эффективной работы сердца, основными характеристиками работы которого являются АД, ЦВД, ДЛЖ и амплитуда сегмента ST. Поэтому, было целесообразным исследовать наличие корригирующего воздействия производного 3,2'-спиро-пирроло-2-оксиндола соединения R-86 на показатели центральной гемодинами и функциональной активности миокарда, как факторов, которые обеспечивают нормальное кровоснабжение головного мозга в постреперфузионный период.
Таблица 3. Влияние соединения R-86 и цитиколина на проявления цереброкардиальной дисфункцииа в острый постреперфузионный период модельного ОНМК (М±m, n=6)
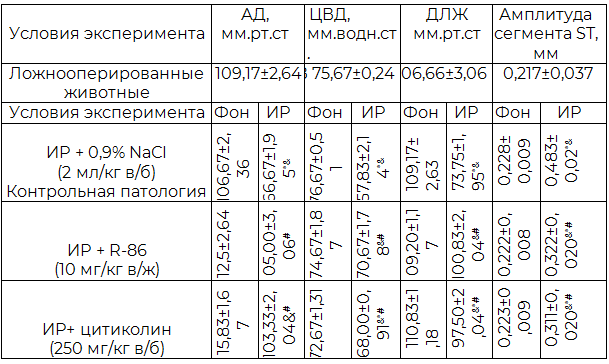
Примечания: ИР – ишемия-реперфузия; ЦВД – центральное венозное давление; * – р<0,05 относительно определенного показателя группы ложнооперированных животных; # – р<0,05 относительно определенного показателя группы контрольной патологии; & – р<0,05 относительно фонового уровня (фона).
Проведенное исследование показало, что в группе контрольной патологи, постреканализационный период сопровождался формированием кардиоцеребральной дисфункции, о чем свидетельствовало достоверное относительно ложнооперированных животных уменьшения уровней АД, ЦВД и ДЛЖ в среднем соответственно на 38,9%, 22,6%, 30,9% и увеличение амплитуды сегмента ST на 22,6%. Эти результаты свидетельствуют о формировании у гербел сразу же после ИР лево- и правожелудочковой недостаточности, а также острого коронарного синдрома.
Терапевтическое введение монгольським песчанкам соединения R-86 на протяжении первых 4-х дней постреперфузионного периода острой церебральной ишемии, более полноценно, по сравнению с цитиколином, препятствовало формированию кардиоцеребрального синдрома. Об этом свидетельствовало, в отличие от цитиколина, отсутствие достоверных различий исследуемых показателей не только с фоновыми значениями, но и с соответствующими значениями у ложнооперированных животных.
Таким образом, всесторонний анализ полученных результатов указывает на перспективность углубленного исследования нейропротекторного действия производного 3,2'-спиро-пирроло-2-оксиндола (соединение R-86) на предмет создания церебропротекторного перепарата с принципиально новыми возможностями воздействия на главные клеточные патогенетические звенья ишемического каскада (модулирующее действие на стероидную нейротоксичность и нейроапоптоз). Отмеченные свойства у исследуемого производного 3,2'-спиро-пирроло-2-оксиндола при энтеральном введении расширяют круг его возможного использования не только в различные периоды ОНМК, но и при хронической церебровоскулярной патологии и тех нейродеструктивных заболеваниях ЦНС, патогенез развития которых непосредственно связан с длительно существующим повышенным уровнем кортизола в структурах головного мозга (болезнь Альцгеймера). Антинейроапоптотические эффекты соединения R-86, а также наличие у него модулирующего действия на формирование кардицеребральной дисфункции, указывают на целесообразность его углубленного изучения в качестве нейро- и кардиопротектора в раннем постреперфузионном периоде ишемического инсульта на фоне тромболитической терапии. Отдельным, не менее перспективным направлением наших дальнейших научных разработок является углубленное изучение кардиопротекторных свойств соединения R-86 при острой кардиальной ишемии, например, в условиях экспериментального инфаркта миокарда.
Заключение
Острое нарушение мозгового кровообращения у крыс и модельная церебральная ишемия-реперфузия у гербел сопровождается значительным (почти четырехкратным) увеличением уровня кортизола в крови сагиттального синуса головного мозга крыс и двукратным возрастанием фрагментации ДНК ядер нейронов лобных долей монгольских песчанок. Полученные данные свидетельствует о формировании стероидной нейротоксичности и развитии нейродеструктивных изменений в условиях церебральной ишемии. Кроме того, исследование показателей центральной и кардиальной гемодинамики показало, что постреперфузионный период ОНМК осложняется формированием кардиоцеребральной дисфункции.
Оригинальное производное 3,2'-спиро-пирроло-2-оксиндола (соединение R-86), достоверно лучше цитиколина способствует нормализации титра кортизола при ишемическом инсульте и уменьшению маркера нейроапоптоза (фрагментации ДНК ядер нейронов) в постреперфузионном периоде. По степени корригирующего влияния на уровень кортизола в крови сагиттального синуса крыс с БКО соединение R-86 как в остром, так и в восстановительном периоде инсульта превосходит цитиколин соответственно в 1,46 и 1,62 раза. При экспериментальной ИР, исследуемое соединение по антинейроапоптотическому эффекту также достоверно превосходит референс-препапарат в среднем на 22,8%. Также использование соединения R-86, более эффективней цитиколина препятствует формированию кардиоцеребральной дисфункции.
Таким образом, соединение R-86 можно считать перспективным церебро- и кардиопротектором протектором, механизм защитного действия которого связан с блокированием стероидной нейротоксичности, антинейроапоптотическим эффектом и улучшением кардиогемодинамических параметров.
