Введение. С каждым годом в нашей стране наблюдается рост заболеваемости и высокая смертность от инсульта, частота которого зависит от возраста, пола, региона проживания, и варьирует от 12 случаев на 100 тысяч (среди женщин 30-49 лет) до 809 случаев на 100 тысяч населения (среди мужчин в возрасте 70-74 лет) [5]. Высокая инвалидизация и смертность при остром нарушении мозгового кровообращения (ОНМК) влечет за собой не только медицинскую, но и экономическую проблему, поэтому интерес к изучению патогенеза острых мозговых катастроф не только не уменьшается, но и поддерживается на достаточно высоком уровне. В частности, в последнее время большое внимание уделяется участию толл-рецепторов в формировании зоны инфаркта мозга [4,10]. Толл-подобные рецепторы (англ. Toll-like receptor, TLR; от нем. toll — замечательный) — класс клеточных рецепторов с одним трансмембранным фрагментом, которые распознают консервативные структуры микроорганизмов и активируют клеточный иммунный ответ. Эти рецепторы представлены на клетках разного типа – от эпителиальных до иммунокомпетентных и несмотря на ассоциацию с клеточным иммунитетом, участвуют в неспецифической резистентности организма и модулируют воспалительные реакции [4,7,8]. Функциональный полиморфизм генов толл-рецепторов, реализует свое действие на начальных этапах воспаления, на характере протекания защитных реакций и предрасположенности к ряду заболеваний [1,4,6,9]. До настоящего момента в литературе недостаточно данных комплексного исследования толл-рецепторов, в том числе и их генетического полиморфизма у больных ишемическим инсультом, что повышает интерес к изучению роли данных белков в патогенезе ОНМК.
Цель исследования. Сравнить частоту генотипов и аллелей генетического полиморфизма TLR2(Arg753Gln), TLR3(Phe412Leu), TLR4(Asp299Gly), TLR6(Ser249Pro) и TLR9(T–1237C) среди относительно здоровых людей и больных ишемическим инсультом. Оценить степень экспрессии TLR2, TLR4 на моноцитах и уровень маркера активации TLR2, TLR4 у больных мозговым инсультом в острый период заболевания (9-10е сутки), в том числе и с учетом носительства выявленных генотипов и аллелей.
Материалы и методы. Нами обследовано 128 пациентов обоих полов в возрасте 52±5,4 лет, находящихся на лечении в стационарах г. Чита с диагнозом ишемический инсульт. Критериями отбора больных в исследуемую группу явились наличие объективно доказанного (методами нейровизуализации) ОНМК и отсутствие в анамнезе онкологических и гематологических заболеваний, инфекционных заболеваний и другой острой соматической патологии (инфаркт миокарда). Степень тяжести заболевания определяли с помощью шкалы NIHSS (шкала инсульта Национального института здоровья). Клиническая группа была разделена на 2 подгруппы: 1-ая подгруппа включала больных с легкой степенью тяжести инсульта (0-5 баллов по шкале NIHSS, n=12), 2-ая – со средней и тяжелой степенью тяжести заболевания (5-20 баллов по шкале NIHSS, n=15). Контрольную группу составили 113 относительно здоровых резидентов обоих полов, не имеющих признаков цереброваскулярной патологии, средний возраст которых составил 43±5,4 лет (р<0,05). Представители клинической и контрольной групп являлись жителями Забайкальского края. У всех обследуемых было получено информированное согласие на участие в исследовании. Работа одобрена ЛЭК (протокол №30 от 9.11.2011 г.).
Материалом для молекулярно-генетического анализа (PCR-Ef) служили образцы ДНК, выделенные из лейкоцитов периферической венозной крови. Амплификацию проводили в термоциклере «Бис-М110» (ООО «Бис-Н», Новосибирск). В работе использовались стандартные наборы НПФ «Литех» (Москва) для исследуемых SNP (Single Nucleotide Polymorphism). Визуализация продуктов амплификации выполнялась в проходящем в ультрафиолетовом свете после электрофореза в 3% агарозном геле с добавлением бромистого этидия.
Степень экспрессии TLR2, TLR4 на моноцитах (у 28 больных в острый период заболевания (9-10 сутки) и 37 респондентов контрольной группы) и уровень маркера активации TLR2, TLR4 (у 19 человек контрольной группы и у 9 человек клинической группы) исследовали мультипараметрическим методом иммунофлюоресцентного анализа. Исследование проводились на проточном цитофлуориметре «Cytomics FC-500» (Beckman Coulter, США) с использованием стандартного протокола.
Статистическая обработка результатов исследования экспрессии и уровня маркера активации TLR2, TLR4 выполнялась с использованием программных пакетов Biostat и Excel 2007. Для определения популяционного равновесия частот аллельных вариантов генов применялся закон Харди-Вайнберга. При сравнении частот аллелей и генотипов по качественному бинарному признаку пользовались критерием χ2. Степень риска развития событий оценивали по величине отношения шансов (odd ratio (OR)) с расчетом для него 95% доверительного интервала (CI). Для сравнения средних величин применялся критерий Манна-Уитни (U-тест) со стандартным отклонением (M±σ). Различия считались статистически значимыми при p<0,05.
Результаты исследования и их обсуждение. В результате молекулярно-генетического исследования обнаружены все искомые мутации в гомо- и гетерозиготном состоянии. Отклонение от равновесия Харди-Вайнберга выявлено для полиморфизма TLR4 (Asp299Gly) (χ2=25,6, р<0,001) и TLR6 (Ser249Pro) (χ2=9,97, р=0,002) у больных инсультом, преимущественно за счет разницы наблюдаемой и ожидаемой гетерозиготности.
Исследуя частоту генотипов и аллелей генетического полиморфизма для TLR3, TLR9, достоверных отличий от группы контроля выявлено не было (табл. 1).
Что касается полиморфизма TLR2(Arg753Gln), TLR4(Asp299Gly), TLR6 (Ser249Pro), то отмечены весьма ощутимые риски развития мозгового инсульта у носителей тех или иных аллелей или (и) генотипов.
Так, у носителей генотипа Arg/ArgTLR2 относительный риск развития инсульта равен 2,41 [CI 95%: 1.33-4.36], для обладателей генотипа Arg/Gln – 0,44[CI 95%: 0,24-0,81], а для Gln/Gln-респондентов – 0,29 [CI 95%: 0,03-2,82].
То есть OR для лиц, имеющих дикий аллель, составляет 2,21[CI 95%: 1,29-3,78], для резидентов, несущих мутантный аллель 0,45[CI 95%: 0,26-0,78]. Таким образом, можно отметить, что носительство мутантного аллеля TLR2(Arg753Gln) обладает протективными, а нормального - предикторными свойствами, если рассматривать в контексте развития острой цереброваскулярной патологии. Кроме этого, у больных отмечается более частое носительство нормального аллеля TLR4(Asp299Gly) - 0,79 против 0,69 в контроле, причем зарегистрировано 1,6 кратное преобладание носительства его в гомозиготном состоянии, гетерозиготное же состояние аллелей встречалось в 4,9 раза реже, чем у обследуемых контрольной группы. Степень риска развития изучаемого заболевания у носителей генотипа Asp/Asp составила 3,63 [CI 95%: 2,11-6,24], у гетерозигот - 0,12 [CI 95%: 0,06-0,23]. Таким образом, у носителей дикого аллеля OR составил 1,72 [CI 95%: 1,14-2,6], для носителей мутантного аллеля – 0,58 [CI 95%: 0,38-0,88].
Как видно из таблицы 1, среди больных значительно чаще встречаются носители Pro/Pro-генотипа полиморфизма TLR6(Ser249Pro), для которых степень риска развития заболевания составляет 2,87 [CI 95%: 1,68-4,89]. Носители дикого аллеля в гомозиготном состоянии преобладают среди здоровых резидентов, OR для развития инфаркта мозга составил 0,56 [CI 95%: 0,30-1,07]. Таким образом, для обладателей нормального аллеля OR равен 0,47 [CI 95%: 0,32-0,68], для носителей мутантного аллеля степень риска развития цереброваскулярной патологии составила 2,15 [CI 95%: 1,46-3,16].
Таким образом, предикторную направленность в отношении ишемического инсульта показали TLR2-753Arg, TLR4-299Asp, TLR6-249Ser аллели. Эта находка во многом объясняется данными литературы, так например, полиморфный маркер -Arg753 ассоциируется с развитием инфекционных процессов, причем именно генотип Arg/Arg ассоциирован с возникновением воспалительной реакции при ряде заболеваний [2], а маркер -299Gly гена TLR4 ассоциирован со снижением иммунного ответа на ЛПС бактерий [2]. В других источниках указано, что существенный вклад в процесс атерогенеза вносит наличие аллеля -299Gly в гене TLR4 [11]. Также Луц Хамманом, Александром Кохом и другими (2013) был изучен полиморфный вариант гена TLR6(Ser249Pro) у лиц кавказкой национальности с ишемической болезнью сердца. Авторы статьи предполагают, что Ser-аллель защищает от атеросклероза [11]. По данным корейских исследователей некоторые SNP в гене TLR6 ассоциированы с ишемическим инсультом в корейской нации, более того влияют на тяжесть инсульта [12].
Таблица 1. Частота аллелей и генотипов TLR2(Arg753Gln), TLR3(Phe412Leu), TLR4(Asp299Gly), TLR6(Ser249Pro), TLR9(T–1237 C) у больных ишемическим инсультом в Забайкальском крае
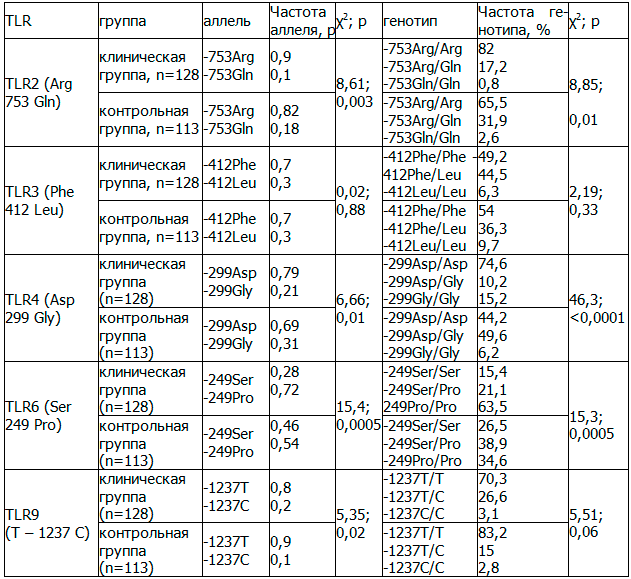
Примечание: χ2; р - статистически значимая разница между клинической и контрольной группами
Таким образом, учитывая, что «TOLL-ы» локализованы не только на клетках иммунной системы, но и на эндотелии, клетках атеросклеротической бляшки, можно прогнозировать, что наличие качественно и функционально измененных TLR2, TLR4, TLR6 рецепторов поддерживает длительное асептическое воспаление сосудистой стенки, прогрессирование атерогенеза и высокую вероятность эмболизации с ее поверхности.
В следующей серии экспериментов нами было рассмотрено влияет ли носительство вышеназванного полиморфизма на уровень маркера активации TLR2, TLR4 в плазме крови и экспрессию TLR2, TLR4 на моноцитах периферической крови, как в условиях нормы, так и во время ишемического инсульта.
Оказалось, что уровень маркера активации как TLR2, так и TLR4 у больных ОНМК был значительно выше, чем у наблюдаемых контрольной группы: 34,5±12,8% и 39±12,6% против 23,1±6,8% и 23,3±5,6% (u, p<0,05). Причем среди больных инсультом легкой степенью тяжести уровень маркера активации TLR2 оказался гораздо выше среднего значения, в пределах 44,7±2,04%, у больных со средней степенью тяжести и тяжелым инсультом (2-я подгруппа) лишь 28,3±2,5% (u, p<0,05). Обратная тенденция прослеживалась в уровне маркера активации TLR4: у испытуемых 1-й подгруппы он составил 36,7±12,6% в то время как у испытуемых 2-й подгруппы – 58,6±15,6% (u, p<0,05).
Степень экспрессии толл-рецепторов также была выше у больных инсультом: TLR2 - 35,7±9,8%, TLR4 - 34,5±12,8%, а у относительно здоровых лиц группы контроля - 22,2±5,7% и 21,3±6,5% соответственно (u, p<0,05). При анализе взаимосвязи носительства различных аллелей изучаемого полиморфизма со степенью экспрессии TLR2, TLR4 отмечено, что как у здоровых исследуемых (в меньшей степени), так и больных инфарктом мозга (в большей степени) носительство аллелей TLR4(Asp299Gly) и TLR6(Ser249Pro) способствует изменению уровня экспрессии, тогда как у обладателей TLR2(Arg753Gln) данные противоречивы. Выявлено, что значительно повышает экспрессию TLR4 на моноцитах у больных инсультом TLR2-753Arg, TLR4-299Gly, TLR6-249Pro аллели, а TLR2-753Arg, TLR4-299Asp, TLR6-249Pro аллели увеличивают экспрессию TLR2, что вполне объясняется ранее проведенными данными [2,3,11] (табл. 2). Известно, что активация и усиление экспрессии TLR влечет за собой множество патофизиологических последствий. В одном из исследований показано, что достоверное усиление экспрессии TLR4 на гранулоцитах, моноцитах и лимфоцитах периферической крови и на клетках воспалительного инфильтрата в носовых полипах ведет к развертыванию иммунного ответа [2]. В другой работе авторы отмечают, что повышение уровня экспрессии TLR2 и TLR4 в сочетании с увеличением локального синтеза lgA может способствовать развитию преимущественно местного воспаления и благоприятному исходу заболевания при урогенитальном хламидиозе у женщин. После лечения нуклеосперматом натрия при патологии шейки матки и эндометрия было зарегистрировано повышение частоты клеток, экспрессирующих TLR4 и TLR9 типов в исследуемом материале, а также снижение количества вируса папилломы человека высокого онкогенного риска [2].
Таблица 2. Взаимосвязь носительства полиморфных вариантов толл-рецепторов со степенью экспрессии TLR2 и TLR4 у больных ишемическим инсультом
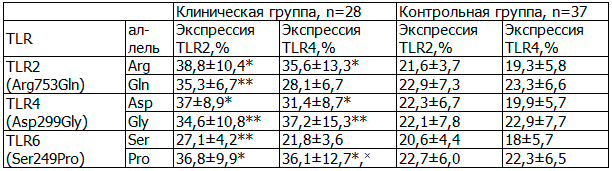
Примечание: u, ** - р<0,05; u, * - р<0,0001 - сравнение данных клинической и контрольной групп; u, × - р<0,05 – сравнение данных у носителей разных аллелей одного полиморфизма внутри группы
Однако при остром нарушении мозгового кровообращения носительство предиктивных аллелей полиморфизма толл-рецепторов вызывает существенные сдвиги в уровне маркеров активации и степени экспрессии последних, что, вызывая асептическое воспаление в ткани мозга и увеличивая тем самым зону инфаркта, вероятнее всего, влияет на течение и исход инсульта.
Заключение. В результате исследования в наблюдаемых группах выявлены все аллели и генотипы изучаемых генетических полиморфизмов в гомо- и гетерозиготном состоянии. В сравнении с контрольной группой у больных мозговым инсультом отмечено частотное преимущество в носительстве генотипов TLR2-753Arg/Arg, TLR4-299Asp/Asp, TLR6-249Pro/Pro и аллелей TLR2-753Arg, TLR4-299Asp TLR6-249Pro, а также TLR9-1237C, что повышает риск развития острого нарушения мозгового кровообращения с 1,72 до 3,63 раза. Кроме этого, носительство предиктивных аллелей влияет на степень экспрессии TLR2 и TLR4 незначительно в условиях нормы и более существенно при ишемическом инсульте. Уровень маркера активации TLR2 и TLR4 также зависит от степени тяжести заболевания – чем тяжелее ОНМК, тем выше его концентрация в крови. Вероятно, настоящий феномен объясняется универсальным физиологическим действием рецепторов в условиях патологического процесса, а в данном случае и генетически детерминированными конформационными изменениями «толлов». В конечном итоге, извращенное функционирование рецепторов вызывает цитокиновый дисбаланс, запускающий воспалительный процесс в сосудистой стенке с развитием и прогрессированием атеросклероза, который среди факторов риска ОНМК занимает ведущее место и, вероятнее всего, влияет на течение и исход инсульта.
