Первичные опухоли головного мозга встречаются примерно в 10% от всех неврологических заболеваний нетравматического генеза. В таком же проценте случаев они являются причиной смерти от всех заболеваний неопухолевого происхождения и второй по частоте причиной смерти у нейрохирургических больных после сосудистых заболеваний [1,4,13]. Выявление первичной опухоли головного мозга, ее метастазов, а также степени ответа на последующее химиолучевое лечение невозможно без использования таких современных методов нейровизуализации, как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Не менее важны диагностика осложнений раннего (в первые двое суток) послеоперационного периода (гематома, ишемия, отек, дислокация) и оценка степени радикальности выполненного хирургического вмешательства [6,11,12]. На сегодняшний день не вызывает сомнений, что наилучшие результаты терапии этого вида опухолей обеспечиваются комплексным лечебным подходом, включающим хирургию, цитотоксическую химиотерапию, лучевую терапию [2,3,14]. Показано, что даже на расстоянии свыше 4 см от удаленного опухолевого узла остается множество опухолевых клеток с повышенной пролиферативной активностью [8,9]. Это объясняется изменчивостью опухолевых клеток в процессе роста, развития и проведения лечебных мероприятий [10]. По мнению большинства специалистов, полное излечение от опухоли хирургическим, лучевым, химиотерапевтическим или другими методами, как правило, не удается, что ставит лечение этих опухолей в ряд наиболее сложных проблем современной нейрохирургии [5,6,7,15]. До настоящего времени проблема комплексного лечения интрацеребральных опухолей больших полушарий головного мозга остаётся одним из самых актуальных вопросов нейроонкологии, которая требует поиска новых исследований в этой сфере.
Цель исследования. Изучение результатов комплексного лечения больных с глиальными опухолями головного мозга, оперированных в отделении нейрохирургии клиники Самаркандского медицинского института.
Материалы и методы исследования. В 2003-2014 г. в нашей клинике оперировано 569 больных с опухолями головного мозга. Из них нейроэпителиальные опухоли составляли 47%, а опухоли, растущие из оболочек мозга и других структур составляли 53%. В данной работе мы решили проанализировать данные 69 больных с внутримозговыми опухолями головного мозга, которые оперированы в 2013-2014 г. Возраст больных от 10 до 68 лет, в среднем 39 лет. Среди оперированных больных 38 (55,1%) составляли женщины, 31 (44,9%) - мужчины. 21 (30,4%) больному была произведена КТ и 48 (69,6%) - МРТ. Статистическая обработка произведена пакетом прикладных программ Microsoft Office Excel 2010.
Рис. 1. Соотношение мужчин и женщин (в %).
Результаты и их обсуждение. Из 69 больных у 64 были первичные опухоли, у 5-х рецидивы опухолей. На основании морфологической классификации ВОЗ (2007) проведены гистологические исследования, которые выявили у 10 пациентов (14,5%) пилоидные астроцитомы, у 24 (34.8%) фибриллярные и протоплазматические астроцитомы, у 8 (11.6%) - олигодендроглиомы, у 18 (26.1%) - анапластические астроцитомы, у 4-х (5.8%) - анапластическая олигодендроглиома, у 2-х (2,9%) - анапластическая эпендимома, у 2-х (2,9%) глиобластома и у 1 больного хориоидкарцинома.
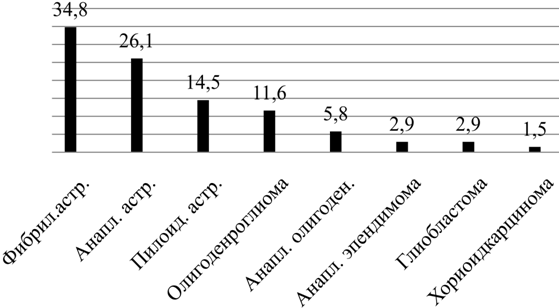
Рис. 2. Распределение больных в зависимости от гистологического типа опухолей (в %).
Эти статистические данные показывают, что по степени злокачественности (WHO grade) высокодифференцированные внутримозговые опухоли (WHO grade I,II) встречались у 60,9%, а малодифференцированные и недифференцированные глиальные опухоли (WHO grade III,IV) у 39,1% больных. По локализации: у 36 (52,2%) пациентов опухоль располагалась в левом полушарии, у 33 (47,8%) - в правом полушарии. У большинства больных опухоль локализовалась в височных долях - 15 (21,7%), в лобных долях - 10 (14,5%), в лобно-височной области - у 10 (14,5%) больных, в височно-теменной области - у 9 (13%) больных, в теменной - у 8 (11,6%) больных, в теменно-затылочной - у 7 (10,1%) больных, в лобно-теменной и височно-теменно-затылочной - у 3 (4,3%) больных, а также в височно-затылочной области у 2 (2,9%) больных, в височно-базальной и лобно-височно-теменной областях по 1 больному. В зависимости от локализации и степени злокачественности опухолей клиническая картина и течение заболевания были различными.
Таблица 1. Распределение больных по локализации опухолей (абс. к-во и в %)

При операции учитывалась не только локализация, но и функциональная значимость зон расположения опухоли с тем, чтобы хирургический доступ был физиологически дозволенным и не вызывал дополнительное повреждение функционально значимых проводящих путей (ФЗПП). Операции проводились путем костно-пластической трепанации (58 больных) и резекционной трепанации (11 больных)при локализации опухолей в средней черепной ямке. 64 больным производилось тотальное и субтотальное удаление опухолей, у 5 больных учитывая гигантские размеры с инфильтрацией двух-трех долей головного мозга ограничились биопсией опухоли. При отеке головного мозга и наличии дефекта твердой мозговой оболочки (ТМО) в конце операции производилась аутопластика ТМО трансплантатом из широкой фасции бедра. При развитии выраженного отека головного мозга у 3-х больных производилось удаление костного лоскута в конце операции.
Нами разработана и 48 больным была установлена субдуральная и эпидуральная регулируемая закрытая дренажная система с использованием стерильной разовой системы. Периферический конец системы соединяется со стерильным, на 1/5 заполненным раствором фурацилина, флаконом. Установка уровня флакона зависит от частоты капель кровянистого тканевого отделяемого (жидкости) из раны, индивидуально. Эта система вводится через миниразрез кожи в рану и обеспечивает хороший дренаж накопляемой тканевой жидкости из субдурального и эпидурального пространства и таким путем можно регулировать объем отделяемой тканевой жидкости с предупреждениемвозможного сдавления головного мозга жидкостным или кровянистым объемным образованием. Среди оперированных 48 больных с установкой такой системы ни в одном случае не наблюдались послеоперационные осложнения. Также не наблюдались послеоперационные осложнения (отек мозга, ликворея) у тех больных, которым была произведена аутопластика дефекта ТМО.
Всем больным в послеоперационном периоде была назначена лучевая терапия. Катамнез от 6 месяцев до 1 года изучен у 22 больных, получивших лучевую терапиюв суммарной дозе 56-60 Гр. Из них у 4-х больных с глиальной гипергрейдной опухолью на контрольной МРТ обнаружен рецидив опухоли. У 1 из них была глиобластома и ему была назначена лучевая терапия, которую он не принимал. Ему была произведена повторная операция, через 4 дня после операции наблюдался летальный исход. У остальных 3 больных, несмотря на комплексное лечение, включая лучевую терапию, развился рецидив. Этим больным назначена химиотерапия.
Выводы:
- Среди наших больных нейроэпителиальные опухоли чаще встречались у женщин - 55,1%, и по гистологической картине преимущество имеют высокодифференцированные внутримозговые опухоли (WHO grade I, II) - 60,9%.
- По локализации в 52,2% случаях опухоли располагались в левом полушарии головного мозга и чаще всего в височной и лобной долях.
- При изучении катамнеза у 22 больных до одного года в послеоперационном периоде только у 3-х пациентов с гипергрейдной опухолью обнаружен рецидив опухоли. Один больной не принимал лучевую терапию и через 4 дня после повторной операции умер.
- Послеоперационные осложнения (напр. отек мозга, ликворея) не встречались благодаря применению свободной аутопластики ТМО и регулируемой закрытой дренажной системы в эпидуральное и субдуральное пространства.
