Введение. Известно, что монооксид азота обладает крайне ироким спектром физиологических и метаболических эффектов [1-4], однако последние в большей степени описаны для NO, синтезируемого эндогенно в физиологических условиях или при внешней стимуляции [1-3, 5, 6]. При этом абсолютное большинство работ из второй категории и включают не непосредственное действие самого оксида азота на биосистему, а различные варианты модификации активности NO-синтаз (введение субстрата L-аргинина [1] либо блокирование ингибиторами разной степени специфичности [1, 5]). В то же время сравнительно мало исследований, касающихся изучения биологического действия экзогенного NO [4, 7, 8].
В связи с вышеуказанным, нами начата систематическая работа по сравнительной оценке метаболических эффектов монооксида азота в свободном и депонированном виде. В том числе проведен анализ влияния NO на окислительный и энергетический метаболизм [9, 10] и состояние некоторых детоксикационных энзимов крови [11]. Опубликованы также результаты исследований действия высоких доз свободного NO (газовый поток с концентрацией соединения 800 ppm) на кристаллогенные свойства сыворотки крови [12]. В них продемонстрировано, что указанное воздействие вызывает достаточно специфическую модификацию дегидратационной структуризации биологической жидкости с формированием одной ли нескольких дополнительных полос в краевой зоне микропрепарата. Данный феномен может быть объяснен образованием в плазме крови значимой фракции нитрозилированных белков, о чем свидетельствует повышением в ней концентрации 3-нитротирозина [12], известного маркера нитрозативного стресса [6].
С другой стороны, как в отечественной, так и в зарубежной литературе отсутствуют сведения о характере действия низких доз оксида азота, обладающих, согласно нашим предшествующих изысканиям [9, 10], более благоприятным влиянием на метаболизм крови. На этом основании целью данного исследования служило изучение действия низких доз газообразного оксида азота на кристаллогенные свойства сыворотки крови человека in vitro.
Материал и методы исследования. Эксперимент выполнен на образцах цельной консервированной крови здоровых доноров (n=10). Каждый образец разделяли на 4 равных порций по 5 мл., первая из которых была контрольной (с ней не проводили никаких манипуляций), а вторая и последующие – опытными (их обрабатывали путем барботажа газовым потоком с концентрацией монооксида азота 20, 50 и 100 ppm соответственно).
Генерацию газовой смеси осуществляли с использованием экспериментального NO-генератора, созданного в ВНИИЭФ-РФЯЦ (Саров) [13]. Объем вводимой газовой смеси составлял 100 мл, продолжительность барботажа – 3 мин. Экспозиция после воздействия – 5 мин.
По завершении экспозиции производили центрифугирование всех образцов при 1500 об/мин в течение 15 мин.
Полученную сыворотку крови в объеме 100 мкл наносили на предметное стекло в соответствии с методом тезиокристаллоскопии [12]. В качестве базисного вещества использовали 0,9% раствор хлорида натрия. Высушенные микропрепараты оценивали морфологически и визуаметрически с применением собственной системы параметров [12].
Статистическая обработка результатов производилась алгоритмами вариационной статистики с применением пакета SPSS 11.0.
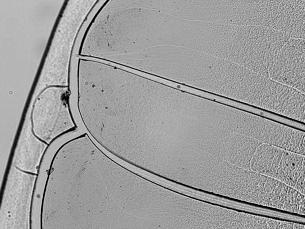
Результаты и обсуждение. Проводили морфологическую и критериальную оценку особенностей дегидратационной структуризации сыворотки крови контрольного и опытных образцов. Так, морфологически для контрольного микропрепарата высушенной биологической жидкости был характерен типичный физиологический рисунок фации с умеренными признаками кристаллизации в центральной зоне и многочисленными регулярными аркообразными разломами в краевой зоне (рис. 1А). В то же время некоторые признаки белкового дисбаланса имели место и в этом случае. В частности, обнаруживалась относительно малая ширина краевой зоны, формируемой протеиновым компонентом биологической жидкости, причем в этой части препарата присутствовали неоднородности текстуры.
|
|
|
|
|
|
|
|
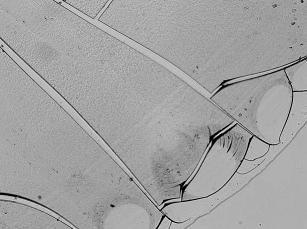
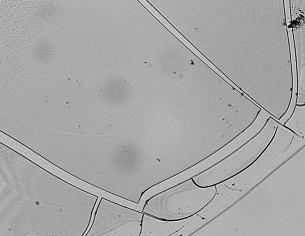
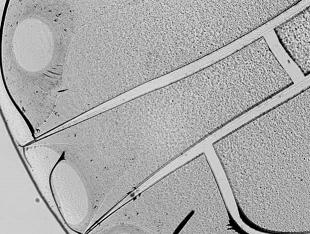
Рис. 1. Картины кристаллизации образцов сыворотки крови при ее обработке различными дозами газообразного оксида азота.
Наиболее низкая из использованных концентраций газообразного оксида азота (20 ppm) способствовала умеренной оптимизации кристаллоскопической картины биосубстрата (рис. 1Б). Это проявлялось в формировании регулярных центростремительных разломов, имеющих сопоставимую глубину и длину. Кроме того, следует обратить особое внимание на существенное расширение радиуса краевой зоны в целом. С учетом того, что именно в данной части образца могут происходить наиболее значимые преобразования [14, 15], связанные с возможностью нитрозилирования белков [1, 6, 8], подобные сдвиги нужно трактовать как позитивные.
Нарастание действующей концентрации оксида азота до 50 ppm обуславливает дальнейшую трансформацию результата дегидратационной структуризации сыворотки крови (рис. 1В). В этих образцах наблюдали умеренное обеднение кристаллического компонента фации с одновременным сужением краевой зоны микропрепарата, сопоставимым с выявленным в контрольном образце высушенной биологической жидкости.
Более высокие концентрации NO (75 и 100 ppm) хотя и способствовали оптимизации сети разломов картины (в случае воздействия 100 ppm оксида азота – с формированием дугообразных разломов), стимулировали кристаллообразование в центральной и промежуточной зонах фации, а также обеспечивали неоднородность текстуры образца. Следует подчеркнуть умеренную тенденцию к хаотизации «дополнительных» разломов краевой зоны микропрепарата, соединяющих основные между собой. В то же время формирования выраженной полосы, характерной для действия высоких концентраций изучаемого соединения (800 ppm) [12], не происходит при действии ни одной из использованных в данном исследовании концентрация оксида азота. Это служит косвенным отражением отсутствия нитрозилирующего эффекта в отношении белковых компонентов плазмы крови и, следовательно, возникновения нитрозилирующего стресса [6, 16].
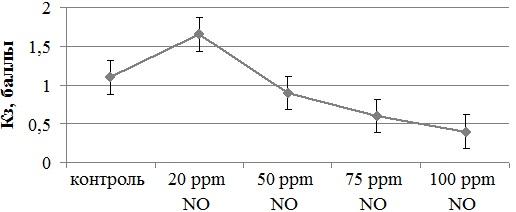
Рис. 2. Выраженность краевой зоны фаций сыворотки крови при ее обработке различными дозами газообразного оксида азота.
Для количественного описания результата дегидратационной структуризации сыворотки крови нами была применена критериальная оценка кристаллоскопических фаций биосубстрата. Учитывая ранее указанные особенности влияния оксида азота на кристаллогенную активность крови, особое внимание было уделено параметрам, характеризующим правильность структуропостроения элементов микропрепарата (степень деструкции фации) и выраженность краевой белковой его зоны (рис. 2).
Установлено, что минимальная среди использованных концентраций оксида азота (20 ppm) снижает выраженность деструктивных изменений кристаллов с 0,76±0,15 балла до 0,36±0,14 балла (p<0,01). Повышение концентрации приводит к дозозависимому нарастанию параметра, практически выходящему на плато при воздействии на образцы цельной крови 75 ppm NO. Следует подчеркнуть, что даже наиболее высокая концентрация оксида азота (100 ppm) не вызывает значительного увеличения значения степени деструкции фации, остающейся в пределах 1,5 балла.
Анализ сформированности краевой зоны микропрепарата высушенной биологической жидкости при действии различных концентраций оксида азота также продемонстрировал двухфазную зависимость (рис. 2). Так, выявленные на основании морфологической оценки кристаллограмм сыворотки крови особенности краевой зоны фации выразились при визуаметрии в повышении значения параметра (с 1,10±0,12 до 1,65±0,14 балла при концентрации NO 20 ppm; p<0,05). Дальнейшее увеличение воздействующей дозы оксида азота приводило к резкому сужению краевой зоны с соответствующим падением уровня показателя, достигающим максимума (0,41±0,12 балла) при барботаже образцов крови наивысшей из использованных концентраций соединения (100 ppm). В целом, результаты исследования подтверждают исходные предположения о превалирующем влиянии газообразного оксида азота на белковую фракцию плазмы крови здоровых доноров при обработке in vitro [12].
Заключение. Таким образом, низкие концентрации монооксида азота оказывают модулирующее действие на кристаллогенные свойства сыворотки крови человека, причем их влияние реализуется преимущественно в модуляции свойств белков. Установлено, что наиболее оптимальным эффектом, проявляющимся в расширении краевой зоны и формировании в ней регулярных центростремительных разломов, обладает газовый поток с концентрацией оксида азота 20 ppm.