Введение. Злокачественная опухолевая патология органов репродукции у женщин является одной из наиболее актуальных проблем современной гинекологии в связи с ростом заболеваемости. Статистика свидетельствует, что в последние годы на рак тела матки (РТМ) приходится 6,5%, рак молочной железы - 19,3%, рак шейки матки - 5,3% и рак яичников -5,0% всех случаев злокачественных новообразований среди женского населения России [2]. Высокая частота распространения рака органов репродукции указывают на несомненные специфические особенности заболевания и на зависимость его возникновения от комплекса причин эндогенной и экзогенной природы.
В настоящее время установлено, что особенностью патогенеза РТМ является его развитие на фоне предшествующих эндокринно-обменных нарушений в организме в сочетании с ановуляцией, гиперэстрогенией и дефицитом прогестерона [1]. Нет сомнений и в том, что РТМ является процессом накопления мутаций, генетических изменений [10], что приводит к нарушениям регуляции клеточного цикла, дифференцировки, морфогенетических реакций клетки, а также к неэффективному функционированию факторов специфического и неспецифического противоопухолевого иммунитета. Ключевую роль в возникновении указанных нарушений может играть окислительный стресс [12]. Считается, что реакции перекисного окисления липидов (ПОЛ) участвуют в клеточной пролиферации и трансформации, а антиоксиданты обладают антипролиферативным действием [4]. По мнению ряда авторов, противоопухолевая активность жирорастворимых витаминов (А, Е, каротин и др.) в значительной степени определяется прямым или косвенным воздействием (через макрофаги) на функциональную активность Т-клеток [8]. Так, прямой эффект токоферолов может быть связан с витамин Е-индуцированными изменениями Т-клеточных рецепторов, участвующих в иммунных реакциях [9]. Обладая антиоксидантным функциям, он способствует снижению синтеза иммуносупрессивных факторов (PGE2, Н2О2) активированными макрофагами, стимулирует Th1 клеточный ответ [8, 13]. Витамин А регулирует активность клеточной смерти Т-лимфоцитов [11]. Предотвращение развития или своевременная коррекция нарушений иммунной реактивности организма с помощью жирорастворимых витаминов является одним из эффективных подходов профилактики опухолевых заболеваний.
Целью исследования явился анализ содержания жирорастворимых витаминов и основных субпопуляций Т-лимфоцитов в крови у женщин с раком тела матки.
Материал и методы. В соответствии с поставленной целью исследования было обследовано 335 женщин, из которых первую группу составили 290 женщин с РТМ. Согласно степени дифференцировки опухоли группа состояла из 34,5% пациенток с высокодифференцированной, 33,8% - с умеренно-дифференцированной и 31,7% - с низкодифференцированной аденокарциномой. Распределение по морфологическим стадиям заболевания показало, что у 67,6% пациенток имеется I стадия заболевания; у 20,6% - II, у 7,4% – III и у 4,4% – IV. Средний возраст пациенток составил 63,3±5,2 лет.
В контрольную (вторую) группу были включены 45 женщин, находящихся в таком же возрасте, что и пациентки клинических групп, но не имеющих в анамнезе опухолевых заболеваний матки и других внутренних органов. Все исследования выполнялись в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы научных и медицинских исследований с участием человека» и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г., № 266. Содержание жирорастворимых витаминов (β-каротина, ретинола, α-токоферола) в сыворотке крови определяли с помощью метода ВЭЖХ [6] на хроматографе «Милихром» (Россия) с УФ детекцией в диапазоне 260-292 нм. Анализ основных субпопуляций Т-лимфоцитов проводили с использованием моноклональных антител к поверхностным дифференцировочным антигенам. Количество антигенпозитивных клеток (CD3+, CD4+, CD8+, СD16+) определяли как процент флуоресцирующих клеток при просматривании 200 лимфоцитов за вычетом процента флуоресцирующих клеток, наблюдаемых в препарате отрицательного контроля. Результаты исследований статистически обрабатывали [3], вычисляя среднюю арифметическую величину (М), ошибку репрезентативности средней величины (m) и уровень значимости различий средних величин (р) на основании t-критерия Стьюдента с поправкой Бонферони для уровня достоверности 95% (p<0,05).
Результаты. При оценке содержания жирорастворимых антиоксидантов было обнаружено (табл. 1), что в группе пациенток с РТМ содержание β-каротина было достоверно (p<0,05) ниже на 35,1% «средней» контрольных показателей. Анализ концентраций ретинола в сыворотке крови у пациенток с РТМ показал, что «средняя» концентраций витамина А была ниже на 33,2% показателей контроля (p<0,05). При определении уровня витамина Е в сыворотке крови у пациенток с РТМ «средняя» концентраций α-токоферола оказалась ниже на 30,9% контрольных значений.
Таблица 1. Содержание жирорастворимых витаминов в крови практически здоровых женщин и больных раком тела матки (M±m)
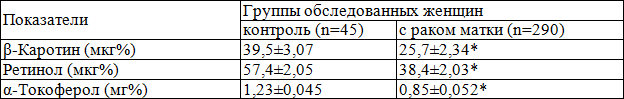
Примечание: здесь и далее * - p<0,05 по сравнению с контролем
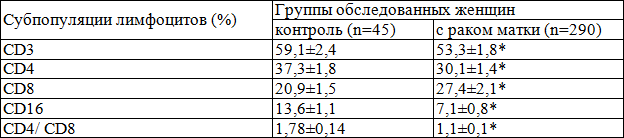
При исследовании состояния Т- клеточного звена иммунитета было установлено (табл. 2), что у пациенток с РТМ отмечается достоверное (p<0,05) снижение процентного содержания CD3+ лимфоцитов в крови, по сравнению с контролем. При тестировании процентного содержания CD4+ лимфоцитов, «средняя» у пациенток с диагнозом РТМ была достоверно ниже в 1,24 раза значений контрольных показателей (p<0,05).
При оценке процентного содержания CD8+ лимфоцитов, относящихся к супрессорно-цитотоксической субпопуляции зрелых Т-клеток [7] было обнаружено, что в группе пациенток с диагнозом РТМ их «средняя» величина достоверно выше в 1,31 раза значений нормативных показателей (p<0,05).
Данные научной литературы свидетельствуют о важности определения соотношения CD4/CD8 положительных Т-лимфоцитов в крови для тестирования функционального состояния клеточного звена иммунной системы при различных патологических процессах [7]. Часто при опухолевых заболеваниях отмечаются существенные нарушения Т-клеточного иммунитета, проявляющиеся снижением функции вилочковой железы, появлением в циркуляции незрелых Т-клеток, нарушением баланса субпопуляций Т- лимфоцитов, а именно активацией супрессоров и угнетением хелперов, снижением NK-активности [5]. Анализ полученных данных показал, что в группе женщин с диагнозом РТМ «средняя» соотношения CD4/CD8 была достоверно ниже в 1,62 раза, чем в контрольной группе пациенток (p<0,05).
Таблица 2. Относительное содержание субпопуляций лимфоцитов в крови практически здоровых женщин и больных раком тела матки (M±m).
Известно, что чрезвычайно важным для оценки состояния организма при опухолевых процессах является определение содержания в крови лимфоцитов, несущих кластер дифференцировки (CD16+), наличие которого позволяет отнести его к субпопуляции NK – клеток, играющих значимую роль в механизмах противоопухолевой защиты организма [14].
При оценке процентного содержания CD16+ лимфоцитов установлено, что в группе пациенток с диагнозом РТМ их «средняя» величина достоверно ниже в 1,92 раза значений нормативных показателей (p<0,05).
Проведенный корреляционный анализ между изучаемыми показателями позволил выявить следующие взаимосвязи. Так, в контрольной группе женщин была выявлена прямая коррелятивная взаимосвязь между содержанием CD3+ и CD4+ лимфоцитов (r=+0,50, p<0,05), CD3+ и CD8+ лимфоцитов (r=+0,45, p<0,05); CD4+ лимфоцитов и α-токоферола (r=+0,65, p<0,05); CD8+ лимфоцитов и β-каротина (r=+0,55, p<0,05). У пациенток с диагнозом РТМ эти коррелятивные взаимосвязи исчезают, однако, возникает обратная взаимозависимость между содержанием CD16+ лимфоцитами и α-токоферола (r=-0,63, p<0,05), а также CD8+ и CD16+ лимфоцитами (r=-0,43, p<0,05), причем последняя корреляция свидетельствует о взаимосвязи снижения противоопухолевой защиты, реализуемой посредством NK-клеток, с нарастанием супрессорных эффектов в клеточном звене иммунной системы.
Заключение. Таким образом, при исследовании субпопуляционного состава Т-лимфоцитов у женщин с РТМ была выявлена достоверная тенденция к снижению содержания общей популяции зрелых Т-лимфоцитов (CD3+), хелперно-индукторной субпопуляции Т-лимфоцитов (CD4+), NK-клеток (CD16+) на фоне повышения уровня супрессорно-цитотоксической субпопуляции зрелых Т- лимфоцитов (CD8+).
Полученные результаты свидетельствуют о выраженном, нарастающем дисбалансе в клеточном звене иммунной системы при РТМ, который может быть тесным образом связан с наличием недостаточности жирорастворимых витаминов (β-каротина, ретинола, α-токоферола) в организме больных женщин. Это позволяют рекомендовать применение жирорастворимых витаминов в комплексных лечебных и профилактических мероприятиях для повышения противоопухолевой резистентности организма.
