Введение
Рак молочной железы (РМЖ) – наиболее распространенный вид опухолей, встречающихся среди женского населения Европы, Америки и некоторых стран Азии [4,5,8-10,12]. В течение последних 20 лет в мире, а также в России наметилась устойчивая тенденция к росту заболеваемости этим видом рака, особенно в городах и мегаполисах [7-9,12]. Начиная с 1985 г. РМЖ занимает 1-е место среди онкологических заболеваний у женщин (частота встречаемости – 31,2%) [4,5,8-10].
Известно, что развитие опухоли связано с нарушением роста и дифференцировки клеток и злокачественным их перерождением. Во многих случаях такие нарушения обусловлены мутациями или резким повышением активности клеточных онкогенов – нормальных генов, которые участвуют в регуляции клеточного цикла, передаче сигналов и других процессах жизнедеятельности клеток. В 10% случаев заболевание передается из поколения в поколение и обусловлено наличием врожденных мутаций в генах предрасположенности BRCA1 или BRCA2 (BReast CАncer) [1,8,9,13,14].
Развитие и биологические характеристики рака молочной железы во многом определяются метаболизмом эстрогенов. К наиболее значимым проявлениям действия эстрогенов относят активацию пролиферации, ингибирование процессов апоптоза, а так же стимуляцию выработки факторов роста. Вышеперечисленные эффекты могут обуславливать развитие пролиферативных гиперпластических процессов и рака в эстроген-зависимых тканях.
В настоящее время при определении прогноза заболевания и выбора наиболее адекватной тактики лечения больных раком молочной железы основываются на ряде факторов, определяющих как особенности организма (возраст, состояние менструальной функции), так и биологические характеристики самой опухоли (размер опухоли, наличие метастазов в регионарные лимфоузлы, тип опухолевого роста, гистологическая принадлежность, степень злокачественности, инвазия кровеносных и лимфатических сосудов, уровень экспрессии рецепторов эстрогенов и прогестерона и др.). Однако результаты лечения далеко не всегда являются удовлетворительными. И в настоящее время ведется поиск новых, более информативных параметров, позволяющих адекватно учитывать молекулярные механизмы развития опухолевого процесса.
Несмотря на значительные достижения молекулярной биологии и генетики последнего десятилетия в диагностике, лечении и профилактике рака молочной железы тема остается актуальной. Железистый компонент молочной железы является гормонозависимой мишенью по отношению к яичниковым гормонам, особенно эстрогенам и его метаболитам [3,11].
В настоящее время в отечественной литературе уделяется мало внимания роли метаболитов эстрогенов в генезе гормонозависимых опухолей репродуктивных органов у женщин. Более того, практически отсутствуют исследования, касающиеся попыток их коррекции. Вместе с тем, современная фармакологическая индустрия выделила ряд соединений, активно участвующих в регуляции эстрогенных метаболитов [2,3,15]. Одним из таких препаратов, корректирующий соотношение 2 -ОНЕ1 к 16α-ОНЕ1 является индинол - фитонутриент, содержащийся в овощах семейства крестоцветных, обладающий противоопухолевой активностью. В биохимических исследованиях установлено, что Индинол препятствует образованию 16 α-гидроксистерона, блокирует проведение сигналов в опухолевые клетки, которые побуждают ее к активному делению, и обладает свойством индуцировать в опухолевых клетках процессы апоптоза [3,15].
Для нас было важным на основе современных методологий, на одном клиническом материале обозначить роль метаболического синдрома и убедиться в реальной значимости влияния Индинола на уровень экспрессии метаболитов эстрогенов, что позволит существенно расширить представление о подходах к предупреждению и лечению опухолей молочной железы.
Цель исследования: Изучить роль метаболического синдрома у больных раком молочной железы, оценить изменение экспрессии метаболитов эстрогенов (16α-ОН и 2-ОН) и возможности их коррекции.
Материалы и методы
В основу работы легли результаты наблюдений за 86 больными РМЖ I–IV стадий и 50 пациентками с фиброзно-кистозной мастопатией, находящихся на лечении в ФГУ РНЦРР в период с 2006 по 2009 г. Средний возраст больных РМЖ составил 47,3±4,1 года, в контрольной группе этот показатель был равен 49,6±2,5 года. Распределение по стадиям пациенток со злокачественными новообразованиями молочной железы было следующим: I стадия РМЖ диагностирована у 31 (36,04%), II – у 40 (46,5%), III – у 15(17,4%) больных. В план лечения входили различные варианты хирургических вмешательств: секторальная резекция молочной железы; радикальная резекция молочной железы с регионарной лимфаденэктомией (ЛАЭ); радикальная резекция молочной железы с регионарной ЛАЭ и одномоментной пластикой торакодорзальным лоскутом и фрагментом большой грудной мышцы; мастэктомия по Маддену; подкожная мастэктомия (одно- или двусторонняя) с одномоментным аломаммопротезированием. Гистологическое и иммуногистохимическое исследования биопсийного и операционного материалов проводили в отделении патоморфологии ФГУ РНЦРР.
Молекулярно-генетическое исследование проводилось с использованием метода полимеразной цепной реакции (ПЦР). Основные этапы исследования включили в себя: подготовку материала и выделение из него ДНК, аплификацию и детекцию продуктов ПЦР.
Для количественного определения соотношения метаболитов эстрогенов в моче (2 гидроксиэстрон/16α-гидроксиэстрон) в настоящей работе использован иммуноферментный набор ESTRAMET 2/16 ELISA.
Использовалась утренняя моча 40 мг с добавлением 50 мг аскорбиновой кислоты (лучше всего для хранения образца), затем образец мочи подписывался и помещался в заморозку при -20°С и ниже. Образцы в таком состоянии могут храниться в замороженном состоянии несколько месяцев без потери метаболитов.
Принцип методики: тест ESTRAMET 2/16α ELISA основан на конкурентном методе твердофазного иммуноферментного анализа (рис.1).
С помощью набора ESTRAMET 2/16 определялась индивидуальная концентрация 2-гидроксиэстрона (2ОНЕ1) и 16α-гидроксиэстрон (16αОНЕ1) в моче. В методе используются антитела, связанные с твердой фазой (лунки микропланшета) и антиген (метаболит эстрогена), конъюгированный с ферментом. Во время инкубации связывание конъюгированного с ферментом антигена с иммабилизованными в лунках микропланшета антителами ингибируется добавленными в лунки свободным антигеном, присутствующим в стандартных образцах. Так как число сайтов связанных с антителами, иммобилизованными в лунке, ограничено, то активность фермента, связавшегося с твердой фазой (в лунке) снижается в присутствии свободного антигена. После промывки лунок добавляется субстрат, в результате его взаимодействия с ферментом появляется цветное окрашивание (рис 2).

Рис. 1. Метод твердофазного иммуноферментного анализа
Рис. 2. Цветное окрашивание лунок при взаимодействии субстрата с ферментом
Интенсивность окрашивания обратно пропорциональна концентрации свободного антигена. Моноклональные антитела к метаболитам эстрогена иммобилизованы непосредственно в лунках микропланшета. Метаболиты эстрогена конъюгированы со щелочной фосфатазой.
2ОНЕ1 и 16α-ОНЕ1 в моче обнаруживаются в форме 3-глюкуронида и 3- или 3,16α–глюкуронидов, соответственно. Для глюкуронидов требуется удаление сахаров перед тестированием, для распознавания моноклональными антителами. Для высвобождения эстрогенов от глюкуроновой кислоты и от сульфата используют смесь β-глюкуронидазы и арилсульфатазы, выделенных из улитки Helix pomatia. В ходе анализа при подготовке образцов, аликвоту мочи разводят в соотношении 1:20 буфером, содержащим ферменты и инкубируют до полного расщепления. Затем смесь ферментов нейтрализуется, и полученный раствор используется непосредственно для анализа.
Значения уровня метаболитов эстрогенов в моче у «здоровых» женщин, по данным литературы: 16α-ОН -0,6-10 нг/мл; 2-ОН -1-20 нг/мл; 2-ОН/16α-ОН (в популяции «здоровых» женщин) – 0,6-6. Среднее значение соотношения 2-ОН/16α-ОН для здоровых женщин - 2.
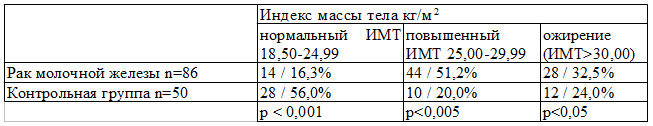
Результаты и обсуждение. В нашей работе мы оценили индекс массы тела больных раком молочной железы в сравнении с контрольной группой. Как видно из табл. 1 в группе больных раком молочной железы всего у 14 пациенток (16,3%) нормальный индекс массы тела, у 44 больных (51,2%) он повышенный и у 28 (32,5%) индекс массы тела превышает 30 кг/м2. При этом в контрольной группе повышенный индекс массы отмечен лишь у 10 женщин, что составило 20,0% и только в 24,0% наблюдений индекс массы тела превышал 30 кг/м2. Из 50 женщин контрольной группы у 28 (56,0%) индекс массы тела был в пределах нормы.
Таблица 1. Индекс массы тела у больных раком молочной железы и контрольной группы (абс/%).
Таким образом, ожирение, являясь патогенетическим субстратом продукции эстрона в постменопаузе, становится как бы маркером гиперэстрогении. Кроме того, жировая ткань является источником ряда значимых с онкологической точки зрения цитокинов: фактора некроза опухолей-α (ФНО-α) и интерлейкина 6. Многие исследователи рассматривают ФНО-α как медиатор инсулинорезистентности. Количество интерлейкина-6, продукция которого сосредоточена в абдоминальной жировой ткани, значительно увеличивается с развитием ожирения.
Следующим этапом наших исследований стало изучение уровня продукции 2 – гидроксиэстрона, 16а-гидроксиэстрона и их соотношений.
Как видно из приведенных данных, средний уровень метаболита 2-ОН в группе больных раком молочной железы (7,80 нг/мл) в 3,2 раза ниже, чем в контрольной группе (25,08 нг/мл). В то же время, средний уровень метаболита 16α-ОН оказался выше, чем в контрольной группе (18,63 нг/мл и 12,00 нг/мл соответственно) в 1,6 раза. Соотношение метаболитов в группах также демонстрировало существенные, статистически достоверные (Р<0,001), различия. При раке молочной железы величина 2-ОН/16α-ОН находилась на уровне 0,42, в то время, как в контрольной группе это показатель более, чем в 5 (2,09) раз превышал коэффициент для больных раком молочной железы. Полученные данные свидетельствуют о том, что в группе больных раком молочной железы метаболизм эстрона через систему цитохромов Р450 чаще ориентирован на продукцию «агрессивного» метаболита 16α-ОН.
Таблица 2. Средний уровень и соотношение метаболитов эстрогенов 2-ОН/16α-ОН

Примечание: * - статистически достоверные отличия между группами, р<0,01
Следующим этапом мы провели анализ соотношения метаболитов 2-ОН/16α-ОН в зависимости от индекса массы тела (рис. 3)
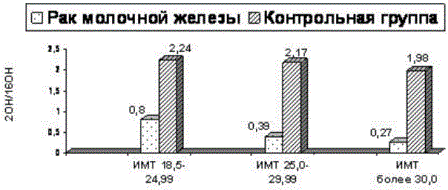
Рис. 3. Средний коэффициент соотношения метаболитов (2-ОН/16α-ОН) у больных раком молочной железы и в контрольной группе в зависимости от индекса массы тела (кг/м2) в группе контроля
Обращает на себя внимание то, что в группе больных с низким индексом массы тела (отсутствие клинически выраженных проявлений метаболического синдрома) отмечен низкий (0,8) коэффициент соотношения метаболитов. Иными словами, при раке молочной железы участие «агрессивных» метаболитов в формировании баланса гормонов представляется более значительным у пациенток и без ожирения. Отчетливо прослеживается и следующая тенденция: по мере нарастания индекса массы тела снижается соотношение метаболитов, о чем свидетельствует более высокий уровень экспрессии 16а-ОН. В то же время, в группе контроля соотношение этих двух метаболитов при различных ИМТ подвержено меньшим колебаниям. Однако следует особо отметить, что при индексе массы тела >30 в группе контроля зафиксировано падение коэффициента ниже 2. О чем это свидетельствует? Без преувеличения можно констатировать, что любое увеличение индекса массы тела свидетельствует о формировании целого комплекса метаболических нарушений, а повышенная экспрессия 16аОН – один из факторов. Иными словами, низкий коэффициент соотношения метаболитов при высоком индексе массы тела может служить признаком высокого риска развития в будущем опухолей репродуктивных органов.
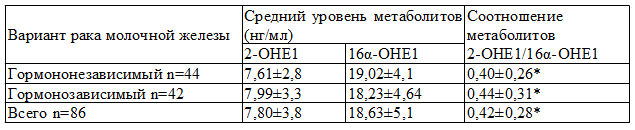
Особое значение в рамках настоящего исследования имеет анализ данных об уровнях метаболитов при различных вариантах рака молочной железы (гормонозависимый и гормононезависимый варианты). В нашем исследовании у 42 больных имелся гормонозависимый и у 44 – гормононезависимый рак молочной железы. Следует заранее оговорить, что определение варианта рака молочной железы выполнялось с помощью иммуногистохимического исследования.
Таблица 3. Средний уровень и соотношение метаболитов эстрогенов 2-ОН/16α-ОН в зависимости от варианта рака молочной железы
Примечание: *- статистически достоверные отличия между группами, р<0,001
Полученные данные иллюстрируют закономерность: при низком уровне рецепторов (гормоннезависимый вариант) мы имеем более высокие значения 16α-ОН - 19,02 (а значит и низкое соотношение 2-ОН/16α-ОН=0,40), в то время как при высоком рецепторном статусе (гормонозависимый вариант) соотношение метаболитов несколько выше - 0,44.
Закономерен вопрос, можно ли каким-то образом повысить в организме уровень 2-ОН (2-гидроксиэстрона) и тем самым блокировать один из ключевых путей патологической пролиферации в гормон-зависимых тканях? В большом количестве проведенных за рубежом экспериментальных и клинических исследованиях было показано, что активно действующий компонент индинола – индол-3-карбинол, а также его физиологический метаболит - 3,3’-дииндолилметан (DIM) обладают выраженным антиэстрогенным эффектом, стимулируя образование в гормон-зависмых тканях антипролиферативного 2-гидроксиэстрона и улучшая таким образом соотношение 2-ОНЕ1/16α-ОНЕ1 в пользу первого.
Рис. 4. Результаты сравнительного исследования
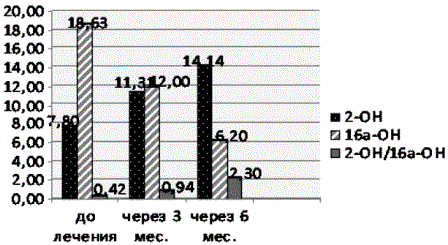
Опираясь на эти данные, предприняли попытку изменить уровень экспрессии эстрогенных метаболитов в сторону усиленной продукции антипролиферативного метаболита 2-ОН (2-гидроксиэстрона) преследуя, как бы две цели: предупреждение новых очагов рака в контралатеральной молочной железе и предупреждение рецидива заболевания и метастазирования.
С этой целью больные раком молочной железы в течение 6 месяцев получали индинол и в интервале 3 и 6 месяцев по схеме 2 капсулы, 2 раза в день (400 мг/сут), без перерыва. У них определялся уровень 2-гидрокси-эстрона и 16α-гидроксиэстрона в моче через 3 месяца и затем через 6 месяцев. Назначался препарат Индинол параллельно с началом общепринятого стандартного лечения рака молочной железы и продолжался прием препарата на фоне проводимого лечения (хирургическое, химиотерапевтическое, лучевое, гормональное).
Результаты исследования свидетельствуют, что заметное улучшение в метаболизме эстрогенов проявляется уже после 3-х месяцев приема: существенно снизился уровень 16α-ОН (с 18,63 нг/мл до 12,00 нг/мл) и возрос уровень экспрессии 2-ОН (с 7,8 нг/мл до 11,31нг/мл). Соответственно коэффициент соотношения метаболитов увеличился более чем в 2 раза: с 0,42 до начала лечения до 0,94 через 3 мес. Последующие еще 3 мес. приема привели к полному восстановлению нормального взаимоотношения метаболитов. Коэффициент 2-ОН/16α-ОН достиг 2,31. При этом экспрессия 16α-ОН снизилась в 3 раза в сравнении с данными до начала лечения. Иными словами, для достижения полного «метаболического» эффекта необходим длительный, не менее полугода, прием препарата. Этот факт вполне вписывается в механизм фармокинетики таргетных препаратов, эффект действия которых сопряжен с формированием нормальных физиологических процессов.
Выводы
1. У больных раком молочной железы отмечена высокая экспрессия 16α-ОН и низкие показатели 2-ОН (коэффициент соотношения 0,42) в сравнении с контрольной группой (2,09), что является важной составляющей метаболического синдрома.
2. Низкий коэффициент соотношения метаболитов характерен как для гормонозависимого (0,44), так и для гормононезависимого (0,4) вариантов заболевания.
3. При раке молочной железы вне зависимости от индекса массы тела отмечен низкий уровень коэффициента соотношения метаболитов, что позволяет отнести этот показатель к прогностическому маркеру при определении риска развития рака молочной железы.
4. Для рака молочной железы характерен высокий уровень сопутствующих эндокринно-обменных нарушений при высоком индексе массы тела, что отражает клиническое проявление метаболического синдрома. Увеличение индекса массы тела коррелирует с коэффициентом соотношения метаболитов для группы контроля: при низком ИМТ (<25 кг/м2) коэффициент соответствует 2,24, при ИМТ>30 кг/м2 он снижается до 1,99.
5. При всех вариантах рака молочной железы проявляется эффект корректирующего действия Индинола наиболее выраженный по истечении 6 месяцев приема.
