Введение. Ежегодно в мире регистрируется около 700000 вновь выявленных случаев первичного рака печени, заболеваемость которым в России составляет 6,6% и 4,1% на 100000 населения среди мужчин и женщин [1].
Коморбидность – сосуществование двух и/или более синдромов (транссиндромальная коморбидность) или заболеваний (транснозологическая коморбидность) у одного пациента, патогенетически взаимосвязанных между собой или совпадающих по времени (хронологическая коморбидность), оказывающих патогенетические взаимовлияния [2].
Коморбидные процессы часто сопровождают онкологические заболевания и/или являются весомыми причинами возникновения рака [3]. Исследования обнаружили увеличение риска развития рака печени в 2-3 раза у больных с сахарным диабетом и гипералиментацией [4-8].
Роль коморбидных процессов, как системных, так и локальных, недостаточно изучена. В последние годы особое внимание в этиопатогенезе гепатоцеллюлярного рака отводится метаболическому синдрому и неалкогольному стеатогепатиту. Данные литературы свидетельствуют о возможной трансформации этих изменений в опухолевый процесс [9-11].
Наличие сопутствующих заболеваний негативно влияет на начало и исход основного заболевания [12]. Однако более верно предположение, что патология эндокринной системы и доброкачественные болезни печени могут быть предикторами возникновения и развития гепатоцеллюлярного рака.
Цель исследования. Выявить характер и частоту коморбидных процессов при гепатоцеллюлярном раке.
Материалы и методы исследования. Настоящая работа основана на анализе клинических данных 120 больных с первичными злокачественными и доброкачественными поражениями печени, находившихся на обследовании и лечении в отделении превентивной онкологии, лапароскопической и общей хирургии Ростовского научно-исследовательского онкологического института за период с 01.01.1998 по 01.05.2011 г.
Для решения поставленных задач была разработана карта сбора данных больных, в которой учитывалось: возраст, пол, диагноз, осложнения, общие и локальные сопутствующие заболевания. Изучались заболевания: системы кровообращения и соединительной ткани; органов дыхания; крови и кроветворной системы; эндокринной системы; почек, органов мочевыделительной системы; печени; желчного пузыря; желудка и 12 п. кишки; толстой кишки; поджелудочной железы; определялся индекс массы тела (ИМТ).
Ретроспективному анализу подверглось 80 пациентов с верифицированным диагнозом гепатоцеллюлярный рак (ГЦР), а в качестве контрольной группы исследовались пациенты с непаразитарными кистами печени (НКП) – 40 человек. У всех больных ГЦР были выполнены различные оперативные вмешательства (циторедуктивная абляция, резекция печени).
Больные с ГЦР распределялись по стадиям согласно классификации TNM (7 издание) [13]. В соответствии с этой классификацией больные распределялись следующим образом: 1 стадия – 1,3%; 2 стадия – 2,5%; 3 стадия – 17,5%; 4 стадия – 78,8%.
Мужчины составляли 62,5%, женщины 37,5%, в возрасте старше 60 лет было 51,2% пациентов с ГЦР.
Для определения метаболического синдрома использовались критерии IDF – International Diabetes Federation [14].
Под метаболическим синдромом понимается: обязательный критерий - индекс массы тела >30 кг/м2; два или более дополнительных показателей - триглицериды ≥ 1,7mmol/L; липопротеиды высокой плотности (ЛПВП) <1,03 mmol/L; А/Д систол. ≥130 mm Hg или диастол. ≥85 mm Hg или лечение гипертонической болезни ранее. Уровень глюкозы крови ≥5,6 mmol/L или установленный диагноз диабета II типа.
Вместо определения ЛПВП, был включен показатель уровня общего холестерина >5,0 mmol/L, в настоящее время рекомендуемый как один из адекватных критериев метаболического синдрома [15].
С целью определения состояния непораженных участков печени у 30 пациентов с ГЦР был изучен биопсийный материал, полученный интраоперационно. Для проведения морфологических исследований собственно опухолей печени и изменений в окружающей ткани были использованы следующие гистологические окраски: гематоксилин и эозин; пикрофуксин по Ван-Гизон, окраска на жир Шарлах – рот Судан III, IV, а также в ряде наблюдений иммуногистохимические методы (Hep – 2; альфа - фетопротеин). Морфологическая оценка степени выраженности фиброза проведена с помощью шкалы Brunta Е.М. [16] , выраженность печёночного стеатоза – по шкале Dixona J.M. [17], цирроз печени – по индексу гистологической активности Кноделя [18].
Статистическая ценность полученных данных верифицировалась определением индекса вероятности Odd Ratio (OR), для сравнения групп был использован t-критерий Стьюдента [19].
Результаты. При изучении органно-системных процессов было выявлено 117 различных заболеваний.
Сводные данные общих коморбидных процессов без поражения печени представлены в табл. 1 и рис. 1.
Анализ полученных данных показал, что среди выявленных заболеваний наибольшую частоту имеют: гипертоническая болезнь, гипералиментация, холелитиаз, хронические гастриты. Часть этих заболеваний может быть отнесена к группе «истинно» сопутствующих, патогенетически не связанных с развитием рака печени. Другие обусловлены уже сформировавшейся гепатокарциномой. Так больные ГЦР имеют высокие показатели рефлюксной болезни (46,8%) – в 3,6 раз больше, чем в контрольной группе (T=2,22; Р<0,5), что может быть объяснено давлением, связанным с увеличением размеров печени и самой опухоли.
В последнее время все больше внимания уделяется метаболическому синдрому как предиктору ракового процесса. Пациентов с наличием метаболического синдрома в основной и контрольной группах было 23,7% и 3 7,5%, соответственно - OR 3,7, то есть в группе с ГЦР метаболический синдром наблюдался в 3,2 раза чаще, чем в контроле.
Отмечается также увеличение количества больных с ожирением (ИМТ>30,0кг/м2) – 31,3%, в контрольной группе – 22,5% (OR 1,4).
Больные с сахарным диабетом II типа при ГЦР составили 13,7%, тогда как в контрольной группе – 2,5%, что в 2,5 раза чаще (OR 5,5).
Очевидны половые различия, так отношения (индекс муж/жен) в группе с ГЦР равен 1,58, а в контрольной группе – 0,25 (OR 6,3).
Нами также изучены локальные поражения печени. Сводные данные представлены в табл. 2.
Вирусные гепатиты В и С и стеатоз при ГЦР составили 28,7% и 18,7%, что в 5,7 и 1,9 раз больше, чем в контрольной группе, соответственно.
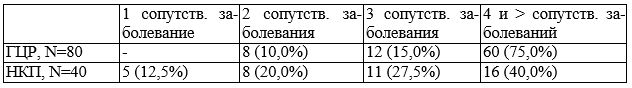
Нами также определено количество сопутствующих заболеваний в изучаемых группах (табл. 3).
У 75,0% больных гепатоцеллюлярным раком имелось более 4-х сопутствующих заболеваний, а в контрольной группе – 40,0%, т.е. в 1,9 раз меньше (t=3,8; p<0,01). Количество заболеваний увеличивается с возрастом, однако средний возраст в основной и контрольной группе отличался незначительно – 58,0 и 59,0 лет, соответственно.
Таблица 1. Общие органосистемные сопутствующие заболевания при гепатоцеллюлярном раке
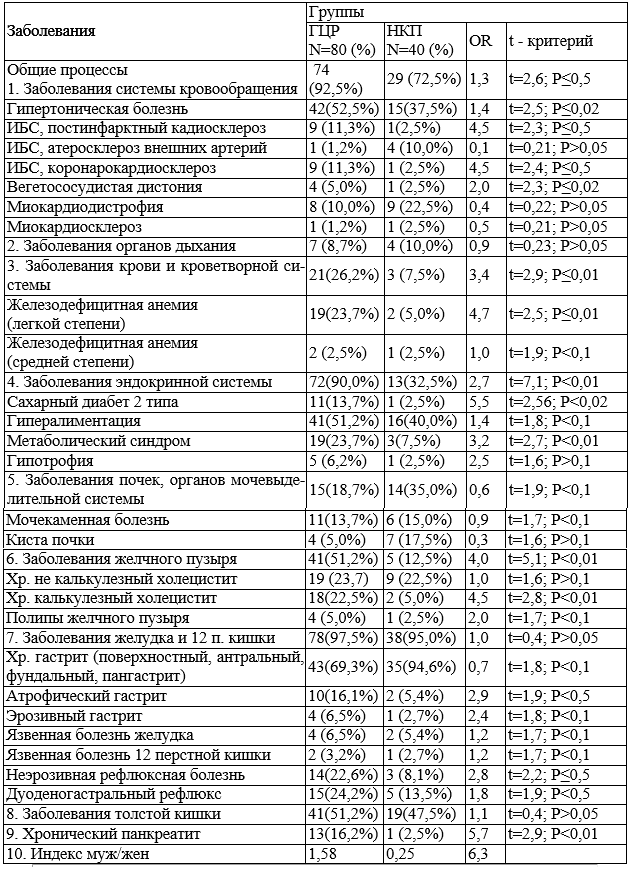
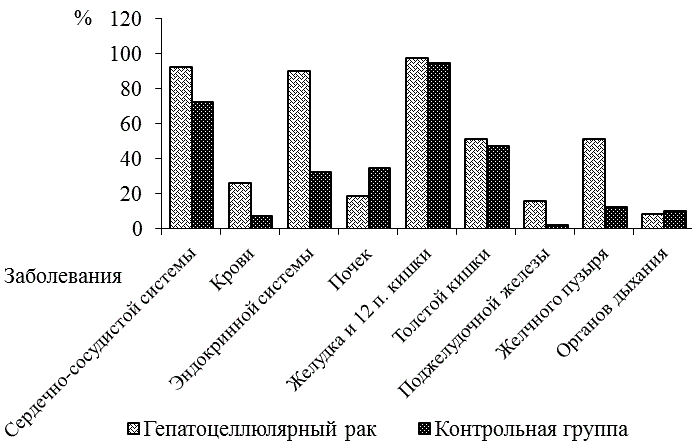
Рис. 1. Общие сопутствующие заболевания при ГЦР
Таблица 2. Локальные сопутствующие заболевания печени
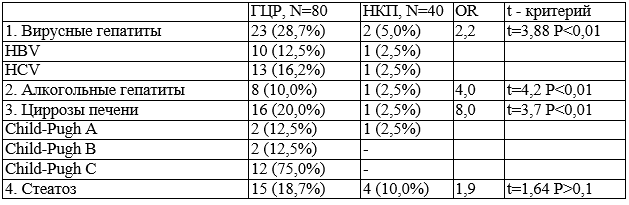
Таблица 3. Количество сопутствующих заболеваний при гепатоцеллюлярном раке (абс. %)
Вместе с тем, очевидно, что «накопление» комплекса различных заболеваний может косвенно индуцировать канцерогенные процессы в печени, вследствии различных иммунологических, биохимических и эндокринных сдвигов в организме.
У 30 пациентов с ГЦР был исследован биопсийный материал. Результаты гистологических исследований представлены в табл. 4. Из табл. 4 видно, что при гепатоцеллюлярной карциноме превалируют лимфоцитарная инфильтрация и фиброз печени. Дополнительного разъяснения требуют данные об относительно низкой частоте стеатоза. Следует иметь ввиду, что среди больных с ГЦР превалировали пациенты 3-4 стадии процесса, то есть среди них имели место нарушение питания и в частности – гипотрофия. В этих обстоятельствах возможно «вымывание» тканевого жира печени, что и отразилось на данных результатов гистологического исследования.
Таблица 4. Структурные изменения в паратуморальной зоне
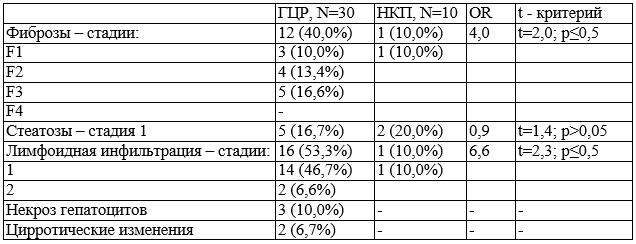
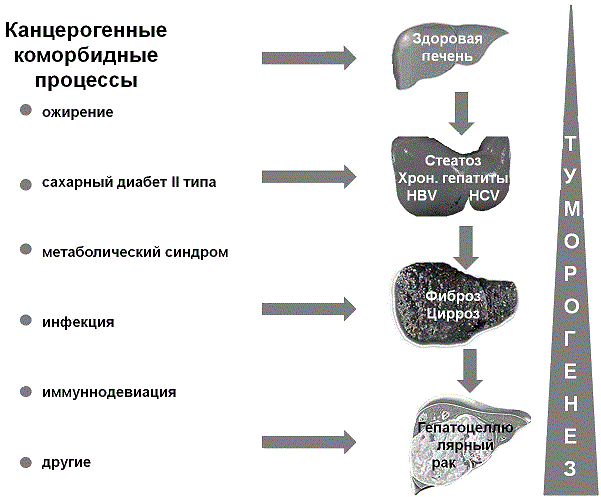
Рис. 2. Коморбидные процессы и гепатоканцерогенез
Таким образом, проведенный анализ наличия общих и локальных коморбидных процессов при гепатоцеллюлярной карциноме выявил превалирование некоторых системных заболеваний: метаболический синдром, сахарный диабет, ожирение, анемия. Часть из них не может быть связана с гепатоканцерогенезом, тогда как другие (сахарный диабет II типа, метаболический синдром) по современным представлениям являются факторами риска злокачественного поражения печени.
Более яркая картина выявляется при анализе локальных, «базовых» поражений печени. Вирусные гепатиты, фиброзы и циррозы печени являются основой для последующей трансформации печеночных клеток в рак.
Анализ собственных данных и имеющихся исследований в этой сфере, позволяет представить следующую общую картину влияния коморбидных процессов на гепатоканцерогенез (рис. 2).
Выводы
1. Гепатоцеллюлярная карцинома развивается на фоне общих, системно-органных коморбидных процессов, среди которых доминирует эндокринно-обменные изменения.
2. Воспалительно-дегенеративные и фибро-цирротические трансформации тканей печени служат базой для развития рака.
3. В рамках превентивных онкомероприятий, выявленные коморбидные процессы требуют длительной терапии и должны учитываться при определении риска возникновения гепатоцеллюлярного рака.
