Введение. Хорошо известен высокий риск развития венозных тромбоэмболических осложнений у больных страдающих онкологическими заболеваниями. У этой категории больных, тромбоз может поражать вены самой разной локализации [1]. Онкологические больные, получающие специальное лечение, имеют еще более высокий риск развития венозного тромбоза и тромбоэмболии легочной артерии (ТЭЛА). Наличие злокачественной опухоли сопровождается увеличением риска развития венозного тромбоза в 4 раза, а химиотерапия повышает этот риск более чем 6 раз [4, 8]. У онкологических больных, перенесших хирургическое лечение, риск фатальной ТЭЛА в три раза выше, чем у неонкологических больных, перенесших подобные операции [3]. При сочетании злокачественного заболевания с венозным тромбозом и ТЭЛА годичная летальность онкологических больных увеличивается в три раза [9].
Наиболее частыми источниками ТЭЛА (в 90% случаях) являются тромбы, cформированные в системе нижней полой вены - в глубоких венах нижних конечностей и магистральных венах таза. При этом, причиной массивной эмболии легочного ствола и главных его ветвей в 65% случаев является тромбоз, локализующийся в илиокавальном сегменте, в 35% - в подколенно-бедренном. А причиной эмболии дистальных ветвей легочной артерии, в большинстве случаев является тромбоз глубоких вен голени [1].
Однако известно, что не каждый тромбоз осложняется развитием ТЭЛА. Проведение результативной, целенаправленной профилактики ТЭЛА зависит от правильного определения эмбологенности тромбов, сформировавшихся в системе нижней полой вены. Несмотря на то, что применение ультразвуковых технологий позволило добиться значительных успехов в диагностике тромбозов системы нижней полой вены, до настоящего времени однозначно не определены все признаки эмбологенности тромба. Одни авторы эмболоопасным считают флотирующий тромб, который имеет единственную точку фиксации в своем дистальном отделе, тогда как остальная его часть расположена свободно, не связана со стенками вены и находится в токе крови [1,2]. По данным других авторов, наличие флотирующего тромба не приводит к повышенному риску эмболии, и амбулаторное ведение таких пациентов является приемлемым [5, 6, 7].
Своевременная ультразвуковая диагностика эмбологенных тромбозов вен нижних конечностей и подвздошных вен способствует правильному целенаправленному выбору мер профилактики ТЭЛА и значительному уменьшению летальности от ТЭЛА среди онкологических пациентов. Правильный выбор мер профилактики ТЭЛА у онкологических больных может существенно улучшить прогноз и снизить смертность.
Цель: установление признаков эмбологенности тромбов, сформировавшихся в системе нижней полой вены у онкологических больных, получающих специальное лечение.
Материалы и методы. В 2011-2012 г. было обследовано 246 онкологических больных (основная группа), проходивших специальное лечение по поводу онкологических заболеваний в ГАУЗ «Республиканский клинический онкологический диспансер МЗ РТ» (г. Казань). В группе были 110 женщин, 136 мужчин, средний возраст пациентов основной группы составил 68 лет (от 58 до 73 лет). Всем пациентам основной группы проводили ультразвуковые исследования (УЗИ) вен нижних конечностей, подвздошных вен, дистального отдела нижней полой вены непосредственно до начала специального лечения, а далее в период проведения специального лечения со следующей последовательностью:
1) при хирургическом лечении - на второй день после выполнения хирургической операции, а далее с периодичностью каждые 3-4 дня до выписки из стационара;
2) при химиотерапии - на второй день после начала химиотерапии, а далее с периодичностью каждые 3-4 дня до конца курса химиотерапии;
3) при лучевой терапии - на второй день после начала лучевой терапии, а далее с периодичностью каждые 3-4 дня до конца курса лучевой терапии.
В тех случаях, когда в период проведения специального лечения у пациентов (основная группа) были выявлены тромбозы, УЗИ вен нижних конечностей, подвздошных вен, дистального отдела нижней полой вены им проводились ежедневно.
В контрольную группу были включены 230 пациентов, которым УЗИ вен нижних конечностей, подвздошных вен, дистального отдела нижней полой вены проводились только непосредственно до начала специального лечения. В контрольной группе были 115 женщин, 115 мужчин, средний возраст пациентов контрольной группы составил 69 лет (от 60 до 75 лет).
Для обеих групп пациенты были отобраны в случайном порядке (с использованием таблицы случайных чисел). УЗИ вен нижних конечностей, подвздошных вен, дистального отдела нижней полой вены в обеих группах выполнялись по стандартному протоколу на ультразвуковых сканерах Logiq 7, Logiq 9 (General Electric, USA).
Распределение онкологических больных в контрольной и основной группах показано в табл. 1.
Таблица 1. Распределение онкологических больных в контрольной и основной группах

В основной группе после каждого ультразвукового исследования проводили анализ путем сопоставлений результатов текущего исследования с предыдущими с целью выявления следующих признаков эмбологенности:
- наличие признаков флотации, подвижности тромба;
- неоднородность (гетерогенность) эхоструктуры тромба;
- гипоэхогенность-анэхогенность структуры проксимального отдела (верхушки) тромба;
- неровность контуров проксимального отдела (верхушки) тромба;
- появление тромба на ранее интактном венозном сегменте;
- появление признаков флотации, подвижности ранее диагносцированных неподвижных, стабильных тромбов;
- изменение эхоструктуры тромба.
Результаты. Результаты УЗИ в контрольной и основной группах представлены в табл. 2, 3.
Таблица 2. Результаты ультразвуковых исследований в контрольной и основной группах

В большинстве случаев эмболоопасные тромбозы и тромбофлебиты имели сразу несколько признаков эмбологенности. Признаки эмбологенности тромбов в системе нижней полой вены, выявленные в ходе УЗИ, представлены в табл. 3.
Таблица 3. Признаки эмбологенности тромбов в системе нижней полой вены, выявленные в ходе УЗИ
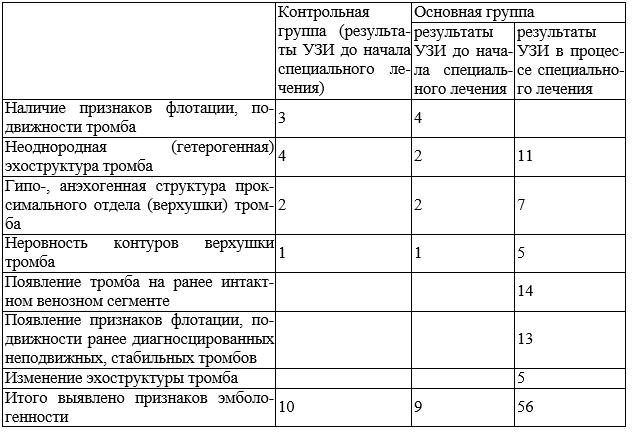
В основной группе хронические заболевания вен нижних конечностей отмечены у 31 пациента. Эмбологенные тромбозы в основной группе до начала специального лечения были выявлены у 5 пациентов, из них: тромбозы суральных вен, подколенной вены и дистального отдела поверхностной бедренной вены - 4, тромбофлебит проксимального отдела большой подкожной вены с переходом на сафенофеморальное соустье - 1. У 27 пациентов основной группы (в процессе специального лечения по поводу онкологического заболевания) были выявлены эмбологенные тромбозы. Из них: тромбозы суральных вен, подколенной вены, дистальной трети поверхностной бедренной вены – 15 (в трех случаях с флотацией проксимальной части тромб-масс), илеофеморальные тромбозы – 9 (в двух случаях с флотацией проксимальной части тромб-масс), тромбофлебиты большой подкожной вены с распространением тромб-масс на сафенофеморальное соустье – 3.
В контрольной группе хронические заболевания вен нижних конечностей были диагностированы у 26 пациентов. Эмбологенные тромбозы и тромбофлебиты в контрольной группе были выявлены у 6 пациентов, из них: тромбозы дистального отдела поверхностной бедренной и подколенной вен -2, илеофеморальные тромбозы - 2, тромбофлебит большой подкожной вены с распространением тромб-масс на сафенофеморальное соустье -1.Всего острые, эмболоопасные тромбозы и тромбофлебиты в основной группе были у 32 пациентов (до начала специального лечения – у 5, в процессе специального лечения – у 27), в контрольной группе у 6 пациентов. Во всех случаях выявления эмболоопасных тромбозов немедленно были предприняты соответствующие лечебно-профилактические мероприятия: имплантация кава-фильтра, тромбэктомия с парциальной окклюзией магистральных вен, перевязка вены выше эмбологенно опасного тромба, кроссэктомия и консервативное ведение под динамическими контрольными УЗИ вен нижних конечностей и подвздошных вен. В основной группе летальных случаев от ТЭЛА не было.
В контрольной группе у 7 пациентов в процессе проведения специального лечения было развитие ТЭЛА. Результаты проверки статистических критериев, основанных на применении t-критерия Стьюдента представлены в табл. 4 (t=3,9).
Таблица 4. Развитие ТЭЛА в контрольной и основной группах

Обсуждение. Проведение специального лечения по поводу онкологических заболеваний (хирургическое лечение, лучевая терапия, химиотерапия) существенно увеличивает риск тромбообразования в системе нижней полой вены. Для проведения целенаправленной профилактики ТЭЛА в этот период, существенное значение имеет достоверное выявление эмболоопасных тромбозов в системе нижней полой вены. Самыми частыми источниками ТЭЛА являются тромбозы вен нижних конечностей и подвздошных вен. Эмболоопасные тромбозы часто имеют неокклюзирующий характер. При неокклюзирующем тромбозе венозная гемодинамика существенно не страдает и часто пациенты с таким тромбозом специфических жалоб не предъявляют, а клинические проявления неокклюзирующего эмболопасного тромбоза бывают незначительными. Эмболопасные тромбозы достоверно могут быть выявлены только при инструментальных исследованиях. Динамические УЗИ вен системы нижней полой вены путем сопоставлений результатов текущего ультразвукового исследования с предыдущими позволяют достоверно определить эмболоопасные тромбозы.
Выводы. Проведение специального лечения по поводу онкологических заболеваний сопровождается высоким риском развития венозных тромбоэмболических осложнений у онкологических больных. В значительном большинстве случаев ТЭЛА развивается вследствие миграции тромбоэмболов из вен нижних конечностей, подвздошных вен. Достоверное установление эмболоопасности тромбозов способствует своевременному, целенаправленному выбору мер профилактики ТЭЛА. Признаки эмбологенности тромбов системы нижней полой вены у онкологических больных можно определить динамическими ультразвуковыми исследованиями в процессе специального лечения и путем сопоставления результатов этих исследований.
