Рак предстательной железы (РПЖ) является одним из самых распространенных злокачественных заболеваний среди мужчин. Ежегодно в мире выявляется до 900 тыс. новых случаев РПЖ. В структуре онкологической заболеваемости в мире доля РПЖ составляет 14% [4]. В России рак предстательной железы занимает второе место в структуре онкологической заболеваемости (после рака легких), доля его среди всех онкологических заболеваний составляет 10,7%. В 2009 г. стандартизированный показатель заболеваемости составил 24,8 на 100 тыс. населения [1]. В нашей стране активно внедряется ранняя диагностика РПЖ с помощью ПСА-теста, все больше пациентов с диагнозом РПЖ выявляется на профилактических осмотрах в ранних стадиях. Более 50% больных с впервые установленным диагнозом РПЖ имеют III-IY стадии заболевания. Пик заболеваемости РПЖ приходится на возраст 70-72 года. Большая часть пациентов в этом периоде жизни страдает серьёзными и множественными сопутствующими заболеваниями (сердечно-сосудистая, легочная патология). Следовательно, при выборе варианта лечения больных РПЖ взвешиваются возможность, доступность, переносимость методов лечения. Необходимо учитывать особенности контингента больных РПЖ, степень распространенности процесса. В настоящее время радикальными методами лечения локализованного РПЖ являются: радикальная простатэктомия, дистанционная лучевая терапия (ДЛТ) в комбинации с гормонотерапией, брахитерапия. При местнораспространенном РПЖ дистанционная лучевая терапия в комбинации с эндокринотерапией является методом выбора [2,6,7]. При генерализованном РПЖ используется гормональная терапия в качестве первой линии лечения, при ее неэффективности – проводится химиотерапия, а ДЛТ применяется в качестве паллиативного вида лечения [3,8]. С радикальной целью применяются три варианта лучевого лечения – дистанционная, контактная и сочетанная лучевая терапия. Из этих трех видов наиболее часто используется дистанционная мегавольтная лучевая терапия, проводимая на линейных ускорителях электронов (ЛУЭ) фотонным излучением с энергией различных уровней. В большинстве радиологических клиник России проводится конвенциональная (2D) лучевая терапия. Предлучевая подготовка при таком варианте лучевой терапии проводится на рентгеновских симуляторах по ортогональным рентгенограммам. При таком планировании лучевого лечении локализация предстательной железы и окружающих органов определялись чаще всего по костным ориентирам. Такой подход является достаточно грубым и приводит к необходимости включения в клинический объем облучения значительного объема окружающих нормальных тканей, т.к. его уменьшение значительно увеличивало вероятность ошибок. В настоящее время при проведении предлучевой подготовки для конвенциональной лучевой терапии по центру выбранного поля облучения проводится КТ-исследование с точным отображением всех органов-мишеней, органов риска на полученном срезе, определением плотностных характеристик тканей (при необходимости число срезов может быть увеличено), для каждого пациента изготавливается индивидуальный одноплоскостной анатомический срез, проходящий через центр выбранного поля облучения. При двухмерном планировании расчёт дозы проводится по центральному срезу. При подготовке к проведению конформной лучевой терапии используется объемное (трехмерное, 3D) планирование, позволяющее увидеть опухоль и критические органы в объёме, создать необходимое распределение дозы по всему объему мишени с максимумом в зоне опухоли и резким снижением к минимуму дозовых нагрузок в окружающих опухоль здоровых тканях. При проведении высокотехнологичной конформной лучевой терапии необходимо использовать все открывающиеся возможности современных спиральных КТ, МРТ, ПЭТ в сочетании с совершенствованием компьютерных программ объемного дозного планирования. Пациенту проводится компьютерная томография зоны предполагаемого облучения с шагом 2,5-5-10 мм. Шаг сканирования определяется в зависимости от конкретной клинической ситуации (так, при опухолях предстательной железы он чаще всего составляет 5мм). Компьютерные и магнитно-резонансные томографы, используемые для топометрической подготовки больных к лучевой терапии, имеют широкую апертуру и плоскую, как на ЛУЭ, деку стола (рис.1).

Рис. 1. Компьютерный томограф (фото слева) и магнитно-резонансный томограф (на фото справа)
При планировании лучевой терапии дополнительную ценную информацию о границах опухоли и критических структурах получают при МРТ-исследовании. В дальнейшем при планировании проводится слияние информаций от обоих методов исследований (КТ и МРТ) для более точного определения границ опухоли (рис. 2). Следующим этапом подготовки к лечению является расчёт дозного распределения с помощью специальных математических программ на компьютерных станциях. Процедура планирования состоит из выбора оптимального набора полей облучения с учетом веса каждого. При этом оптимальным считается тот план, для которого доза на опухоль максимальна, а на критические органы минимальна.
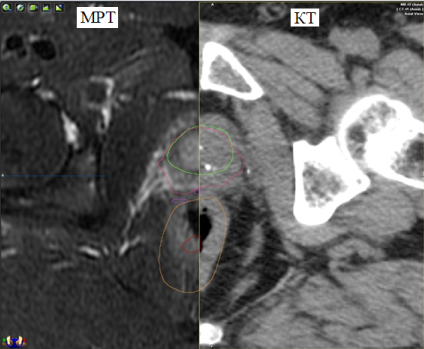
Рис. 2. Представлены КТ и МРТ-срезы пациента. Наглядно видны различия в объёмах при оконтуривании предстательной железы (зелёный контур выполнен по данным МРТ, а красный – по данным КТ)
Достижение такого дозного распределения, при котором планируемый лечебный объём был бы охвачен высокой однородной дозой, является важнейшей целью объемного планирования. Уже первые работы, давшие оценку внедрения 3-х мерной лучевой терапии, показали существенное улучшение ближайших и отдаленных результатов, а также снижение частоты и выраженности побочных эффектов радиотерапии [5, 9]. В нашей работе мы представляем анализ результатов комплексного эндокринолучевого лечения больных локализованным и местно-распространенным РПЖ.
Материалы и методы. За период с 2000 по 2006 г. в отделе радиационной онкологии НИИ клинической онкологии ФГБУ РОНЦ им. Н.Н. Блохина РАМН проведено лечение 127 больным раком предстательной железы в стадии Т2-Т4NХМ0, которые выбрали в качестве радикального варианта консервативное комбинированное лечение, включающее дистанционную лучевую терапию (ДЛТ) в комбинации с гормональной терапией. Возраст пациентов колебался от 46 до 83 лет, средний возраст - 66,5 года. Всем пациентам проведено стандартное клинико-рентгенологическое обследование, обязательно включающее: пальцевое ректальное исследование, ультразвуковое исследование таза включая трансректальное УЗИ предстательной железы, радиоизотопное исследование костной системы, КТ и МРТ, определение уровня простатспецифического антигена (ПСА). Диагноз РПЖ подтвержден во всех случаях морфологическим исследованием биоптатов из опухоли предстательной железы. Во всех случаях при гистологическом исследовании биоптатов выявлена аденокарцинома разной степени дифференцировки. По шкале Глисона в большинстве случаев (82,6%) – установлен статус 5-7 баллов; в 10,3% случаев - 8-10 баллов; в 7,1% случаев – 2-4 балла. По местному распространению заболевания пациенты распределялись следующим образом: у 24 (19,3%) – опухоль была ограничена капсулой предстательной железы (Т2), у 65 (51,4%) больных – имелась инвазия капсулы предстательной железы (Т3а), у 24(19,3%) пациентов – выявлена инвазия одного или обоих семенных пузырьков (T3в), и у 14(11%) пациентов определялось распространение опухоли на окружающие органы и ткани: мочевой пузырь, прямую кишку, стенки таза (Т4). Гормональную терапию получили 112 пациентов (88%). В большинстве случаев использовалась максимальная андрогенная блокада, реже проводилась монотерапия агонистами LH-RH или антиандрогенами. Длительность неоадьювантного периода эндокринотерапии составляла 2-6 месяцев, адьювантного 1,5 года в зависимости от степени риска. У 15 (12%) больных гормонотерапия не проводилась в связи с наличием сопутствующих заболеваний, отказе пациентов или отсутствием препаратов. Все 127 больных были разделены на 2 группы - контрольную и основную.
В контрольную группу вошли 53 пациента, прошедших конвенциональную дистанционную лучевую терапию с 2D планированием на ЛУЭ с двумя уровнями энергии фотонов 6 или 18 МэВ без многолепесткового коллиматора диафрагмы. Лучевая терапия проводилась РОД 2Гр, ритм облучения 5 дней в неделю. В объем облучения у больных с низким риском прогрессирования заболевания включалась предстательная железа, семенные пузырьки и перипростатическая клетчатка, у пациентов с умеренным и высоким риском - дополнительно к этому регионарные лимфатические узлы таза. Лучевая терапия проводилась по 4-польной методике (типа «бокс»), СОД- 44Гр. Затем ДЛТ продолжилась на область предстательной железы и семенных пузырьков методикой ротационного облучения в секторе ±120? РОД-2Гр до СОД 22-26 Гр. СОД за весь курс лучевого лечения составляла 66-70Гр.
Основную группу составили 74 больных, прошедших конформную лучевую терапию (3D CRT) с энергией 6 и/или 18 МэВ, РОД 2 Гр. Нужно отметить, что у больных обеих групп (2D и 3D CRT) различий в объёмах лучевого воздействия, РОД, СОД, условиях проведения I этапа лечения не отмечено (рис. 3). Далее лучевое лечение продолжалось на линейном ускорителе электронов «Siemens Primus» с наличием многолепесткового коллиматора. Чаще всего применялась 7-польная методика облучения (рис.5). СОД на предстательную железу, перипростатическую клетчатку и семенные пузырьки составляла 68Гр, локальное лучевое воздействие на предстательную железу продолжалось до СОД 72-76Гр. Данные изодозного распределения IIэтапа лучевой терапии больных основной группы представлены на рис. 4.

Рис. 3. Изодозное распределение в сагиттальной плоскости объема лучевого воздействия на первичную опухоль и зоны регионарного метастазирования при конформной (3D CRT)ЛТ

Рис. 4. А: Изодозное распределение в горизонтальной плоскости при конформной лучевой терапии использовали вариант 7-польной методики; Б: Реконструкция в сагиттальной плоскости объема лучевого воздействия включающего предстательную железу при конформной (3D CRT)лучевой терапии, по варианту 7- польной методики
С целью профилактики частоты и выраженности ранних и поздних лучевых повреждений больным как основной, так и контрольной группе лучевая терапия во время лучевого воздействия на зоны регионарного метастазирования проводилась на фоне вдыхания радиопротектора - гипоксической газовой смеси, содержащей 9% кислорода и 91% азота (ГГС-9). Для оценки степени риска возврата болезни у больных РПЖ мы использовали классификацию, разработанную National Comprehensive Cancer Network (2005) [Clinical Practice Guidelines in oncology, v.2, 2005.] по которой к группе низкого риска относятся пациенты со стадиями заболевания Т1-Т2аN0M0, PSA<10 нг/мл, Глисон <6; к группе промежуточного риска – пациенты со стадиями T2b,cN0M0, 20>PSA<10, Глисон 6; к группе высокого риска: Т3-4Nх,1M0, Глисон ?7.
Объем ЛТ и длительность гормонотерапии (ГТ) в обеих группах были определены по рекомендациям NCCN (National Comprehensive Cancer Network), версия 1.2006.
- Низкий риск - короткий курс неоадъювантной гормонотерапии (3 мес.) + ЛТ до СОД 72-78 Гр (объем облучения – ПЖ + семенные пузырьки); адъювантная ГТ заканчивается через 1 месяц после окончания ЛТ;
- Умеренный риск - неоадъювантная гормонотерапия 3-6 месяцев + ЛТ COД 74-78 Гр (объем ЛT – ПЖ и семенные пузырьки); адъювантный период ГТ 2-3года;
- Высокий риск и очень высокий риск - неоадъювантная гормонотерапия 3-6 месяцев + ЛТ COД 74-78 Гр (объем ЛT - ПЖ и семенные пузырьки, зоны регионарного метастазирования), адъювантная гормонотерапия - 3 года.
Распределение больных по группам риска представлено на рис. 5.
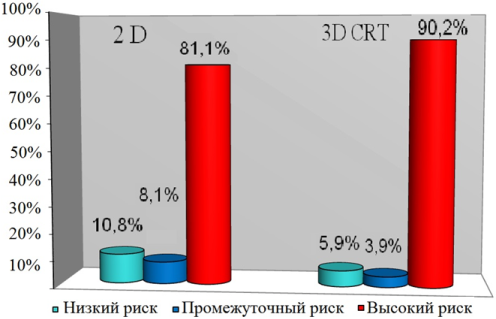
Рис. 5. Распределение больных по группам риска возврата болезни
Как видно из данных, представленных на рис. 5, в основной группе пациентов с высоким риском прогрессирования было больше чем в контрольной (90,2% и 81,1%, соответственно), а с низким риском меньше (5,9% и 10,8%, соответственно), что указывает на худший прогноз у больных в основной группе по сравнению с контрольной. Эффективность лечения оценивали в соответствии с последними рекомендациями EORTC по данным клиники, и обследования включающего определение уровня ПСА каждые 3 месяца после окончания ЛТ.
Результаты и обсуждение В нашем исследовании среди пациентов всей группы наблюдения в процессе облучения ранние лучевые повреждения II-III степени RTOG-EORTC диагностированы у 34 (26,7%) пациентов. Из них у 18 (14,2%) больных зарегистрированы только явления лучевого цистита, у 5 (3,9%) человек - только ректиты. При этом у 2 (1,6%) – геморрагические ректиты. У 9 (7,1%) пациентов имело место сочетание цистита с ректитом. В контрольной группе (2D RT) вынужденный перерыв в лечении был сделан у 27 (51%) пациентов вследствие появления ранних лучевых повреждений со стороны окружающих здоровых тканей. Медиана продолжительности вынужденного перерыва в лечении составила 10,5 дней. Выраженность ранних лучевых повреждений оценивалась по градации RTOG-EORTC и в большинстве случаев была II степени. Ректит был отмечен у 9,4% больных, цистит – у 24,5%, сочетание цистита с ректитом – у 15,1% (у одного из больных этой подгруппы был зафиксирован геморрагический ректит). Ранние лучевые повреждения на момент окончания полного курса 2D RT отмечены у 21 (39,7%) пациентов: цистит – у 8 (15,1%) человек, сочетание ректита с циститами – у 9 (17%) пациентов и у 4 (7,5%) человек - ректит. Во второй группе (3D CRT) вынужденный перерыв в лучевом лечении, медиана которого составила 8 дней, был установлен у 7 (9,5%) больных вследствие появления ранних лучевых повреждений II степени: геморрагического ректита и сочетание цистита с ректитом у одного пациента, цистита – у 6,8%. Ранние лучевые повреждения на момент окончания лучевого лечения отмечены у 25 (33,8 %) человек: цистит – у 14(18,9%) пациентов, сочетание цистита с ректитом – у 6 (8,1%) пациентов, и у 5 (6,7%) человек были явления ректита. Поздние лучевые повреждения в группе больных, получавших 3D CRT, отмечены у 3 (4,1%) пациентов, которые проявлялись в виде циститов. Поздние лучевые повреждения в группе конвенциональной 2D RT лучевой терапии отмечены у 7 (13,2%) больных в сроки от 5 до 47 месяцев после окончания ЛТ, которые проявлялись в виде циститов и у 2-их пациентов – стриктура уретры. Ранние и поздние лучевые повреждения оценены по RTOG-EORTC как проявления II степени тяжести. Интенсивность их соответствовала II -III степени тяжести по RTOG-EORTC.
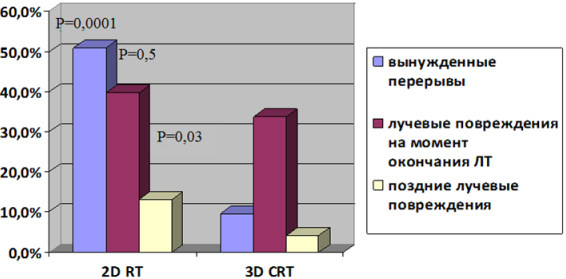
Рис. 6. Частота развития вынужденных перерывов, ранних и поздних лучевых повреждений при 2D RT и 3D CRT лучевой терапии
Из данных, представленных на рисунке 6, видно, что достоверно чаще вынужденные перерывы в лечении (р=0,0001) были у пациентов в группе с конвенциональной лучевой терапией. Длительность перерывов в лучевом лечении у больных всей группы без вдыхания ГГС-9 колебалась от 3 до 27 дней (медиана - 14 дней), в группе больных, получавших гипоксирадиотерапию от 5до 11 дней (медиана – 9 дней), р=0,09. Обращает на себя внимание, что среди пациентов (n=63), которым проводилась радиотерапия без использования ГГС-9, перерывы пришлось сделать 28 (44,4%) пациентам, в то время как у получавших гипоксирадиотерапию (n=64) перерывы в ЛТ были только у 7 (10,9%) больных, р=0,0001, (рис. 7).
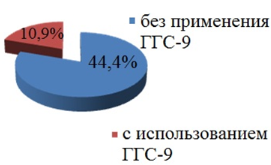
Рис. 7. Вынужденные перерывы в курсе лучевого лечения среди всех больных в зависимости от использования ГГС-9 Проведенный нами анализ частоты и выраженности вынужденных перерывов позволил установить, что вынужденный перерыв в ЛТ как при 2D RT, так и при 3D CRT был чаще у больных которым не использовалась ГГС-9 (рис. 8).
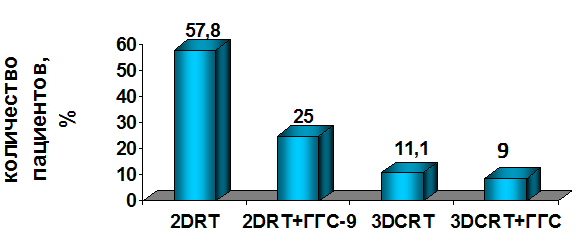
Рис.8. Частота перерывов в лучевом лечении в подгруппах в зависимости от использования радиопротектора ГГС-9 Анализ результатов, представленных на рис.8, показал, что вынужденный перерыв, при 3DCRT, был сделан у 2 (11,1%) больных без использования радиопротектора ГГС-9 и у 5 (8,9%) из 56 пациентов при вдыхании гипоксической газовой смеси ГГС-9, среди 53 больных, получавших конвенциональную 2D RT, перерывы были зафиксированы у 26 (57,8%) больных не получавших ГГС-9 и у 2 (25%) больных при вдыхании ГГС-9 во время ЛТ (р=0,005). Таким образом, анализируя результаты лечения 127 больных РПЖ T2-4 NxMo стадий, можно сделать вывод о преимуществах проведения конформной 3D CRT в сравнении с 2D RT, проявляющихся в достоверном уменьшении частоты и длительности вынужденных перерывов в лечении, в достоверном снижении частоты ранних и поздних лучевых повреждений. Дополнительное вдыхание гипоксической газовой смеси ГГС-9 в группе с 3D CRT позволило практически всем больным провести лечение без вынужденного перерыва. Анализ результатов лечения больных обеих групп продолжается, результаты исследования будут изложены в последующих работах.
