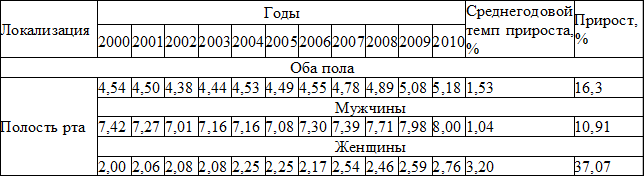
Среди злокачественных опухолей головы и шеи, плоскоклеточный рак слизистой оболочки органов полости рта является одним, из наиболее распространенных и по частоте занимает второе место после рака гортани. Исследования последних лет свидетельствуют о росте заболеваемости злокачественными опухолями полости рта, за последнее десятилетие прирост заболеваемости в Российской Федерации составляет 16,3% (табл. 1) [10].
Таблица 1. Динамика заболеваемости населения России раком слизистой оболочки полости рта в 2000-2010 г.
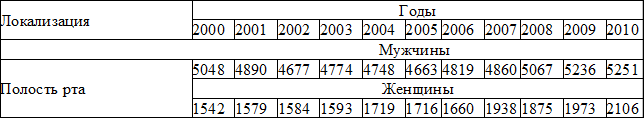
Наряду с растущими цифрами заболеваемости злокачественными опухолями полости рта, имеется тенденция к её увеличению у лиц более молодого возраста, преимущественно у мужчин в возрасте от 30-60 лет [12]. Рак слизистой оболочки полости рта встречается у мужчин приблизительно три раза чаще по сравнению с женщинами. Также следует отметить, что рак слизистой оболочки полости рта встречается чаще у людей старшего возраста, что является фактором риска этого заболевания среди пожилых людей (табл. 2).
Таблица 2. Абсолютное число впервые в жизни установленных диагнозов рак слизистой оболочки полости рта в России в 2000-2010 г.
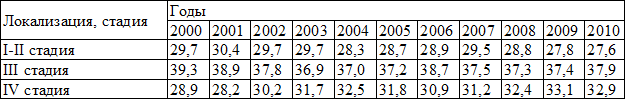
По результатам эпидемиологических исследований и данным Американского общества по изучению рака (American Society of Clinical Oncology (ASCO)) большая часть злокачественных опухолей слизистой полости рта связана с курением, злоупотреблением алкоголем, а также, инфицированием слизистой полости рта вирусом папилломы человека (ВПЧ), что представляет высокий риск развития определенных видов рака головы и шеи [13]. По данным статистических исследований отмечается поздняя обращаемость пациентов страдающих раком слизистой оболочки полости рта, несмотря на то, что полость рта легко доступна для визуального осмотра, более 2/3 больных обращаются за специализированной помощью на III или IV стадии опухолевого процесса, когда выявляются регионарные и отдаленные метастазы (табл. 3,4) [7,8].
Таблица 3. Удельный вес больных с раком слизистой оболочки полости рта, выявленных при проведении профилактических осмотров в России в 2000-2010 г., % (оба пола)

Таблица 4. Удельный вес больных с впервые установленным диагнозом рак слизистой оболочки полости рта, обратившихся на разных стадиях заболевания в России в 2000-2010 гг., % (оба пола)
Среди вновь выявленных больных раком слизистой оболочки полости рта 50% вскоре будут иметь локальный рецидив и отдаленные метастазы [7]. Имеется тенденция к росту смертности от рака слизистой оболочки органов полости рта в Российской Федерации [10]. По данным Всемирной организации здравоохранения (ВОЗ) летальность от рака органов полости рта занимает четвертое место после рака легкого, желудка и колоректального рака [2]. Следует отметить, что плоскоклеточный рак слизистой оболочки полости рта относится к группе онкологических заболеваний с неблагоприятным течением болезни. Подтверждением тому, является высокая смертность в течение первого года после установки диагноза, высокий процент развития локорегионарных метастазов, рецидивов болезни и в отдельных случаях развитие отдаленных метастазов с крайне неблагоприятным прогнозом (табл. 5). Наличие метастазов в регионарных лимфатических узлах у больных плоскоклеточным раком слизистой оболочки полости рта значительно снижает показатели 5-летней выживаемости с 74 до 38% [15].
По данным литературы, 5-летняя выживаемость в случае рака органов полости рта:
I стадии (комбинированного или комплексного лечения) составляет 75%-80%,
II стадии - 50-60%, в случае использования комбинированного лечения при наличии рака.
III стадии - 30-40%. Большая часть больных погибают от локальных рецидивов и/или регионарных метастазов в первые 2 года от начала лечения [14,15].
Таблица 5. Летальность больных в течение года с момента установления диагноза рак слизистой оболочки полости рта в России в 2000-2010 г., оба пола, %

Лечение данной группы больных представляет собой сложную и далеко не всегда разрешимую проблему. Трудности в лечении этой группы больных объясняются биологическими особенностями и закономерностями роста и развития опухоли. Даже на современном уровне знаний невозможно дать исчерпывающее определение сущности опухолевого роста как биологического процесса. В значительной степени это относится к больным злокачественными опухолями челюстно-лицевой области. Сложные анатомо-физиологические взаимоотношения органов этой области, многообразие генеза опухолей полости рта, лица и челюстей, делают лечение этой группы больных особенно сложной.
В настоящее время, схема лечения пациента составляется с учетом основных клинико-морфологических признаков заболевания, а именно:
- размер и распространенность первичного очага опухоли.
- степень ее дифференцировки.
- наличие метастазов в регионарных лимфатических узлах.
- прорастание капсулы опухоли.
- наличие опухолевых эмболов в кровеносных сосудах.
Все перечисленные характеристики опухоли определяют выбор индивидуального плана лечения. К сожалению, современная противоопухолевая терапия имеет ряд существенных недостатков, одним из которых является эмпирический характер ее назначения. Анализ ближайших и отдаленных результатов хирургического, лучевого и химиолучевого лечения больных раком слизистой оболочки полости рта свидетельствует о неоднозначности выше указанных факторов прогноза и настоятельно требует изучения и внедрения в практику новых характеристик опухоли [1]. В связи с этим не теряет своей актуальности поиск новых подходов к оценке биологического поведения опухоли, а также возможность прогнозирования течения заболевания и индивидуализация схем лечения для каждого пациента. В соответствии с современными представлениями, злокачественную опухоль можно рассматривать как заболевание клетки, в основе которого лежит повреждение ее генома, вследствие чего возникает нарушение четко сопряженных в нормальной клетке процессов пролиферации и дифференцировки в сторону усиления пролиферации, снижение способности к физиологическому механизму гибели клеток - апоптозу - программе самоликвидации, заложенной в геноме всех клеток [4]. Исходя из вышесказанного, клиническое течение заболевания является отражением биологического поведения опухоли, реализации её генетического потенциала и взаимодействия с организмом-носителем [ 3, 16].
Известно, что плоскоклеточный рак слизистой оболочки полости рта характеризуется молекулярно-биологическими особенностями, а клиническая картина опухоли тесно связана с таким биологическим признаком как степень ее агрессивности [5]. Таким образом, прогноз плоскоклеточного рака слизистой оболочки полости рта определяет целый ряд клинико-морфологических и молекулярно-биологических факторов. В настоящее время известно большое количество молекулярно-генетических маркеров, которые являются показателями биологической активности раковых клеток и могут быть использованы в качестве прогностических критериев в онкологической клинике. [3] В этой связи пристального внимания заслуживают мутации и инактивации генов, продукты которых принимают участие в пролиферации и апоптотическом ответе клетки на повреждение дезоксирибонуклеиновой кислоты (ДНК). Мутации генов супрессоров и генов регуляторов клеточного цикла являющиеся причиной ряда человеческих опухолей вызывают как потерю опухоль супрессорной функции, так и возрастание потенциала онкогенной трансформации. В норме, когда изменения в химической структуре ДНК не могут быть устранены системой репарации, запускается программа апоптоза или остановки клеточного цикла. Однако интенсивность этих процессов может колебаться в достаточно широком диапазоне, что во многом определяется генетической конституцией индивидуума. Таким образом, нарушение функции процессов репаративной регенерации ДНК клетки и пониженная эффективность работы апоптотических каскадов и может привести к накоплению в организме клеток, содержащих мутации в онкогенах или генах супрессорах, что, безусловно сопряжено с увеличением онкологического риска [6,11,16].
С целью определения значимости изменений экспрессии в генах участвующих в жизненном цикле клетки, нами проведено исследование иммуногистохимических маркеров в биоптатах пациентов страдающих раком слизистой оболочки полости рта, а именно:
1. Для изучения пролиферативного потенциала опухоли белок Ki-67.
2. Для определения апоптотической активности фермент caspase 3
3. Для изучения потенциала репаративной регенерации поврежденной ДНК, фермент excision repair cross-complementing (ERCC1).
Проведено исследование двух групп пациентов: первая группа состояла из 20 пациентов у которых наблюдался рецидив рака слизистой оболочки полости рта, вторая группа состояла из 20 пациентов у которых не отмечен рецидив рака слизистой оболочки полости рта. Исследование проводилось иммуногистохимическим методом, в качестве исследовательского материала использовались парафиновые блоки первичной биопсии и послеоперационного препарата. Исследование маркеров проводилось на разных этапах противоопухолевого лечения. В каждой группе проведен анализ уровня экспрессии генов белок Ki-67, caspase-3 и ERCC1. Влияние значений экспрессии перечисленных генов на общую и безрецидивную выживаемость.
Получены следующие результаты:
- Во всех проведенных комбинациях сопоставления клинико-морфологических признаков и уровня значение экспрессии Кi-67, отмечается более высокие показатели пролиферативной активности клеток опухолевой ткани в первичном анализе.
- Практически двукратное снижение значения экспрессии Кi-67 после проведенной терапии, что может указывать на угнетение пролиферативного потенциала под влиянием полихимиотерапии.
- Пролиферативная активность опухолевых клеток выше у пациентов с рецидивом заболевания после проведенного лечения что подтверждается статистически значимыми показателями р=0,019, также наблюдается тенденция более высоких показателей экспрессии Кi-67 у пациентов с рецидивом заболевания.
- Низкое значение экспрессии Кi-67 у пациентов, обратившихся на четвертой стадии заболевания до и после лечения, что возможно является показателем низкого пролиферативного потенциала в первичном очаге на поздних стадиях заболевания.
- Длительность периода общей и безрецидивной выживаемости меньше у пациентов со значением экспрессии Кi-67 выше 45%.
- Во всех проведенных комбинациях сопоставления клинико-морфологических признаков и уровня значение экспрессии caspase 3, отмечается более высокие показатели экспрессии caspase 3 в первичном анализе.
- Экспрессия caspase 3 выше у пациентов без рецидива заболевания как до, так и после лечения, что подтверждается статистически значимыми показателями до лечения р=0,0033, после лечения р= 9•10-5.
- Более высокое значение экспрессии caspase 3 у пациентов, обратившихся на четвертой стадии заболевания, до и после лечения, что возможно является показателем более высокой активности процессов апоптоза в первичном очаге на поздних стадиях заболевания.
- У пациентов со значением экспрессии caspase 3 выше и равное 4%, период общей и безрецидивной выживаемости длиннее.
- Во всех проведенных комбинациях сопоставления клинико-морфологических признаков и уровня значение экспрессии ERCC1, отмечается более высокие показатели пролиферативной активности клеток опухолевой ткани в первичном анализе.
- Активность фермента ERCC1 опухолевых клеток выше у пациентов с рецидивом заболевания, как, в первичном анализе, так и после проведенного лечения, данный результат подтверждается статистически значимыми показателями р=0,0016. Такой результат может указывать на то, что более высокая активность ферментов репаративной регенерации нивелирует эффект воздействия препаратов платины на опухолевые клетки.
- Низкое значение экспрессии ERCC1 у пациентов, обратившихся на более поздних, третьей и четвертой стадиях заболевания до и после лечения, что возможно является показателем низкого потенциала фермента участвующего в процессе репаративной регенерации в первичном очаге на поздних стадиях заболевания.
- Период общей и безрецидивной выживаемости длиннее при более низких значениях экспрессии ERCC1.
Анализ изменения в генах опухолевых клеток, течения заболевания, чувствительности к проводимой терапии, вероятно, позволит дать прогноз течения заболевания на этапе планирования лечения, позволит индивидуализировать подходы к лечению заболевания. Вместе с тем, значение большинства этих факторов окончательно не изучено у больных раком слизистой оболочки полости рта. Стало быть, одновременный, многофакторный анализ уровня экспрессии ключевых компонентов систем пролиферации, апоптоза, чувствительности к проводимой терапии в опухолях больных плоскоклеточным раком слизистой оболочки полости рта, определяет несомненную актуальность таких исследований, так как позволяет оценить характер этих опухолей, клиническую динамику на этапах специального лечения, выделить пациентов с высоким риском развития раннего рецидива, достоверно оценить эффективность проводимого лечения.
