Рак молочной железы (РМЖ) в течение многих лет удерживает первое место в структуре онкологической заболеваемости женского населения России, составляя 20,4%. В связи с неуклонным ростом заболеваемости, проблема лечения больных РМЖ, на сегодняшний день, приобретает особенно большое значение [1]. В соответствии с современными представлениями в лечении данной патологии должен преобладать комплексный подход, важнейшим компонентом которого является лучевая терапия. В качестве метода локального воздействия, послеоперационная лучевая терапия, проводимая у пациенток, перенесших радикальную мастэктомию (РМЭ), снижает риск возникновения местного и регионарного рецидива с 32-35% до 8-9%. Анализ литературных данных позволяет утверждать, что проведение лучевой терапии в послеоперационном периоде обеспечивает высокие показатели не только безрецидивной, но и общей выживаемости [4,5,10,15,16]. Несмотря на убедительность данных, свидетельствующих об эффективности адъювантной лучевой терапии (АЛТ), остается ряд нерешенных вопросов. В первую очередь это касается определения категории больных, нуждающихся в проведении АЛТ и выбора объема тканей, подлежащих облучению.
В соответствии с общепринятым подходом, адъювантная лучевая терапия после РМЭ однозначно показана больным с размером первичного опухолевого очага от 5 см и выше, а также с наличием четырех и более метастатических аксиллярных лимфатических узлов, подтвержденных результатами морфологического исследования [7,9,19]. Спорным остается вопрос, касающийся целесообразности проведения АЛТ больным при опухолях меньшего размера и наличии от одного до трех лимфоузлов, пораженных метастазами (N1). Стандартное назначение АЛТ для этой категории пациенток считается не оправданным ввиду достаточно низкой частоты локо – регионарного рецидивирования [8,17,18,19]. В этой связи, в последнее время большое внимание уделяется дифференцированному подходу к лучевой терапии, основанному на клинико–морфологических и молекулярно – генетических факторах, определяющих высокий риск развития локо – регионарного рецидива РМЖ. В настоящее время в зарубежной литературе представлены данные, в которых, при определении показаний к проведению лучевой терапии, подчеркивается необходимость учета таких прогностически неблагоприятных факторов, как молодой возраст больных (до 35 лет), состояние сохраненной менструальной функции, размер первичной опухоли, II-III степень дифференцировки новообразования, наличие опухолевых клеток по краю кожных лоскутов после выполнения РМЭ, количество лимфатических узлов, пораженных метастазами, прорастание опухолью капсулы лимфоузла, наличие лимфоваскулярной инвазии, отсутствие рецепторов к эстрогену и к прогестерону [2, 14, 18, 20].
Дискутабельным остается вопрос, касающийся определения объема тканей, подлежащих облучению. Известно, что после выполнения РМЭ область передней грудной стенки является зоной высокого риска в отношении развития местных рецидивов опухоли. Поэтому при наличии таких показаний, как размер первичного очага более 5 см, прорастание опухолью фасции большой грудной мышцы и\или наличие опухолевых клеток по краю кожных лоскутов после выполнения РМЭ, передняя грудная стенка должна быть включена в объем облучения [7,9,19]. В случае же небольшой распространенности опухолевого процесса, требуется индивидуальный подход к выбору объема лучевой терапии, с учетом дополнительных неблагоприятных факторов риска [11,12]. Единой же точки зрения в интерпретации и практическом использовании вышеуказанных признаков при определении показаний к назначению АЛТ нет.
Еще одним неоднозначным вопросом является определение зон регионарного лимфооттока, на которые должно быть проведено лучевое воздействие. Традиционно, метастатическое поражение 4 и более аксиллярных лимфоузлов (N2-3), подтвержденных морфологическим исследованием, является показанием для адъювантной лучевой терапии на все зоны лимфооттока: подмышечную, парастернальную и над-подключичную области. В случае регионарной распространенности опухоли N1, однозначной точки зрения нет. Ряд авторов полагает оправданным проведение лучевой терапии на все зоны лимфооттока при наличии метастатических лимфоузлов, независимо от их количества (от 1 до 3) [13,16]. Однако большинство специалистов в области лучевой терапии считают такой вариант лечения не целесообразным ввиду высокой вероятности осложнений после облучения [3,6]. Поэтому не теряет своей актуальности индивидуальный подход к выбору показаний и объема АЛТ у больных РМЖ, основанный на учете прогностических факторов.
Целью настоящего исследования явился сравнительный анализ результатов комплексного лечения больных РМЖ после радикальной мастэктомии с применением различного объема адъювантной лучевой терапии и определение показаний к АЛТ с учетом клинико–морфологических факторов прогноза.
Материалы и методы. В исследование были включены 115 пациенток с операбельным раком молочной железы T1-3N0-3M0, получавших комплексное лечение в отделениях общей онкологии и радиологии ФГБУ «НИИ онкологии» СО РАМН. Возраст больных варьировал от 28 до 76 лет, средний составил 53,8±1,8 лет.
В плане комплексного лечения пациентки получали 2-4 курса неоадъювантной химиотерапии по схемам: CMF, FAC; хирургическое вмешательство проводилось в объеме радикальной мастэктомии; адъювантная химиотерапия по вышеуказанным схемам, а при наличии положительного рецепторного статуса - антиэстрогенная терапия в течение 5 лет. Всем больным была проведена послеоперационная дистанционная лучевая терапия.
В зависимости от применяемого объема и вида адъювантной лучевой терапии больные были распределены на две группы.
В I группе (n-55, исторический контроль) пациенткам проводилась дистанционная лучевая терапия (ДЛТ) только на зоны регионарного лимфоотока в стандартном режиме фракционирования: разовая очаговая доза (РОД) – 2,0 Гр, 5 раз в неделю, суммарная очаговая доза (СОД) - 40-44 Гр.
Во II группе (n-60) курс лучевой терапии включал в себя помимо облучения зон лимфооттока проведение электронной терапии на область послеоперационного рубца на малогабаритном бетатроне 7-10 МэВ в режиме: РОД-3,0 Гр, 5 фракций в неделю, СОД-38-44 изоГр.
Изучаемые группы больных были репрезентативны по распространенности опухолевого процесса.
Методика лучевой терапии. Лучевая терапия быстрыми электронами проводилась на область послеоперационного рубца, на малогабаритном бетатроне с энергией 7-10 МэВ, при этом 80% изодоза располагалась на глубине 2-2,5 см от поверхности поля облучения. Размеры полей облучения на послеоперационный рубец (в проекции ложа удаленной опухоли), составляли 6х6-6х18 см2. Режим фракционирования дозы быстрых электронов: РОД – 3,0 Гр, 5 фракций в неделю, СОД 38-44 изоГр [2].
Проведение ДЛТ на зоны регионарного лимфооттока осуществлялось на аппаратах «Рокус-М», линейном ускорителе Siemens SL 75 6 МэВ, в стандартном режиме фракционирования дозы, СОД – 40-44 Гр, с прямых полей облучения, размеры составили:
10х8 см – для над-подключичной области, 6х6-6х8 см – для аксиллярной зоны, 5х12-6х12 см – для парастернальной зоны
Оценка лучевых изменений нормальных тканей проводилась по шкале RTOG/EORTC (1995).
Статистическая оценка результатов проводилась с помощью пакета программ «Statistica 6.0». Для межгруппового сравнения использовались непараметрические критерии. Показатели выживаемости больных рассчитывались по методу Kaplan-Meier. Многомерный анализ данных для построения прогностической модели данных проводился в программе SPSS v17.0. В качестве метода анализа данных была выбрана логистическая регрессия. Получение прогностической модели проводилось итерационным способом, до тех пор, пока в итоговой модели не остаются только статистически значимые коэффициенты регрессии. Экспонента от коэффициента регрессии интерпретировалась как значения относительных рисков для соответствующих показателей.
Результаты и обсуждение. Анализ отдаленных результатов лечения показал, что за 5-летний период наблюдения местные рецидивы РМЖ значительно реже выявлялись у больных, получивших курс АЛТ не только на зоны регионарного лимфооттока, но и на область послеоперационного рубца - в 6,6%, в то время как у пациенток I группы этот показатель был практически в 3 раза выше и составил – 18,1% (p<0,05) (табл. 1).
Таблица 1. Частота и сроки появления местных рецидивов у больных РМЖ в зависимости от объема АЛТ

Примечание: * – различия между группами статистически значимы (p<0,05)
Следует отметить, что у больных, которым не проводилось облучение передней грудной стенки, наиболее часто рецидивы РМЖ диагностировались в первые два года после операции. Во второй группе отмечено более равномерное распределение количества местных рецидивов за аналогичный период наблюдения.
Каких-либо клинических особенностей роста рецидивных опухолей в зависимости от объема лучевого воздействия отмечено не было. У больных обеих групп были диагностированы, преимущественно, единичные опухолевые узловые образования, размеры которых в большинстве случаев не превышали 1 см в диаметре, локализующиеся в области средней трети послеоперационного рубца. При этом, в группе больных без облучения послеоперационного рубца в 3-х случаях диагностировались повторные рецидивы в той же области, у пациенток II группы повторного местного прогрессирования не наблюдалось.
Пятилетняя безрецидивная выживаемость у больных с проведением лучевой терапии на область послеоперационного рубца составила 93,8±3,5, тогда как в группе с облучением только зон регионарного лимфооттока, она была значительно ниже – 79,5±6,1% (p<0,05).
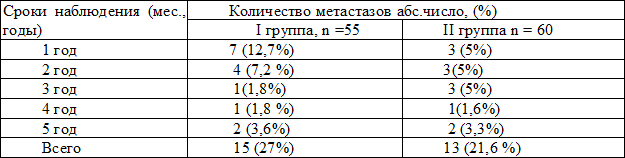
Метастатическое поражение внутренних органов развилось у 15 (27%) больных I группы и у 13 (21,6%) - II-й (p>0,05). Обращает на себя внимание тот факт, что по результатам морфологического исследования более чем у половины этих пациенток исходно определялось обширное лимфогенное метастазирование (N2-3).
Наиболее часто у пациентов обеих групп метастазы РМЖ локализовались в костях – 16%. Поражение печени было выявлено у 8 (7,2%) больных, легких в 5 (4,8%) наблюдениях. Значимых различий при оценке гематогенных метастазов по группам выявлено не было (табл. 2).
Таблица 2 . Частота и сроки появления отдаленных метастазов у больных РМЖ
Пятилетняя безметастатическая выживаемость в обеих группах была практически одинакова и составила 74,2±6,7% у больных без облучения послеоперационного рубца и 75,8±6,9% - при проведении полного объема АЛТ (р>0,05).
Показатели общей выживаемости за пятилетний период наблюдения составили соответственно - 86,8±5,5% в первой группе больных и 90,3±8,6% во второй.
При анализе полученных различий по частоте рецидивов РМЖ в зависимости от объема проведенной лучевой терапии, нами выявлено, что несмотря на проведенный курс адъювантной лучевой терапии в полном объеме, у 4 больных II группы были выявлены местные рецидивы опухоли и их появление ассоциировалось с исходно обширным опухолевым поражением (T2N2M0 и T3N2M0). У больных I группы наблюдалась несколько иная картина.
Так, в 37,5% наблюдений, рецидивы были диагностированы при размере первичного опухолевого очага не превышающего 5 см и наличии менее четырех метастатических лимфоузлов (Т1-2N1). Данное обстоятельство указывает на тот факт, что на возникновение местного рецидива оказывает влияние не только распространенность опухолевого процесса, но и ряд клинико–морфологических критериев.
При однофакторном анализе в нашем исследовании было выявлено, что наиболее значимыми параметрами, определяющими высокий риск развития местного рецидива явились возраст пациенток до 40 лет (р=0,05), сохраненная менструально–овариальная функция (р=0,036), высокая степень злокачественности опухоли (р=0,001), мультицентричный характер роста опухоли (р=0,04), а также отрицательный статус рецепторов к эстрогену (р=0,028) и прогестерону (р=0,04).
При многомерном анализе было показано, что такими значимыми критериями явились лишь мультицентричный характер роста опухоли (р=0,005), III степень злокачественности (р=0,001), а также наличие метастатических лимфатических узлов в количестве от 1 до 3.
В результате анализа данных была построена прогностическая модель, оценивающая вероятность проявления рецидива в зависимости от сочетания факторов риска. Модель основана на статистически значимых коэффициентах, рассчитанных методом логистической регрессии, и представлена в виде формулы:
![]()
где x1 - III степень злокачественности; x2 - мультицентричный характер роста опухоли; x3 – число метастатических лимфоузлов более 4 (N2); x4 - наличие метастатических лимфатических узлов в количестве от 1 до 3.
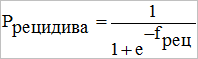
Чувствительность метода составила 90%, специфичность – 54%.
Полученные данные позволяют предположить высокую вероятность развития рецидива РМЖ у больных с наличием представленных выше факторов, что в свою очередь, может служить значимым основанием для проведения адъювантной лучевой терапии.
Выводы. Таким образом, дополнительное проведение адъювантной лучевой терапии на область послеоперационного рубца, оказало положительное влияние на показатели безрецидивной выживаемости и обеспечило адекватный локо–регионарный контроль. Полученные результаты позволяют полагать, что при определении показаний к планированию оптимального объема АЛТ недостаточно опираться на стандартные критерии, оценивающие лишь распространенность опухолевого процесса. Необходимо принимать во внимание дополнительные значимые клинико–морфологические факторы, сопряженные с высоким риском развития местного рецидива опухоли, что позволит персонифицировать подходы к назначению адъювантной лучевой терапии.
