Введение. Колоректальный рак занимает одно из ведущих мест в структуре онкологической заболеваемости во всех развитых странах. Так, в Европе и США злокачественные новообразования толстой кишки занимают второе место по распространённости и имеют вторую по величине летальность [18]. На сегодняшний день статистические данные свидетельствуют о том, что в России колоректальный рак занимает одну из ведущих позиций. За последние 20 лет рак толстой кишки переместился в структуре онкологической заболеваемости населения Российской Федерации с 6-го на 3-е место [4].
Рост заболеваемости ведет к увеличению количества операций. Наиболее опасными и непредсказуемыми в абдоминальной онкохирургии являются операции на толстой кишке. Они до сих пор сопровождаются достаточно большим числом послеоперационных осложнений и смертельных исходов [3].
Основной проблемой этих операций остается несостоятельность кишечного анастомоза, которая по данным разных авторов составляет от 1,6%-28,4% [1, 17].
Послеоперационная летальность остается достаточно высокой и достигает 23,8% [2, 11].
Основная причина послеоперационной летальности, несомненно, кроется в качестве шовного материала, технике и технологических особенностях формирования шва.
В настоящее время основным видом хирургического шва толстой кишки в силу своей простоты и доступности, является ручной узелковый шов. Однако, не следует забывать, что ему присущи многие недостатки: краевое нарушение кровоснабжения тканей анастомоза, их ишемия и некроз, что в свою очередь приводит к функциональным, не редко анатомическим нарушениям оперируемого органа [7]. Кроме того, шовный материал, используемый в хирургической практике обладает целым рядом отрицательных качеств: отсутствием биосовместимости, биодеградации, прочности и атравматичности, наличием "пилящего" эффекта. Фитильность нитей, выраженная реакция тканей в виде некроза в зоне соустья и возникновение септического процесса с обязательным заживлением тканей вторичным натяжением приводит нередко к рубцовому сужению кишечного соустья [9, 12]. Анастомозы, сформированные ручным способом, бактериально проницаемы при физической герметичности, что вызывает спаечный процесс и даже перитонит [6, 13].
В середине XX века, созданные в СССР сшивающие скрепочные аппараты, а чуть позже, более совершенные зарубежные аналоги, не смогли улучшить результаты операций на желудочно-кишечном тракте [5, 16].
И все-таки, несмотря на постоянное совершенствование механического шва, основным недостатком его является сквозное прошивание стенок кишки со всеми вытекающими последствиями и осложнениями [8, 10, 14].
Все это заставляет хирургов искать новые пути решения проблемы анастомозирования толстой кишки.
Более трех десятилетий в нашей стране и за рубежом усиленно возрождается идея бесшовного – компрессионного анастомоза.
До настоящего времени, компрессионный кишечный анастомоз формировали при помощи различных устройств: аппараты АКА-2, АСК-01, Valtrac, CAR-27, из никилид-титановой проволоки и т.д. Но все перечисленные компрессионные устройства требуют конструктивных доработок, хотя и применяются в хирургии толстой кишки с заметным успехом [15, 19].
В силу этих обстоятельств и имея положительные экспериментальные данные, мы предложили формирование кишечных соустий на ободочной кишке новым оригинальным устройством – компрессионным сшивателем кишечника (КСК).
Цель исследования. Улучшение результатов хирургического лечения больных раком левой половины толстой кишки, с помощью применения в клинике новой технологии формирования циркулярного компрессионного анастомоза.
Материалы и методы. Нами было разработано новое устройство – компрессионный сшиватель кишечника, на которое был получен патент РФ № 110246. Все детали устройства выполнены из сплава титана ВТ-1 и обработаны электрополировкой. КСК содержит коаксиально установленные цилиндры, снабженные обращенными друг к другу чашеобразными насадками. Цилиндры соединены между собой с помощью пружины. Предусматривается, что пружина выполнена из специальной пружинной стали. При этом один из цилиндров снабжен диаметрально расположенными сквозными пазами под съемный фиксирующий ключ с вилкообразным рабочим концом.
КСК имеет 3 типоразмера с внешними диаметрами 28 мм, 31мм и 33мм, с внутренними диаметрами 14 мм, 16,8 мм и 16,8 мм. При высоте 30 мм, вес устройств составляет 36-40 г.
Перед операцией необходимо соблюдать следующие условия: перед каждой операцией проверяется правильность сборки устройства; после отторжения КСК из организма больного, необходимо устройство промыть, подвергнуть дезинфекции в растворе антисептика, разобрать, очистить детали от некротизированных тканей, вновь промыть, подвергнуть стерилизации и в таком виде сохранять до следующей операции.
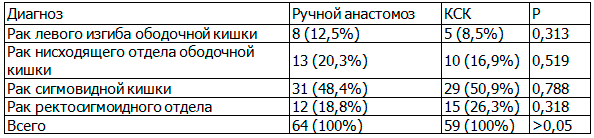
В основу клинического исследования легли результаты оперативного лечения 123 больного раком левой половины ободочной кишки, которые находились на лечении в онкологическом отделении ГБУ Шадринской больницы скорой медицинской помощи и ГБУ Курганском областном онкологическом диспансере с января 2009 по май 2014 г. Все больные были разделены на две группы по способу формирования анастомоза. В группу исследования вошли пациенты с компрессионными анастомозами сформированными при помощи КСК, в группу сравнения были отнесены больные, которым формировали ручной двухрядный узловой шов по Ламберу-Альберту.

Рис. 1. КСК трех типоразмеров
Каждый больной давал информированное письменное согласие на участие в клиническом исследовании в соответствии с положениями Нюрнбергского кода и Хельсинской декларации о защите прав пациентов и руководствуясь стандартами GCP (good clinical practice - добросовестная клиническая практика).
Таблица 1. Критерии исследования
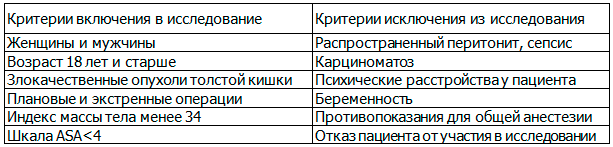
Мужчин было 58 (47,2%), женщин – 65 (52,8%). Средний возраст больных составил 67,5±10,2 лет, с диапазоном от 39 до 88 лет. С I стадией заболевания было 21 (17,4%) пациентов, II-38 (31,4%), III-51 (41,5%) и IV-13 (10,7%). У 78 (64,5%) пациентов имелись одно и более сопутствующих заболеваний. Группы были сопоставимы по полу, возрасту, сопутствующей патологии и характеру заболевания. Статистическую обработку полученных результатов проводили в программе Biostatistica 4.03. Статистически значимым (t-критерий Стьюдента) считали результат, если вероятность отвергнуть нулевую гипотезу об отсутствии различий не превышала 5% (Р<0,05).
Таблица 2. Характер заболевания, послуживший причиной операции
Способ имплантации КСК и формирования анастомоза толстой кишки по типу «конец в конец» состоял в следующем: после удаления пораженного опухолью отдела ободочной кишки, на края анастомозируемых участков мы накладывали кисетные швы любым прочным шовным материалом. Принципиального значения это не имеет, так как через 8-12 суток устройство вместе с кисетными швами отторгается.
После обработки слизистой анастомозируемых участков ободочной кишки антисептиком, хирург разжимает пружину устройства на нужное расстояние, фиксирует его чашеобразные насадки ключем и поочередно внедряет его в дистальный и проксимальный концы толстой кишки. Кисетные лигатуры плотно затягивают на цилиндре устройства и отсекают. Затем оператор снимает устройство с фиксатора и дает возможность пружине полностью сжаться. Пружина восстанавливает свою первоначальную форму, сближает и сжимает концы кишки. Проиллюстрируем этапы формирования анастомоза (рис. 2).
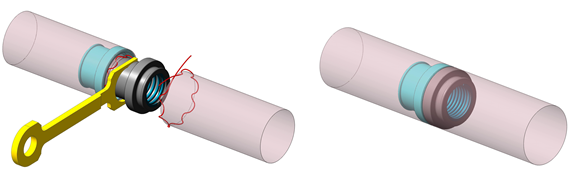
Рис. 2. Устройство установлено на фиксаторе, ограничивающий сжатие пружины, один конец его введен в кишку и завязан кисетный шов (слева). Оба кисетных шва завязаны, после снятия с фиксации, компрессирующие кольца сблизились и сжали кишечные стенки (справа)
Результаты и обсуждение. Учитывая техническую простоту формирования толстокишечного анастомоза с помощью КСК, мы провели хронометраж оперативных вмешательств. Среднее время формирования ручного двухрядного толстокишечного анастомоза составило 19,6±0,65 минут, при компрессионном соединении - 5,8±0,25 минут (P<0,05). Отторжение компрессионных устройств, происходило в сроки от 8 до 12 суток, среднее время элиминации составило 9,6±1,63 суток.
При оценке сравнительной характеристики ранних послеоперационных осложнений (табл. 3), нами отмечено статистически значимое снижение общего числа осложнений (P=0,003) и летальности (Р=0,05) в группе исследования.
При оценке осложнений, связанных с качеством анастомоза, ручной двухрядный узловой шов сопровождался большим количеством осложнений в целом - 8 (12,5%; P=0,004), так и по числу несостоятельностей шва 4 (6,3%; P=0,05), что также было статистически значимо больше, чем в группе исследования. При формировании толстокишечных анастомозов с помощью КСК, осложнений, связанных с качеством шва и летальности выявлено не было.
По другим показателям статистически значимой разницы выявлено не было. Летальные исходы в группе сравнения были получены после двух несостоятельностей анастомоза, перитонита и инфаркта миокарда.
Таблица 3. Сравнительная характеристика ранних послеоперационных осложнений
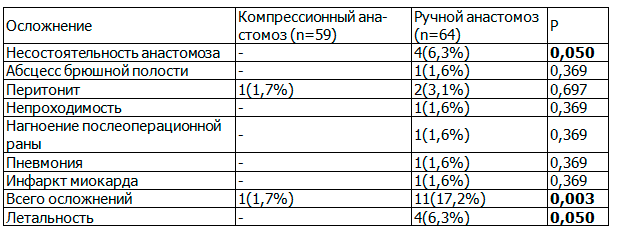
Примечание: для оценки статистической значимости различий использован критерий c².
Выводы. Создано оригинальное устройство для формирования компрессионных толстокишечных анастомозов. Применение КСК позволяет сократить число ранних послеоперационных осложнений и летальности у больных раком левой половины ободочной кишки в сравнении с ручным двухрядным швом.
