Введение. Рак молочной железы (РМЖ) - с точки зрения Международного агентства по изучению рака (IARC, Лион), это «идеальная» опухоль для проведения популяционного скрининга [4]. В России эта патология является ведущей в структуре заболеваемости злокачественными новообразованиями у женского населения. Абсолютное число вновь выявленных больных в 2012 г. составило 59,5 тыс. против 39,0 тыс. в 1996 г., а число умерших выросло до 23,1 тыс. по сравнению с 19,6 тыс. В 2007 г. в структуре онкологической заболеваемости женского населения России рак молочной железы занимал 1-е ранговое место в возрастной группе 40-85 лет и 2-е (18,9%) – в возрастной группе 15-39 лет (после рака шейки матки) [3]. Актуальна эта проблема и для Забайкальского края, где рак молочной железы является одной из основных локализаций среди злокачественных опухолей у женщин, а показатели заболеваемости и смертности (43,3 и 15,3 соответственно на 2012 г.), соотносимые со среднероссийскими данными, имеют тенденцию к росту [3,5].
В клинической практике используются различные молекулярно-генетические методы ранней диагностики, которые позволяют идентифицировать большинство случаев наследственных форм РМЖ, обусловленных мутациями определенного гена — BRCA1, BRCA2, TP53, PTEN и др. В качестве генов-кандидатов, также, могут быть рассмотрены гены белков фолатного цикла, играющие важную роль в таких процессах как синтез и метилирование ДНК, регенерация метионина, биосинтез пуриновых нуклеотидов, превращение уридинмонофосфата в тимидинмонофосфат [1]. Роль их в этиопатогенезе РМЖ окончательно не установлена, что делает изучение данных генов чрезвычайно интересным.
Цель исследования. Изучить частоту генотипов и аллелей генетического полиморфизма белков фолатного цикла у женщин, больных раком молочной железы в Забайкалье.
Материалы и методы. В исследование вошли 90 больных с объективно доказанным (гистологические и иммуногистохимические методы исследования) раком молочной железы, в возрасте 53,1±13,0 лет, находившихся на стационарном лечении в Забайкальском краевом онкологическом диспансере. Контрольную группу составили 299 здоровых женщин Забайкальского края в возрасте 38,2±5,9 лет (р>0,05), считающих себя относительно здоровыми и не имеющих на момент исследования онкологической патологии.
Экстракцию ДНК из лейкоцитов цельной периферической крови проводили посредством комплекта реагентов «ДНК-Экспресс Кровь» (ООО НПФ «Литех», Россия), из буккального эпителия – «Проба Рапид Генетика» (ООО ДНК-Технология, Россия), согласно инструкции производителя.
Генотипирование проводилось с использованием наборов «Генетика Метаболизма Фолатов» для выявления полиморфизма: MTHFR-677C>T, MTHFR-1298A>C, MTRR-66A>G (ООО «НПО ДНК-Технология», Москва) методом полимеразной цепной реакции с детекцией продукта амплификации в режиме реального времени. Для постановки ПЦР использовался ПЦР-амплификатор ДТ-96 («ДНК-Технология», Россия). Для оценки соответствия распределений наблюдаемых генотипов ожидаемым значениям при равновесии Харди-Вайнберга и для сравнения распределений частот генотипов и аллелей в двух субпопуляциях использовали критерий χ2, где значения уровня p<0,05 рассматривались как значимые. Статистическая обработка данных проводилась с использованием on-line-калькулятора http://gen-exp.ru/calculator_or.php
Для более объективной оценки вклада нескольких полиморфных генов в патологический процесс была использована система баллов [2]. С этой целью гомозиготам по нормальному аллелю присваивали 0 баллов, гетерозиготам – 1 балл, гомозиготам по мутантному аллелю – 2. Затем для каждого пациента суммировали баллы всех исследованных генотипов с выделением средней величины (M).
Результаты исследования и их обсуждение. Полиморфные варианты генов MTHFR, MTRR влияют на широкий спектр биохимических реакций в ходе фолатного цикла, обуславливая различную функциональную значимость белковых продуктов [14].
Ген MTHFR локализуется на коротком плече хромосомы 1 (1р36.3) и состоит из 11 экзонов. Длина всего кодирующего региона составляет около 1980 пар нуклеотидов. Имеется ряд аллельных вариантов этого гена, вызывающих тяжелую недостаточность фермента метилентетрагидрофолатредуктазы, но большинство из этих вариантов редки. Практическое значение имеют два полиморфизма:
1) полиморфизм C677T в экзоне 4 - приводящий к замене аминокислотного остатка аланина на валин (Ala222Val) в сайте связывания фолата. У гетерозигот по данной мутации, отмечается термолабильность фермента и снижение его активности примерно до 35%, у гомозигот - до 70% [16].
2) полиморфизм А1298С в экзоне 7 - приводящий к замене аминокислотного остатка глутамина на аланин (Glu429Ala) в регуляторном домене фермента. Аллель 1298С незначительно снижает активность фермента, а гетерозиготность по двум аллелям 1298C и 677T сопровождается снижением активности фермента на 40-50% [16].
Ген MTRR картирован на хромосоме 5 в локусе 5р15.3-р.15.2. В этом гене описаны разные типы мутаций и ряд полиморфных вариантов. Полиморфизм A66G (Ile22Met) в 4 раза снижает активность фермента MTRR (метионин-синтазы редуктазы) участвующего в восстановлении активности метионинсинтазы – непосредственно осуществляющей метилирование гомоцистеина [10].
В ходе исследования полиморфизма генов белков фолатного цикла, обнаружены все искомые мутации в гомо- и гетерозиготном состоянии с частотным подчинением закону Харди-Вайнберга (табл. 1).
Таблица 1. Частота аллелей и генотипов полиморфизма MTHFR-C677T, MTHFR-A1298C, MTRR-А66G в группах сравнения
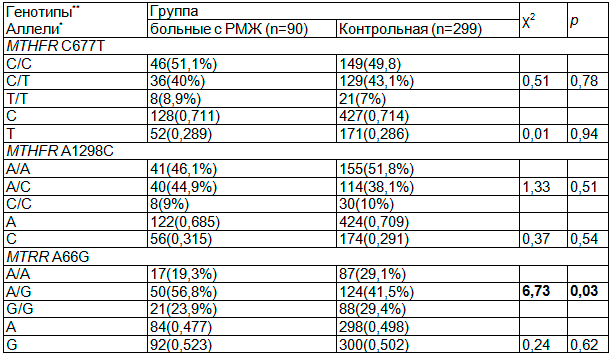
Примечание: выделены значимые различия частот. *df = 1, **df = 2.
Частоты генотипов и аллелей генов MTHFR(C677T), MTHFR(A1298C) в исследуемой и контрольной группе не имели статистически значимых отличий (p>0,05), что может быть связано с недостаточным количеством наблюдений. Следует отметить, что в литературе приводятся неоднозначные данные по изучению полиморфизма этих генов, где например, у носителей генотипа MTHFR-677T/Т отмечается сниженный риск развития аденокарциномы толстой кишки [13], что противоречит данным Giovannucci E. и соавт. [12]. Результаты исследования G. Yin и соавт., другого полиморфного аллеля MTHFR-1298С, показывают повышенный риск развития рака толстой кишки у носителей генотипа MTHFR-1298С/С [13]. В тоже время, по данным мета-анализа, выполненного Y. Huang и соавт., - риск развития колоректальных раков снижен, у носителей этого аллеля [7]. Противоречивость выводов может быть отчасти обусловлена как объективными причинами (мультифакториальный генез рака, этногеографическое разнообразие генофондов популяций), так и субъективными (различные критерии при отборе обследуемых лиц), а изучение роли полиморфизмов гена MTHFR в этиопатогенезе онкопатологии остается актуальным.
В нашей работе, в результате генотипирования, у больных РМЖ выявлено преобладание частоты генотипа MTRR66A/G – 56,8%, против 41,5% (χ2=6,73; p=0,03) в контрольной группе, с увеличением риска развития заболевания в 1,86 раза (CI95%:1,15-3,00). Полиморфизм MTRRA66G является распространенным для большинства популяций, частота гетерозигот составляет около 45–50%, а гомозигот ~ 25% [15]. Распределение генотипов, например, в украинской популяции отличаются от европейских высоким удельным весом патологических гомозигот (35.5%) (в европейской популяции 29.6%) и частотой мутантного аллеля MTRR66G (57%) против 54% [9]. Можно предположить, что ассоциация полиморфизма MTRR-A66G с РМЖ связана, например, с четырехкратным снижением активности метионинсинтазы редуктазы, что может вызвать повреждение ДНК, в том числе, и в клетках молочной железы. В подобных исследованиях ряда авторов была показана неоднозначность результатов. Так, например, по мнению Т. Otani и соавт., не наблюдается ассоциации генотипов MTRR66A/G и MTRR66G/G и аллеля 66G с риском развития рака толстой кишки [8], что противоречит данным других исследователей, сообщавших о повышенном риске развития колоректального рака у гомозигот по мутантному аллею [11].
Для более объективной оценки вклада нескольких полиморфных генов в патологический процесс, при сравнении средних сумм баллов, полученных при оценке полиморфизма генов фолатного обмена в двух группах – получены статистически не значимые отличия. Так, средняя сумма баллов у больных РМЖ составила 2,209 и была незначительно выше, чем в контрольной группе - 2,112 (р>0,05) (табл. 2).
Таблица 2. Сравнительный анализ результатов генетического тестирования у больных РМЖ методом «сумма баллов генотипов»

Примечание: * - статистически не значимые результаты.
Таким образом, полиморфизм MTRR-A66G может выступать, как потенциальный фактор риска развития неопластических процессов, связанных со снижением метилирования ДНК, что является одним из наиболее характерных признаков опухолевой клетки. Важно отметить снижение степени метилирования с возрастом, что в совокупности с полиморфизмами генов фолатного цикла может обуславливать возрастание частоты РМЖ у пожилых [6]. Но, по-видимому, влияние аллелей 677T, 1298C и 66G на развитие онкологических заболеваний зависит от наличия дополнительных факторов риска, изучение которых требует большей выборки.
Выводы. В результате исследования выявлены все изучаемые генетические полиморфизмы в гомо- и гетерозиготном состоянии. В сравнении с контрольной группой у больных РМЖ в Забайкальском крае отмечено частотное преобладание генотипа MTRR66A/G – 56,8%, против 41,5%, с увеличением риска развития заболевания в 1,86 раза (p=0,03). Частоты генотипов и аллелей полиморфизма генов MTHFR(C677T), MTHFR(A1298C) в исследуемой и контрольной группе не имели статистически значимых отличий (p>0,05).
И все же, несмотря на неоднозначность данных по различным случаям онкопатологии, несмотря на неясно обозначенные различия в иммунопатогенезе и в их этиологии, имеются основания говорить о базисной тождественности их патогенеза – о нестабильности генома клеток, индуцированной метилированием ДНК, которое играет значительную роль в манифестации клинических проявлений наследственных заболеваний и мультифакториальных нарушений, что необходимо учитывать, например, при выборе тактики лечения.
