Одной из ведущих причин смертности в онкологии является очаговое поражение печени злокачественными новообразованиями как пер- вичного, так и вторичного характера, к которым относятся гепатоцеллюлярный рак, метастазы колоректального рака, метастазы при других первичных локализациях.
Методом выбора лечения таких пациентов остается хирургическое вмешательство, которое, являясь потенциально радикальным, позволяет достичь 5-летней выживаемости на уровне 35-40%.
Ежегодно в мире раком печени заболевают не менее 250000 человек. В структуре онкологической заболеваемости первичный рак печени составляет 1,2% от всех злокачественных образований [1], вместе с тем, абсолютное число заболевших гепатоцеллюлярной карциномой в России в последнее десятилетие возросло с 4619 случаев в 2003 г. до 4974 в 2013 г.
Почти 90% опухолей печени являются метастатическими [2, 3]. Практически у каждого третьего онкологического больного, независимо от первичной опухоли, обнаруживаются метастатические поражения печени [4], а при локализации опухоли в зонах, дренируемых воротной веной, частота метастазирования возрастает до 50%.
Установлено, что наиболее частыми источниками метастазирования в печень являются: колоректальный рак (от 16 - 25% до 33,73%), рак желудка (от 17,5% до 87,3%), рак поджелудочной железы до 40%; рак легкого (14,7-76,6%), рак молочной железы (18,5-64,9%) [5].
Единственным методом радикального лечения первичного и метастатического рака печени, позволяющим добиться длительной выживаемости, остается резекция органа, однако лишь у 5-15% пациентов удается выполнить радикальную операцию [8].
Доля пациентов, которым не показано, или невозможно провести радикальное лечение, остается весьма значительной. Это связано с тем, что у остальных пациентов определяются множественные очаги в обеих долях, узел расположен в так называемых нерезектабельных зонах, значительно угнетены функциональные резервы печени либо анамнез отягощен тяжелой соматической патологией.
Результаты применения системной полихимиотерапия у таких больных неутешительны, несмотря на возрастающую роль химиотерапии в профилактике метастазирования после удаления первичного очага.
Но сегодня современная онкология может предложить целый комплекс малоинвазивных технологий, которые при малом количестве осложнений несут в себе высокий терапевтический потенциал. При этом сохраняются основные направления противоопухолевого воздействия. Речь идет о технологиях локальной деструкции опухолей.
Абляция (от латинского ablatio) - это методика прямого направленного разрушения ткани, которое достигается путем термического либо химического / электрохимического воздействия.
Несмотря на сравнительно короткую историю клинического применения, методики локальной деструкции опухолей в настоящее время широко используются при лечении пациентов с опухолями печени. [12,13].
Широкое распространение технологии обусловлено наряду с малой инвазивностью и сравнительно не дорогим оборудованием, главным образом - хорошим терапевтическим эффектом, демонстрируемым в большинстве исследований. Одним из широко используемых в настоящее время способов локальной деструкции опухоли печени, у больных, которым хирургическое лечение по разным причинам не показано, является радиочастотная термоабляция.
Это малоинвазивная методика быстро завоевывает прочные позиции. Радиочастотная, или микроволновая термоабляция привлекает относительной простотой выполнения, легкой управляемостью и кратковременностью процедуры, малым количеством осложнений, возможностью использования нескольких средств медицинской визуализации, в том числе - ультразвука для контроля в ходе вмешательства. [15].
Эта технология подразумевает введение специального атравматичного электрода в опухоль и воздействие на последнюю током. В результате опухолевая ткань разогревается до температуры (60-90°С), при которой происходят необратимые изменения в клетках. Опухолевая масса некротизируется [11].
Основным показаниями для проведения радиочастотной абляции следует считать: недоступные для резекции раковые поражения печени; наличие в печени не более 4-5 опухолевых узлов; диаметр одного узла не должен превышать 5 см; расположение узлов не ближе 1 см от воротной либо печеночной вены [14].
Противопоказания для проведения радиочастотной абляции опухолей печени: субкапсулярное расположение опухоли, прилежащее к желчному пузырю, петле кишки, стенке желудка, диафрагме; наличие внепеченочных проявлений заболеваний; цирроз печени класса С (по Чайлду-Пью); некорригируемая коагулопатия; выраженная астения; септическое состояние больного; наличие у пациента искусственного водителя ритма [14].
Цель настоящего исследования - сравнение эффективности лечения больных с первичными и метастатическими опухолями печени с применением радиочастотной термоабляции (РЧТА) и при использовании стандартной полихимиотерапии.
Материалы и методы. Проведен анализ результатов лечения 60 больных с первичными и метастатическими опухолями печени, получивших лечение в нашей клинике с января 2013 по январь 2015 г. Пациентов мужского пола было 28 (46%), женского - 32 (54%). Средний возраст больных колебался от 45 до 72 лет, составляя в среднем 58,1±10,2 г. Период наблюдения за больными составил 2 года.
План лечения каждого больного разрабатывался консилиумом в составе онколога, хирурга, химиотерапевта и радиолога. Контрольные обследования у всех больными проводили в установленные сроки с использованием помимо общеклинических методов ультразвукогого исследования печени и компьютерной томографии с контрастированием.
У всех пациентов диагноз был верифицирован морфологически. Обязательному гистологическому исследованию подвергались не только ткани первичной опухоли, но и метастазы печени.
При формулировке диагноза использовали код Международной Классификации Болезней (МКБ-10), при определении стадии заболевания - клиническую классификацию TNM. Согласно классификации TNM у больных имелись злокачественные новообразования T1-4N0-2M1(hep) G1-4.
В данное исследование не были включены пациенты с нерезектабельными метастазами печени, а также больные с обширными нерезектабельными внепеченочными первичными и метастатическими опухолевыми поражениями, в том числе с перитонеальным канцероматозом и злокачественным асцитом, метастазами в кости, метастазами в головной мозг, а также больные с наличием синхронного рака.
Для статистической оценки использован критерий Стьюдента.
Распределение больных в зависимости от размера очаговых образований печени представлено на рис. 1. Распределение в зависимости от локализации очага представлено на рис. 2.

Рис. 1. Распределение больных по локализации первичного очага.
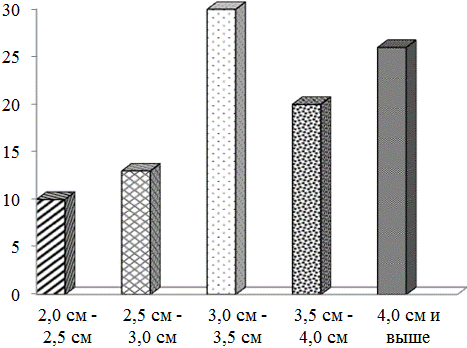
Рис. 2. Распределение больных в зависимости от размера очаговых образований печени.
В зависимости от проведенного лечения все пациенты были разделены на 2 равные группы. В 1-ю группу вошли 30 пациентов, которым была выполнена радиочастотная термоабляция опухолей печени чрескожным доступом под контролем ультразвукового исследования (УЗИ).
В данной группе у 15 больных (50%) очаговые образования в печени были обусловлены метастазами колоректального рака, у одной больной (3,3%) - рака тела матки, у 2-х больных (6,6%) - рака яичников, у 7 больных (23,3%) - рака молочной железы, у одного больного (3,3%) - рака желудка. У 4-х человек (13,3%) был диагностирован первичный рак печени, причём у одного из пациентов наблюдали первично множественный метахронный рак.
Радиочастотной термоабляции были подвергнуты 44 опухолевых очага у 30 больных. Размер 4 опухолей был в пределах 2,0 см - 2,5 см; размеры 7 опухолей варьировали от 2,5 см - 3,0 см; от 3,0 см до 3,5 см было выявлено 13 опухолей; свыше 3,5 см выявлено 20 очагов.
Для проведения радиочастотной термоабляции использовали генератор фирмы «Radionics» «Cool-tip», и игольчатые электроды длиной 20-25 см с рабочей частью 3,0 см. Продолжительность процедуры радиочастотной термоабляции составляла от 12 до 48 мин.
В подавляющем большинстве (83%) случаев была проведена абляция одиночных узлов. В 5 случаях наличие множественных опухолевых узлов (от 2-х до 4-х), потребовало нескольких последовательных воздействий на каждый из очагов. Во всех случаях процедуру завершали коагуляцией пункционного канала с целью гемостаза.
После проведения радиочастотной термоабляции был изучен лечебный (термический) патоморфоз; наблюдение, контроль рецидива и опухолевой прогрессии осуществлялся с помощью ультразвукового исследования, допплерографии и спиральной компьютерной томографии (критерии RECIST).
При оценке эффективности методов лечения учитывали как отдаленные, так и непосредственные результаты. Изучали общую продолжительность жизни и время до прогрессирования. Кривые общей выживаемости, времени до прогрессирования и медиану выживаемости изучали с помощью метода Каплана-Мейера.
Во 2-ю группу включили также 30 больных, но получавших только системную химиотерапию. Критерием включения была невозможность выполнения оперативного вмешательства и радиочастотной термоабляции (субкапсулярно расположенные опухоли; наличие 5 и более опухолевых узлов; расположение в воротах печени, наличие более 3-х узлов диаметром более 5 см каждый).
Применяли схемы химиотерапии (FOLFOX-Оксалиплатин, лейковорин, Фторурацил; FOLFIRI лейковорин, Фторурацил, Иринотекан) в стандартных рекомендуемых дозировках. Среднее число проведенных курсов химиотерапии составило 5,8. Осложнения выявлены у 17 пациентов (56,6%). Наибольшее количество осложнений (46% для разных видов токсичности) было связано с общетоксическим действием химиопрепаратов. Местные реакции в виде дерматита выявлены у 2 больных, функциональные нарушения также в 1 случае. Сенсорные нарушения зафиксированы не были.
Уменьшение продолжительности терапии было обусловлено развившейся в ряде случаев токсичностью, а также прогрессированием основного заболевания на фоне проводимой химиотерапии.
Результаты. В общей сложности радиочастотной термоабляции были подвергнуты 44 опухолевых очага у 30 больных. После процедуры радиочастотной термоабляции у 2-х больных (6,6%) наблюдалась умеренная гипертермия и боль в области вмешательства. Осложнений в отдаленном периоде не было ни в одном случае.
В сроки наблюдения до 2-х лет рецидивы в области воздействия были выявлены у 9 (30%) пациентов. Они объясняются исходно большим объемом и множественностью поражения. Во всех 9 случаях была проведена повторная радиочастотной термоабляции остаточных опухолей. У 3-х больных с локализацией очага в воротах печени дополнительно использовали химиоэмболизацию опухолевых сосудов гепасферами, насыщенными доксорубицином. Медиана выживаемости больных в данной группе составила 20±2 месяцев.
Во 2-й группе пациентов при использовании системной химиотерапии медиана выживаемости составила 11±2 месяцев (различия статистически достоверны, р<0,01).
Таким образом, радиочастотной термоабляции продемонстрировала убедительное преимущество по срокам 2-х летней выживаемости по сравнению с химиотерапией.
Заключение
- РЧТА является эффективным методом лечения первичного и метастатического рака печени у исходно неоперабельных пациентов. Она позволяет выполнить адекватное разрушение опухоли и добиться удовлетворительных показателей выживаемости при низкой частоте контролируемых осложнений.
- Применение радиочастотной термоабляции уменьшает риск оперативного вмешательства у самотически отягощенных больных, за счет малоинвазивности и малотравматичности
- При трудной доступности очагов, или технической невозможности выполнения радиочастотной термоабляции, локальное лечение можно дополнить интервенционными эндоваскулярными методиками.
- При метастатическом поражении печени у исходно неоперабельных больных, лечение с применением метода радиочастотной термоабляции позволяет достоверно увеличить медиану общей выживаемости вдвое по сравнению с системной химиотерапией.
