Хронический тонзиллит остаётся актуальной проблемой современной оториноларингологии. Это обусловлено широкой распространённостью данного заболевания, как среди взрослого населения, так и детей, возможностью развития серьёзных осложнений и хронических заболеваний со стороны других органов и систем организма. В настоящее время для лечения хронического тонзиллита используются различные методики местной терапии, имеющие свои преимущества и недостатки. Наиболее часто при местной терапии нёбных миндалин в качестве антибактериальных средств традиционно используются антисептики и антибиотики. Однако, в силу разных причин (внутриклеточная персистенция патогенов, вегетирование микроорганизмов в составе бактериальных биоплёнок, конституитивная антибиотикорезистентность или ассоциированность патогенного микроба с бактериями, продуцирующими антибиотик-деградирующие ферменты) антибиотикотерапия чаще всего оказывается неэффективной и не позволяет достичь стойкого клинического эффекта. Поэтому остаются актуальными вопросы разработки патогенетически обоснованных подходов к терапии, поиска средств и способов лечения хронического тонзиллита [1].
Нами для местного лечения хронического компенсированного тонзиллита разработана методика топической эрадикационной терапии с применением пероксида водорода, мексидола, лазолвана и новокаина.
Для элиминации патогенов, вегетирующих внутри клеток и в составе бактериальных биоплёнок в ткани нёбных миндалин, ежедневно один раз в день в течение трех недель лакуны нёбных миндалин последовательно промывали сначала 0,05% раствором пероксида водорода, а затем, через 15 минут, повторно промывали 1,67% раствором эмоксипина сукцината («Мексидола») и 0,25% раствором амброксола гидрохлорида («Лазолвана») в 0,33% растворе новокаина. Раствор (0,05%) пероксида водорода для промывания нёбных миндалин изготовляли непосредственно перед его применением путём смешивания 59,0 мл 0,9% раствора натрия хлорида и 1,0 мл 3% раствора (официнального) пероксида водорода. Многокомпонентный раствор для повторного промывания лакун нёбных миндалин, включающий эмоксипина сукцинат, амброксола гидрохлорид и новокаин, изготовляли также непосредственно перед его применением, посредством смешивания в одном флаконе равных объёмов официнальных 1% ампульного раствора новокаина, 5% ампульного раствора эмоксипина сукцината («Мексидола») и 0,75% ампульного раствора амброксола гидрохлорида («Лазолвана»).
Применение данных препаратов патогенетически обосновано на основании изучения многочисленной литературы отечественных и зарубежных авторов.
В настоящее время хорошо известно, что пероксид водорода, будучи водорастворимым неполярным соединением, способен быстро диффундировать через биологические мембраны и проникать в клетки эукариот и бактериальные биоплёнки [2]. Воздействуя в микромолярном диапазоне концентраций (не оказывающих бактерицидного действия на нелизогенные микроорганизмы при экспозиции в десятки минут) на лизогенные штаммы бактерий, пероксид водорода стимулирует экспрессию комплекса энзимов экстренной репарации бактериальной ДНК (SOS-регулона) [3]. Индукция SOS-регулонов лизогенных патогенов сопровождается активацией их резидентных профагов, мультипликацией вирусных частиц и последующей гибелью бактерий, что может обеспечить весьма быстрый клиренс зоны воспаления от патогенной микрофлоры при хроническом тонзиллите. Одновременно в эукариотических клетках под влиянием пероксида водорода (как вторичного мессенджера) [4] наблюдаются:
– при уровне Н2О2 в цитозоле клеток, превышающем 12,5 мкМ, стимуляция активности ядерного фактора транскрипции NF-kB сменяется его ингибированием и, следовательно, блокированием экспрессии провоспалительных факторов [5];
– под влиянием микромолярных концентраций Н2О2 (физиологические уровни пероксида водорода в цитозоле до 100 мкМ, токсические эффекты не обнаруживаются и в диапазоне концентраций 100-200 мкМ) стимулируются транскрипция и трансляция ядерного фактора транскрипции Nrf2 (в течение 1-2 часов уровень Nrf2 в цитозоле увеличивается на 100%), его активация и транслокация в ядро клетки, что сопровождается стимуляцией экспрессии противовоспалительных факторов [6];
– ингибирование формирования митохондриальной транзитной проницаемости посредством увеличения проводимости митохондриальных АТФ-чувствительных К+-каналов под влиянием микромолярных концентраций Н2О2, что проявляется цитопротективными эффектами [7].
Продукция Н2О2 в качестве бактерицидного агента, обеспечивающего дистантно контролируемую индукцию профагов в лизогенных микроорганизмах, – широко распространённая в мире прокариот стратегия вытеснения конкурентов из микроэкологических ниш [8]. Экспрессия Н2О2 симбионтной микрофлорой желудочно-кишечного тракта – действенный фактор колонизационной резистентности, обеспечивающий трансформацию профагов нерезидентных микроорганизмов в их литическую форму. Симбионтные лактобациллы и лактококки в условиях аэробной среды (приэпителиальная зона кишечной трубки) флавинзависимым путём способны продуцировать пероксид водорода. Поскольку молочнокислые бактерии относятся к группе каталазанегативных микроорганизмов, постольку Н2О2 может аккумулироваться в среде их вегетирования до аутоингибиторных концентраций [9]. Симбионтные штаммы молочнокислых бактерий являются носителями дефектных профагов, которые не способны трансформироваться в их литическую форму при индукции SOS-регулонов данных прокариот. Поэтому они на порядок менее чувствительны к действию пероксида водорода, чем нерезидентные микроорганизмы (Staphylococcus, Pseudomonas) [10]. Следовательно, 0,01-0,03 М (0,03-0,1%) раствор пероксида водорода, не оказывая бактериостатического или бактерицидного действия на симбионтов слизистой оболочки ротоглотки и нёбных миндалин, не только не формирует (не усугубляет) микроэкологический дисбаланс, но и способствует восстановлению эубиоза путём селективной элиминации нерезидентных бактерий. Значимо, что элиминации подвергаются как внутриклеточные патогены, так и микроорганизмы, персистирующие в составе бактериальных биоплёнок. Также важно, что пероксид водорода, не стимулируя экспрессию фактора ингибирования миграции макрофагов клеточными элементами слизистой оболочки дыхательных путей (в отличие от других тканей), выполняет роль аттрактанта для лейкоцитов, что способствует разрешению воспаления [11].
Эмоксипина сукцинат (препарат «Мексидол») достаточно давно известен и с успехом применяется в терапии критических состояний [12]. «Мексидол» имеет широкий спектр фармакологической активности: является антигипоксическим, стресспротективным, ноотропным, противосудорожным и анксиолитическим средством, эффективно ингибирующим процессы свободнорадикального окисления. Данный лекарственный препарат обладает противовоспалительным действием, улучшает микроциркуляцию и стимулирует репаративно-регенераторные процессы. Столь широкая палитра фармакологической активности «Мексидола» (эмоксипина сукцината) обусловлена способностью препарата стимулировать сукцинатоксидазное окисление (компенсаторный путь синтеза АТФ) [13], фосфорилироваться в биологических системах и оказывать ингибирующее воздействие на сериновые, металлозависимые протеиназы, ингибировать свободнорадикальные стадии синтеза простагландинов, а также хелатировать ионы железа, исключая тем самым каталитическую продукцию прооксидантов с участием данного металла переменной валентности и его доступность для нерезидентной микрофлоры [14]. Важно, что фармакологическая активность «Мексидола» проявляется, помимо прочего, эффектами стимуляции экспрессии секреторного IgA и лизоцима в полости рта [15].
При хроническом тонзиллите бактериальная инфекция в большинстве случаев ассоциирована с латентной вирусной инфекцией [16]. Поэтому, в контексте рассматриваемой проблемы, важный аспект фармакологической активности эмоксипина сукцината – способность продуктов биотрансформации данной субстанции ингибировать различные протеиназы. Это, с одной стороны, обусловливает (отчасти) его противовоспалительные эффекты, а с другой – может предопределять и противовирусную активность. Известно, например, что для интернализации оболочечных вирусов необходим предварительный процессинг гликопротеинов оболочки вирусной частицы, который осуществляется трипсинподобными лейкопротеиназами [17]. Естественно, что при ингибировании протеиназ фосфорилированными производными эмоксипина возможно снижение вирулентности оболочечных вирусов, т.е. подавление процесса их мультициклической репликации. Кроме того, известно, что воспалительная реакция обеспечивает и поддерживает в зоне воспаления присутствие свободных ионов железа, стимулирующих процессы пероксидации и вегетирования патогенной микрофлоры. Особо значима способность фосфорилированных производных эмоксипина хелатировать ионы железа и ингибировать активность протеиназ в связи с тем, что на фоне хронического воспаления нёбных миндалин локально подавляется активность лактоферрина вследствие его протеолитической деградации под влиянием эластаз и катепсинов нейтрофилов и патогенных микроорганизмов [18].
Лактоферрин – гликопротеин, обильно экспрессируемый клеточными элементами слизистых оболочек [19], обладает выраженной противовоспалительной активностью и способностью блокировать формирование бактериальных биоплёнок вследствие:
– эффективного железохелатирующего действия, поддерживающего бактериостатический статус биосред организма [20];
– прямого связывания липополисахарида и его рецептора CD14, блокирования TLR-зависимой сигнальной трансдукции [21];
– ингибирования образования и лизиса существующих бактериальных биоплёнок, прямого железо-независимого разрушения структурных элементов клеточной стенки микроорганизмов и оболочечных вирусных частиц [22].
Новокаин, попадая на слизистую оболочку ротоглотки, частично всасывается, оказывая слабое местное анестезирующеее действие, и относительно быстро гидролизуется, распадаясь на пара-аминобензойную кислоту и диэтиламиноэтанол [23]. Пара-аминобензойная кислота (витамин В10) представляет собой «фактор роста» для представителей симбионтной микрофлоры, способствующий подавлению вегетирования нерезидентных микроорганизмов. Кроме того, будучи индуктором интерферона, пара-аминобензойная кислота – эффективное противовирусное средство и стимулятор экспрессии полимерного рецептора иммуноглобулина А (pIgR), обеспечивающего трансцитоз sIgA через эпителиальные клетки (в условиях достаточной обеспеченности организма витамином А), что способствует увеличению уровня sIgA на слизистых оболочках [24]. В плане рассматриваемого вопроса значимо, что в процессе трансцитоза полимерная форма sIgA нейтрализует внутриклеточные патогены и их токсины [25]. Кроме того, витамин В10 способен оказывать нормализующее воздействие на обменные процессы в соединительной ткани и оптимизировать усвоение других витаминов группы В. Новокаин, как предшественник пара-аминобензойной кислоты, также эффективный индуктор интерферона. Противовирусная активность новокаина, как индуктора интерферона, значима в связи с тем, что на фоне подавления микрофлорой биоплёнки способности клеточных элементов эпителиального барьера нёбных миндалин экспрессировать данный противовирусный фактор [26], персистирующая риновирусная инфекция индуцирует дальнейшее распространение биоплёнки и внутриклеточное вегетирование бактериальных патогенов [27].
Противовирусное действие новокаина (как индуктора интерферона), эмоксипина сукцината (как ингибитора протеиназ) при лечении хронического тонзиллита целесообразно усиливать за счёт эффектов муколитика амброксола гидрохлорида (препарат «Лазолван»). «Лазолван» при местном применении, оказывая местноанестезирующее действие [28], стимулирует выделение секреторного ингибитора лейкопротеиназ, повышает экспрессию секреторного IgA [17] и индуцирует активность щелочной фосфатазы – энзима детоксикации липополисахарида грамнегативных бактерий [29].
Для оценки влияния лечения (терапии) больных компенсированной формой хронического тонзиллита предложенным способом под нашим наблюдением находились 98 больных. Лечение проводилось амбулаторно в медицинском центре «21век». Всем больным выполнялось общеклиническое обследование, осмотр ЛОР органов. Также проводились бактериологическое и вирусологическое исследования содержимого лакун нёбных миндалин (до лечения, через одну, две и три недели после начала лечения). Результаты исследования обрабатывались по общепринятым статистическим методикам. Обследуемые больные были разделены на две группы: основная (первая) группам - 75 человек и группа сравнения (вторая) - 23 пациента. Больным первой группы проводилось местное эрадикационное лечение с применением пероксида водорода, мексидола, лазолвана и новокаина по предложенной нами схеме. Больным второй группы проводилось традиционное промывание лакун нёбных миндалин раствором фурациллина.
Забор материала для бактериологического и вирусологического исследований из лакун нёбных миндалин выполняли при помощи стерильного ватного тампона, который затем помещали в транспортную среду Amies для доставки в лабораторию [30,31].
Динамика носительства патогенов вирусной природы на нёбных миндалинах представлена в табл.1.
Таблица 1. Динамика носительства патогенов вирусной природы на поверхности нёбных миндалин под влиянием лечения
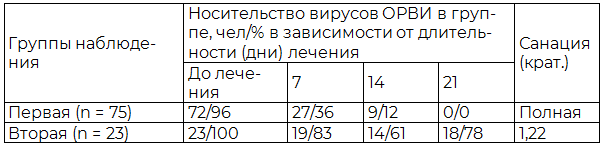
Как видно из данных, представленных в таблице, в первой группе обследованных наблюдалась полная санация поверхности нёбных миндалин от носительства вирусов.
В отличие от этого, лечение пациентов второй группы не обеспечивало санации поверхности нёбных миндалин от носительства вирусов.
Разработанный способ лечения хронического тонзиллита обеспечивал также выраженное (почти полное) сокращение распространённости носительства патогенов бактериальной природы на поверхности нёбных миндалин (табл. 2).
Таблица 2. Динамика носительства патогенов бактериальной природы на поверхности нёбных миндалин под влиянием лечения
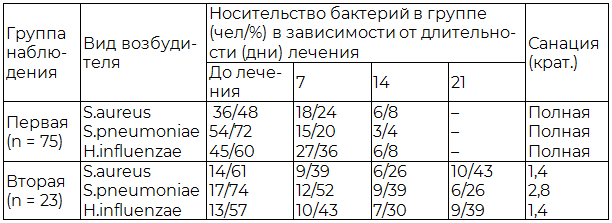
Важным следствием лечения хронического тонзиллита у больных первой группы (табл. 3) следует признать нормализацию показателей колонизации поверхности нёбных миндалин симбионтными микроорганизмами, т.е. восстановление эубиоза.
Таблица 3. Колонизация поверхности нёбных миндалин симбионтными микроорганизмами до и после лечения
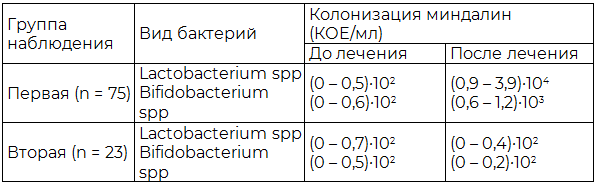
Примечание: КОЕ – колониеобразующие единицы.
Лечение хронического тонзиллита у больных второй группы не только не приводило к купированию микроэкологического дисбаланса, но даже несколько усугубляло дисбиотическое состояние.
В процессе проведения исследования (лечения больных хроническим тонзиллитом) ни у одного из пациентов первой группы никаких побочных эффектов и осложнений не возникло.
Подавляющее большинство больных первой группы (92%) в течение года за медицинской помощью не обращалось, а у остальных пациентов данной группы (8%) имело место снижение частоты обращений. При лечении больных во второй группе за медицинской помощью в течение года не обращались лишь два пациента (8,7%).
Анализ результатов проведённого исследования показал, что при традиционном способе лечения достигается лишь временное клиническое улучшение при сохранении очага инфекции и воспалительного процесса в нёбных миндалинах. Антисептики, оказывая бактерицидное действие, способствуют углублению и консервации дисбиотического состояния слизистой оболочки верхних дыхательных путей, что является условием и причиной возникновения и поддержания хронического воспаления нёбных миндалин.
Таким образом, предложенный нами способ патогенетического местного эрадикационного лечения больных хроническим компенсированным тонзиллитом с применением пероксида водорода, мексидола, лазолвана и новокаина не только более эффективен, но и достаточно прост в исполнении, хорошо переносится больными, не вызывает каких - либо побочных эффектов и для осуществления предполагает использование доступных отечественных официнальных препаратов.
Совокупность представленных данных доказывает возможность реализации этой методики лечения больных с хронической патологией нёбных миндалин.
