Актуальность. Артериальная гипертензия (АГ) является самым распространенным заболеванием, приводящим к фатальным осложнениям и встречается со стандартизованной по возрасту и полу частотой от 28% в Северной Америке до 44% в европейских странах [1, 2]. В России около 40% взрослого населения имеют повышенный уровень АД. Большинство имеющихся рекомендаций по АГ признают, что антигипертензивные препараты должны снижать не только АД, но и обладать органопротективными свойствами, снижая риск развития сердечно-сосудистых осложнений (ССО) [3].
Кроме таких опасных осложнений, связанных с АГ, как мозговой инсульт, инфаркт миокарда, хроническая почечная недостаточность, существует высокая вероятность развития и других клинических состояний, в частности нейросенсорной тугоухости (НСТ) [4, 5].
Хроническая нейросенсорная тугоухость (ХНТ), (синонимы – неврит слухового нерва, перцептивная тугоухость, сенсоневральная тугоухость) – понятие собирательное, указывающее на поражение слухового анализатора, начиная от органа Корти, проводящих путей внутреннего уха и центральной нервной системы (ЦНС), вплоть до высшего его отдела – коры головного мозга [4].
Наиболее частыми причинами нейросенсорной тугоухости являются расстройства кровообращения в сосудах внутреннего уха и головного мозга, развивающиеся на фоне АГ, атеросклероза, нарушения кровообращения в вертебробазилярном бассейне. Однако наиболее часто имеет место сочетание ХНТ с АГ, которое по литературным данным составляет около 17-19% [6].
Реакция внутреннего уха и, в первую очередь улитки, на сосудистые изменения обусловлены особенностями кровоснабжения этой области: внутренне ухо кровоснабжается только одним сосудом — лабиринтной артерией, конечной ветвью системы базилярной артерии. Лабиринтная артерия отдает густую сеть мелких артериальных стволов к основанию улитки, что создает хорошие условия для кровоснабжения. Но, относясь к терминальным сосудам, лабиринтная артерия имеет в стенках гладкую мускулатуру и поэтому кровоток в улитке зависит от общего артериального давления и от состояния мозгового кровообращения [7].
Блокаторы рецепторов ангиотензина II (БРА, сартаны) - класс антигипертензивных препаратов, являющихся селективными непептидными блокаторами (антагонистами) АТ1-рецепторов и не оказывающих прямого влияния на кининовую систему. Вследствие блокады АТ1-рецепторов снижается повышенное АД за счет уменьшения вазоконстрикции, высвобождения альдостерона и катехоламинов, реабсорбции натрия и воды. БРА сочетают высокую антигипертензивную эффективность с мощными органопротективными свойствами и отличной переносимостью. Они способны предотвращать либо вызывать обратное развитие эндотелиальной дисфункции, уменьшать гипертрофию гладкой мускулатуры сосудистой стенки, гипертрофию левого желудочка, а также внутриклубочковое давление и протеинурию, приводят к ослаблению фиброзирования в сосудах, сердце и почках.
Таким образом, для лечения АГ у больных в сочетании с ХНТ по всей видимости приоритетным является назначение препаратов, которые контролируют активность ренин-ангиотензин-альдостероновой системы (РААС), а именно - сартанов. Кроме того, сартаны предположительно могут иметь и иной спектр действия по сравнению с ингибиторами ангиотензинпревращающего фермента (АПФ). Дело в том, что высвобождение ренина контролируется по принципу обратной отрицательной связи с АТ1-рецепторами на клетках юкстагломерулярного аппарата: когда рецептор стимулируется, ренин ингибируется [8,9].
Одним из наиболее современных БРА в настоящее время является олмесартана медоксомил — представитель класса бифениловых тетразолов [10].
Проведенные международные экспериментальные и клинические исследования выявили ряд положительных эффектов характерных для олмесартана:
- выраженный антигипертензивный эффект. Препарат достоверно снижает систолическое и диастолическое АД, обеспечивая устойчивое снижение АД на протяжении 24 часов [10, 11];
- доказана особая долговременная эффективность снижения АД у пожилых пациентов, в связи с уменьшением жесткости артериальной стенки и этот эффект вероятно не связан со снижением САД, а обусловлен вазопротекцией [12, 13];
- олмесартан по сравнению с другими БРА (лозартан, валсартан, ирбесартан) обеспечивает устойчивое снижение АД на протяжении 24 часов [14];
- кардиопротективные эффекты - за счет снижения резистентности коронарных артерий и положительного влияния на процессы ремоделирования левого предсердия у больных с АГ [15];
- вазопротективные эффекты: при приеме олмесартана наблюдалось уменьшение гипертрофии сосудистой стенки (ТИМ) и объем больших атеросклеротических бляшек на 11,5 мкл [16];
- плеотропные эффекты: уменьшение воспалительных изменений в сосудистой стенке, антиоксидантное действие, приводящие к положительному влиянию на процессы атеросклероза при АГ [17];
- нефропротективные эффекты: снижение резистентности сосудов почек, увеличение почечной перфузии и уменьшение оксидативного стресса при приеме олмесартана [18].
С учетом выявленной органопротекции представляется особенно актуальным исследовать влияние олмесартана на течение АГ и ХНТ.
Целью нашего исследования было оценить клиническую эффективность олмесартана у больных с АГ в сочетании с ХНТ в составе комбинированной терапии.
Материалы и методы. В открытое, сравнительное, контролируемое исследование были включены 75 больных в возрасте 45-70 лет (средний возраст (54,8+-10,3) с АГ I-II степени и ХНТ (31% мужчины и 69% женщины). Все пациенты дали добровольное письменное информированное согласие на участие в исследовании, которое было одобрено локальным этическим комитетом.
Критериями включения в исследование считали ситолическое АД (САД) - 140-179 мм рт.ст. и диастолическое АД (ДАД)- 90-109 мм рт.ст, оцененные без предшествующего приема антигипертензивных препаратов.
После «отмывочного периода» в течение 5-7 дней больные получали олмесартан в дозе 10-20 мг в сутки или эналаприл 10-20 мг в сутки. Если при контрольном исследовании не достигался целевой уровень АД менее 140/90 мм рт.ст., то дозу препарата увеличивали в 1,5- 2 раза. При сохраняющейся АГ на фоне монотерапии к лечению добавляли индапамид 2,5 мг в сутки.
В зависимости от назначенной терапии больные были распределены на 4 группы наблюдения, сопоставимые по полу, возрасту, индексу массы тела, исходным значениям САД, ДАД и длительностью АГ. Все больные получали комплексную терапию для лечения ХНТ (кавинтон, мексидол, витамины (В1, В6, РР, С), но отличались по группам по лечению АГ: больные 1 группы (20 человек) получали олмесартан (кардосал, Берлин/Хеми, Менарини) в дозе 10-40 мг/сут., 2-й (18 человек) - олмесартан в дозе 10-40 мг/сут. и индапамид в дозе 2,5 мг/сут., 3-й (20 человек)- эналаприл (берлиприл, Берлин/Хеми, Менарини) в дозе 10-40 мг/сут., 4-й (17 человек) – эналаприл в дозе 20-40 мг/сут. и индапамид в дозе 2,5 мг/сут.
Всем больным проводили комплексное клинико-инструментальное обследование исходно и через 6 месяцев наблюдения.
Суточное мониторирование АД (СМАД) проводилось неинвазивным способом с помощью портативного регистратора (Кардиотенз, Венгрия), осуществляющего регистрацию АД и ЧСС осциллометрическим методом в течение 24 часов с интервалами 15 минут во время бодрствования и 30 минут в ночной период.
Толщина комплекса интима-медиа определялась при ультразвуковом исследовании экстракраниальных сегментов общей сонной артерии стандартным методом.
Для определения реологических свойств крови и плазмы использовали вискозиметр ротационного типа АКР-2. Измерение вязкости крови проводилось на скоростях сдвига 200 с-1, 100 с-1 и 20 с-1.
Отношение величин вязкости крови при 100 и 200 с-1 характеризует деформируемость эритроцитов (индекс деформируемости).
Агрегационную активность тромбоцитов изучали по методу G.Born в модификации В.Г. Лычева с вычислением суммирующего индекса агрегации по Howard et al. В качестве индуктора агрегации использовали аденеозиндифосфат (АДФ) в конечной концентрации 2 мкМ. Исследование проводили на фотоэлектроколориметре КФК-2 МП (Россия).
Тональную пороговую аудиометрию проводили с уровнем фонового шума менее 30 дБ на аудиометре Medimate 622 (Madsen electronics, Дания), в диапазоне частот от 125 до 8000 Гц по воздушной проводимости и от 250 до 6000 Гц по костной проводимости.
Все исследования проводили исходно и через 6 месяцев после проводимой терапии. Статистическую обработку проводили методом вариационной статистики путем вычисления средней арифметической (М), ошибки средней арифметической (sd), критерия Стьюдента (t). Достоверность различия определяли при p<0,05.
Результаты и обсуждение. Во всех группах наблюдения исходные демографические показатели, степень тяжести НСТ, а также среднесуточные значения САД и ДАД были одинаковыми и составили в 1-й группе: 153,2±1,3/92,3±2,5 мм рт.ст.; во 2-й: 154,6±1,5/95,2±1,7 мм рт.ст; в 3-й: 152,2±2,7/94,6±1,2 мм рт.ст; в 4-й: 156,9±1,5/96,8±1,7мм рт.ст.
При анализе полученных результатов исследования до назначения антигипертензивных препаратов была выявлена прямая корреляционная связь между АГ и ХНТ. Корреляционная связь между САД и данными аудиометрии: коэффициент корреляции - 0,91 (р<0,01). Корреляционная связь между ДАД и данными аудиометрии: коэффициент корреляции - 0,93 (р<0,01). Корреляционная связь между САД и шумом в ушах: коэффициент корреляции - 0,64 (р<0,05). Корреляционная связь между ДАД и шумом в ушах: коэффициент корреляции - 0,63 .(р < 0,05).
Через 6 месяцев проводимой терапии во всех группах наблюдения отмечалось улучшение клинического состояния больных: уменьшение головной боли, улучшение сна, работоспособности, уменьшение головокружений, шума в голове. После 6-месячной моно- и комбинированной антигипертензивной терапии во всех четырех группах пациентов наблюдалось достоверное снижение среднесуточных показателей САД и ДАД. Динамика показателей СМАД представлена в табл. 1.
Так, в результате проведенной терапии олмесартаном (1-я группа) целевых значений суточных показателей АД достигли 13 (65%) больных. Получено достоверное снижение, как среднесуточного САД (130,7±1,5 мм рт. ст., р<0,01), так и среднесуточного ДАД (88,4±1,6 мм рт. ст., р<0,01).
Таблица 1. Динамика показателей СМАД (М±sd, Δ%) на фоне различных схем терапии
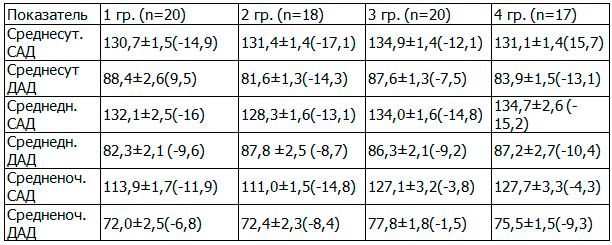
На фоне лечения олмесартаном и индапамидом (2-я группа), целевых значений АД достигли 15 (83,3%) больных, у остальных больных был получен хороший эффект (3 пациента). Отмечено снижение среднесуточных показателей САД и ДАД до 131,5±2,4/81,1±3,2 мм.рт.ст. (р<0,01).
При применении эналаприла (3-я группа наблюдения) целевых значений АД достигли 60% больных, хороший эффект отмечался у 15%, у пятерых (25%) - анитигипертензивный эффект был расценен как удовлетворительный. Среднесуточные показатели САД и ДАД через 6-месячного лечения составили: 134,9±1,8/ 87,6±1,3 мм рт.ст (p<0,01).
Применение эналаприла и индапамида (4-я группа) позволило достичь целевых значений АД у 76,5% больных, у остальных (4 пациента) был получен хороший антигипертензивный эффект. После 6 месяцев терапии среднесуточные показатели САД и ДАД составили: 131,1±1,4/83,9±1,5мм рт.ст. (р<0,01).
Результаты межгруппового сравнения динамики показателей СМАД (табл. 2) показывают, что наиболее выраженные антигипертензивные эффекты получены после лечения больных с АГ I - II степени в сочетании с ХНТ при монотерапии олмесартаном (1 группа) и олмесартаном с индапамидом (2 группа).
Таблица 2. Межгрупповое сравнение динамики показателей СМАД (Δ,%)
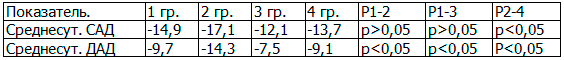
Таким образом, монотерапия олмесартаном и в комбинации с индапамидом по сравнению с контрольными группами в большей степени позволяет контролировать уровень АД в течение 24 часов, положительно влияет на суточный профиль АД, способствуя нормализации суточного ритма САД и ДАД.
Известно, что АГ является одним из главных факторов риска развития эндотелиальной дисфункции. В связи с этим было интересно исследовать тромбоцитарное звено гемостаза, которое чутко реагирует на патологические процессы в сосудистой стенке. При оценке исходных показателей отмечалось повышение спонтанной агрегации и, в большей степени, АДФ-индуцированной агрегации тромбоцитов. В среднем исходный уровень спонтанной агрегации составил 14,8±3,1% - в 1-й, 15,2±2,5% - во 2-й, 13,8±3,4% - в 3-й, 14,2±1,6% - в 4-й группах; АДФ- индуцированной агрегации составил 52,4±2,2% - в 1-й группе, 56,1±1,8% - во 2-й, 49,3±1,9% - в 3-й, 50,3±1,3% - в 4-й. Через 6 месяцев комплексной терапии во всех группах наблюдения выявлено достоверное (р<0,05) снижение до нормализации агрегационной активности тромбоцитов (табл. 3). Уменьшение спонтанной и индуцированной АДФ агрегации тромбоцитов составило 13,7% и 6,2% соответственно в 1 группе наблюдения, 22,8% и 9,1% - во 2 группе, 11,9% и 4,4% - в 3 группе, 17,3 - в 4 группе.. Статистически значимых различий в снижении исходно повышенной интенсивности спонтанной и индуцированной АДФ агрегации тромбоцитов у пациентов всех групп наблюдения не обнаружено.
Таблица 3. Динамика показателей агрегации тромбоцитов после 6 месяцев терапии в различных группах (Δ,%)
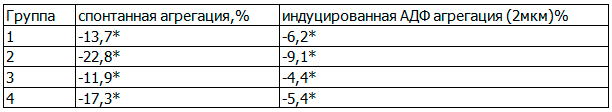
Примечание:* - р< 0,05.
Изменение реологических свойств крови у пациентов привело к достоверному снижению исходно повышенной вязкости крови на всех скоростях сдвига: 200об/с, 100об/с, 20об/c.- в 1-й группе на 11,6%; 11,4%, 9,5% соответственно (все р<0,05), во 2-й - на 26,7% (р<0,05), 17,1%, 11,2% (все р<0,05); в 3-й - на 12%, 11,1%, 9,2% (все р<0,05); в 4-й -20,3%, -10,7%, -7,8% (все р<0,05). При этом изучаемые показатели существенно приблизились к нормальным значениям, но не достигли их. Кроме того, увеличился индекс деформируемости эритроцитов (ИЭ) на 5,6% (р>0,05), 5,9% (р>0,05), 5,1% (р> 0,05), 5,4% (р>0,05) при достоверном (р<0,05) уменьшении индекса агрегации эритроцитов (ИАЭ) на 8,7%, 9,8%, 8,1%, 8,4% в первой, второй, третьей и четвертой группах соответственно что указывает на улучшение реологических свойств крови, как в крупных сосудах, так и в микроциркуляторном звене.
Таким образом, наиболее существенные положительные изменения в тромбоцитарном звене гемостаза и реологических свойствах крови были получены при применении олмесартана, как в моно- , так и в комбинированной терапии с индапамидом.
Изменения реологических свойств крови в группах наблюдения, на наш взгляд, можно связать, как с улучшением показателей центральной гемодинамики и увеличением скорости кровотока, так и со снижением агрегационной активности эритроцитов, что косвенно указывает на улучшение функции эндотелия и вазопротективный эффект на фоне органопротективной антигипертензивной терапии. Кроме того, на фоне улучшения вазопротекции повышается образование эндотелиального NО, который предупреждает агрегацию тромбоцитов и противодействует вазоконстрикторному действию тромбоксана – А2 и серотонина, продуцируемых тромбоцитами.
Установлено, что утолщение толщины комплекса интима-медиа (ТИМ) более 75-процентиля для возраста, пола, расы ассоциировано с повышением риска сердечно-содистых осложнений и фатального исхода независимо от традиционных факторов риска [19].
Мета-анализ Lorenz М. W et al. продемонстрировал значительное увеличение риска инфаркта миокарда в 1,26 раза и инсульта в 1,32 раза на каждое стандартное отклонение увеличения ТИМ [20].
При изучении влияния указанной терапии на динамику ТИМ общей сонной артерии были получены следующие результаты, представленные в табл. 4.
Таблица 4. Изменение показателя комплекса ТИМ к концу 6 месяца терапии (n=75), (М±sd, Δ%)
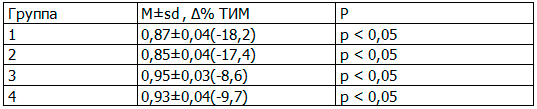
Примечание: ТИМ – толщина комплекса интима-медиа.
Как видно из табл. 4, наиболее выраженный вазопротективный эффект был получен в группе больных принимаваших олмесартан как в моно -, так и в комбинации с индапамидом. Таким образом, полученные результаты исследования указывают на улучшение структуры и функции сосудистой стенки, в том числе и а.ventricularis у больных с АГ в сочетании с ХНТ.
Влияние различных схем терапии на течение ХНТ у больных с АГ.
С этой целью исследуемые группы были распределены по степени хронической нейросенсорной тугоухости: 1 степень тугоухости была выявлена у 10 (13,3%) пациентов, 2 степень – 31 (41,3%), 3 степень – 30 (40%) и 4 степень – 4 (5,3%). Шум различной интенсивности беспокоил 62 больных (82,6%).
На фоне проводимой терапии к 6 месяцу наблюдения было достигнуто улучшение аудиометрических показателей во всех 4 группах наблюдения (табл. 5).
В 1 группе средняя слуховая чувствительность в области низких частот улучшился в среднем на 12,3±1,1дБ, в области средних - на 14,1±1,3дБ, высоких - на 13,9±1,5дБ. Во 2-й группе - в области: низких частот улучшился в среднем на 12,2±1,2 дБ, средних - на 13,7±1,3дБ, высоких - на 13,2±1,4дБ. В 3-й группе слух в области: низких частот улучшился в среднем на 8,3±1,2дБ, средних - на 9,3±1,2дБ, высоких - на 8,7±1,5дБ. В 4-й группе слух в области: низких частот улучшился в среднем на 8,4±1,3дБ, средних - на 9,5±1,4дБ, высоких - на 8,6±1,6дБ. Динамика указанных показателей носила достоверный характер во всех группах наблюдения (р<0,05), особенно выраженная при применении в схемах лечения олмесартана. Межгрупповые различия носили достоверный характер: р(1-3)< 0,05, р(2-4)<0,05.
Таблица 5. Изменение показателей тональной пороговой аудиометрии с АГ I-II степени с ХНТ (Δ,%)
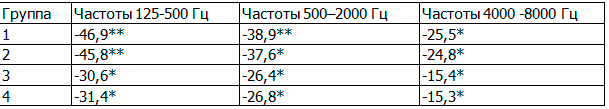
Примечание: * - р<0,05, ** - p<0,01.
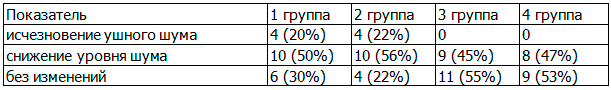
Ушной шум, как субъективный критерий, значительно влияющий на качество жизни, зачастую являлся доминирующей жалобой больных с АГ и ХНТ. При анализе полученных результатов исследования по динамике уровня шума на фоне различных схем терапии был получен более выраженный благоприятный эффект у больных 1й и 2-й групп, получавших олмесартан. Так, после 6-месячного лечения: в 1-й группе ушной шум исчез у 4 (20%), уровень шума снизился у 10 (50%), у 6 (30%) больных шум сохранился; во 2-й группе ушной шум исчез у 4 (22%), уровень шума снизился у 10 (56%), у 4 (22%) больных шум сохранился; в 3-й группе шум не исчез ни у одного больного, уровень шума снизился у 9 (45%), у 11 больных (55%) шум сохранился; в 4-й группе - не исчез ни у одного больного, уровень шума снизился у 8 больных (47%), у 9 (53%)- шум сохранился на прежнем уровне (табл. 6).
Таблица 6. Изменение уровня ушного шума на фоне терапии олмесартаном у больных АГ I-II степени с ХНТ (Δ,%)
Проведенное исследование показывает, что именно олмесартан в большей степени подходит для лечения АГ у больных с ХНТ, поскольку не только эффективно снижает АД и нормализует его суточный профиль, но и существенно влияет на толщину КИМ, агрегационную активность тромбоцитов, вязкость крови, микроциркуляцию, липидный обмен, что в конечном результате приводит к улучшению слуха и уменьшению шума.
Таким образом применение олмесартана, как в монотерапии, так и в комбинации с индапамидом у больных с АГ I - II степени с ХНТ, оказывает более выраженный антигипертензивный эффект, нормализует показатели суточного ритма АД. Также олмесартан в большей степени, чем эналаприл уменьшает толщину комплекса интима-медиа. Терапия с включением олмесартана оказывает положительное влияние на реологические и коагулогические свойства крови, способствует нормализации исходно нарушенного липидного спектра. Олмесартан в наибольшей степени по сравнению с эналаприлом, приводит к улучшению аудиометрических параметров.
