Лизосомальные цистеиновые протеиназы (ЛЦП), или катепсины, относятся к протеолитическим ферментам, и первоначально были идентифицированы, как протеазы, действующие в лизосомах. Исследования последних лет раскрыли нетрадиционные роли для катепсинов во внеклеточном матриксе, а также в цитозоле и в ядре [6, 10].
В настоящее время активно изучается активность ЛЦП при различных патологических состояниях, в частности при сердечно-сосудистых заболеваниях. Показано, что лизосомальные цистеиновые протеиназы – катепсины L и Н способны секретироваться во внеклеточную среду, где они и обнаруживаются при различной сосудистой патологии [12]. Способность ЛЦП к секреции и наличие данных об участии катепсинов В и L в деградации внеклеточных белков – ламинина, фибронектина, коллагена IV типа [9] заставляет рассматривать данную группу ферментов в качестве одного из наиболее вероятных факторов развития патологии сосудистой стенки.
В настоящее время доказано, что ЛЦП, а также дисбаланс между ЛЦП и их внутриклеточным ингибитором – цистатином С играют одну из ведущих ролей в ремоделировании сосудистой стенки при патологии сосудов – атеросклерозе [7] и аневризме аорты [12]. Тем не менее, участие ЛЦП в патологии венозной системы остаётся практически не изученным.
Последнее десятилетие ознаменовалось значительным прогрессом в развитии методов диагностики и оценки тяжести венозной дисфункции, что позволило получить более глубокие представления о хронических заболеваниях вен нижних конечностей. В настоящее время доказана и не вызывает сомнений роль воспаления в развитии и прогрессировании хронических заболеваний периферических сосудов [9]. В то же время, роль воспаления и его клеточного субстрата – лейкоцитов в повреждении венозной стенки при первичных (не тромботических) формах хронических заболеваний вен и, прежде всего, при варикозной болезни, по-прежнему вызывает научные споры [1]. Тем не менее, всё больше появляется исследований, подтверждающих наличие повышенной адгезии лейкоцитов к стенке варикозно поражённого сосуда [1,8], что в настоящее время объясняют дисфункцией эндотелия с избыточной продукцией молекул клеточной адгезии [2].
В связи с вышеизложенным, актуальным представляется изучение зависимости изменений активности ЛЦП от выраженности клинических проявлений варикозного расширения поверхностных вен нижних конечностей, возможность количественной оценки которых даёт классификация СЕАР [4, 13].
Целью настоящей работы явилось изучение изменений активности лизосомальных цистеиновых протеиназ плазмы и различных фракций лейкоцитов крови у пациентов с варикозным расширением поверхностных вен нижних конечностей в зависимости от клинического класса и интегрированного индекса клинической тяжести.
Материалы и методы. В работе представлены результаты обследования 24-х пациентов с диагнозом «варикозное расширение поверхностных вен нижних конечностей», находившихся на стационарном лечении в клинике сосудистой хирургии ГБОУ ВПО РязГМУ Минздравсоцразвития России в 2011–2012 г. Средний возраст пациентов составил 47,6±13,7 года. Степень тяжести клинических симптомов была оценена по классификации СЕАР от С0 до С5. Согласно этой классификации пациенты были разделены на 3 группы: группа 1 – пациенты С0 – С1, группа 2 – пациенты С2 – С3, группа 3 – пациенты С4 – С5. Кроме того, для каждого клинического случая был рассчитан интегрированный индекс клинической тяжести.
Контрольную группу составили здоровые доноры, забор крови осуществлялся в отделении переливания крови ГБУ РО «Областная клиническая больница». Исследуемые группы были сопоставимы по возрасту и полу.
Для исследования использовали ЭДТА (этилендиаминтетрауксусная кислота) – стабилизированную кровь, взятую из локтевой вены утром натощак. Для выделения различных фракций лейкоцитов эритроциты осаждали 6% раствором декстрана, после чего плазму со взвешенными в ней лейкоцитами подвергали изопикническому центрифугированию на градиенте плотности урографин – полиглюкин. При этом получали две фракции лейкоцитов: интерфазный слой содержал моноядерные лейкоциты, представленные лимфоцитами и моноцитами, осадок – полиморфноядерные гранулоциты. Клетки отмывали 0,15 М раствором хлорида натрия, пропускали через капроновый фильтр, подсчитывали в камере Горяева и гомогенизировали пипетированием через иглу малого диаметра. Активность катепсинов L и Н измеряли в полученном гомогенате спектрофлуориметрическим методом по Barrett & Kirschke [5].
Для оценки статистической значимости межгрупповых различий использовали непараметрический U-критерий Манна–Уитни.
Результаты и обсуждение. Оценка изменений активности катепсинов L и Н в плазме и лейкоцитах крови у пациентов различных классов клинической тяжести по сравнению с контрольной группой выявила ряд статистически значимых отличий (табл. 1).
Активность катепсина L в плазме повышалась у пациентов по сравнению с контролем, причём его повышение оказалось статистически значимым в группе с наименьшей выраженностью тяжести клинических симптомов: группа 1 (С0-С1). В полиморфноядерных лейкоцитах (ПМЯЛ) мы также наблюдали повышение активности катепсина L, статистически значимым оказалось повышение в группах 1 (С0-С1) и 2 (С2-С3). В моноядерных лейкоцитах (МЯЛ) активность катепсина L достоверно снижалась во 2 (С2-С3) и 3 (С4-С5) группах.
Таблица 1. Показатели активности катепсинов L и Н в плазме и клетках крови больных варикозным расширением вен в зависимости от класса клинической тяжести заболевания (M±S)
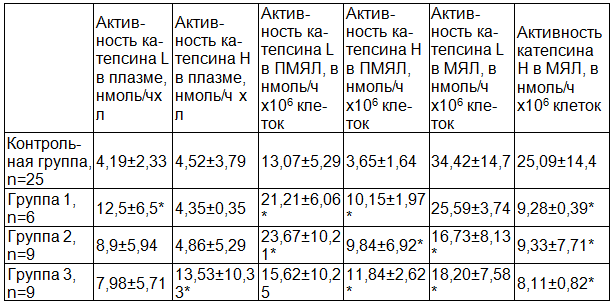
Примечание: * – статистически значимые отличия от контрольной группы (р<0,05).
Активность катепсина Н достоверно повышалась в плазме пациентов с варикозным расширением вен 3 группы (С4-С5) и достоверно повышалась в полиморфноядерных лейкоцитах всех трёх групп пациентов по сравнению с группой контроля, и достоверно снижалась у пациентов всех трёх групп в моноядерных лейкоцитах.
При оценке корреляционной связи активности катепсинов L и Н в плазме и различных фракциях лейкоцитов крови при варикозном расширении вен нижних конечностей с интегрированным индексом оценки тяжести симптомов заболевания с учётом данных клинических проявлений по классификации СЕАР нами было обнаружено следующее.
Корреляционной связи между активностью катепсина L, содержащегося в плазме и лейкоцитах крови, и балльной оценкой степени клинической тяжести по классификации СЕАР обнаружено не было.
Наиболее выраженной оказалась корреляционная связь между активностью катепсина Н в моноядерных лейкоцитах и оценкой СЕАР – средняя cтепень корреляции (r = 0,55).
Корреляция между активностью катепсина Н в полиморфноядерных лейкоцитах и интегральной оценкой по классификации СЕАР оказалась средней (r = 0,49). Также средними оказались корреляционные значения между активностью катепсина Н в плазме крови и интегрированным индексом оценки тяжести симптомов по классификации СЕАР (r = 0,41).
Выводы
- Активность лизосомальных цистеиновых протеиназ – катепсинов L и Н у пациентов с варикозным расширением поверхностных вен нижних конечностей меняется разнонаправлено: повышается в плазме и полиморфноядерных лейкоцитах и снижается в моноядерных лейкоцитах.
- Активность катепсина L в плазме и полиморфноядерных лейкоцитах достоверно повышается у пациентов с малой степенью клинических проявлений варикозного расширения вен нижних конечностей согласно классификации СЕАР, в моноядерных лейкоцитах достоверно понижается при более развитой симптоматике.
- Активность катепсина Н достоверно повышается в плазме у пациентов с варикозным расширением вен с более выраженными поражениями – стадии С4-С5 по классификации СЕАР и в гранулоцитах всех трёх групп пациентов, а также достоверно снижается в моноядерных лейкоцитах всех трёх групп пациентов.
- Активность катепсина Н коррелирует с интегрированным индексом оценки степени тяжести симптомов по СЕАР - классификации, что позволяет предположить более активное участие катепсина Н тканей и лейкоцитов в патогенезе варикозного расширения поверхностных вен нижних конечностей.
