Шизофрения – психическое расстройство, характеризующееся широким диапазоном симптомов, обычно подразделяемых на продуктивные, такие как бред, галлюцинации и расстройства мышления, и негативные, включающие в себя нарушения в когнитивной и социальной сфере, обеднение речи, эмоциональное уплощение [13]. Несмотря на разработанные в настоящее время лечебные подходы, заболевание в большинстве случаев характеризуется неблагоприятным исходом. Значительный объем данных указывает на роль оксидантного стресса в патогенезе шизофрении. Активные формы кислорода (АФК) дестабилизируют структуру фосфолипидной мембраны и изменяют ее текучесть и проницаемость, что приводит к нарушениям проведения сигнала и обратного захвата и высвобождения нейротрансмиттеров, что в конечном итоге оказывает влияние на структуру и функцию головного мозга. В патогенез шизофрении вовлечены нарушения сигнальных путей с участием дофамина, адреналина, норадреналина, серотонина и глутамата [12]. Вызванные воздействием АФК нарушения также могут участвовать в возникновении клинически важных последствий при шизофрении, включая тяжесть психопатологических симптомов, позднюю дискинезию и паркинсонизм [3, 13].
К биомаркерам оксидантного стресса относятся антиоксиданты, маркеры оксидантного повреждения и маркеры образования АФК [1-3]. Чаще всего при шизофрении для оценки антиоксидантной защиты проводят количественное определение антиоксидантных ферментов, таких как супероксиддисмутаза (СОД), глутатионпероксидаза (ГП) и каталаза, а также уровень глутатиона [13], однако полученные данные противоречивы [4]. В качестве маркеров оксидантного повреждения обычно оценивают концентрацию малонового диальдегида (МДА), 3-нитротирозина, карбонильных групп белков и 8-гидрокси-2-дезоксигуанозина [13]. К маркерам образования АФК относятся ксантиноксидаза (КСО), гомоцистеин и оксид азота [5].
В исследованиях пациентов, не получавших ранее лекарственного лечения, показана существенная роль АФК и нарушения метаболизма незаменимых полиненасыщенных жирных кислот (НПНЖК) в патогенезе заболевания [8;11]. Усиление оксидантного стресса в сочетании со снижением уровня НПНЖК приводит к усилению перекисного окисления липидов. Предполагаемые механизмы усиления оксидантного стресса включают катаболизм дофамина [6], метаболизм оксида азота, нарушения в митохондриальной электрон-транспортной цепи [9] и генетические факторы. Некоторые авторы указывают на большую выраженность оксидантного стресса при лечении классическими нейролептиками, по сравнению с атипичными нейролептиками, что может вносить дополнительный вклад в нарушение баланса оксидантов и антиоксидантов в организме. Предполагается, что оксидантный стресс также может вносить вклад в развитие побочных эффектов, наблюдаемых при применении традиционных нейролептиков [7]. В то же время некоторые исследователи не обнаруживают связи оксидантного стресса с лечением нейролептиками [10, 14]. Так, X.Y. Zhang с соавт. (2006), при измерении различных биомаркеров оксидантного стресса, включая МДА, СОД, каталазу и ГП у пациентов с шизофренией, получавших лечение клозапином, рисперидоном и классическими нейролептиками, не обнаружили значимых различий между группами [15].
Результаты недавно проведенного мета-анализа биомаркеров оксидантного стресса при шизофрении по сравнению со здоровыми добровольцами продемонстрировал, что противоречивость результатов в значительной степени связана с влиянием этнической принадлежности, источника исследуемой популяции, техники измерения, воздействия антипсихотических препаратов и стадии заболевания, а также особенностей образа жизни пациентов [3].
Целью настоящего исследования явилось изучение показателей свободнорадикальных процессов у больных шизофренией и влияния на них терапии нейролептиками.
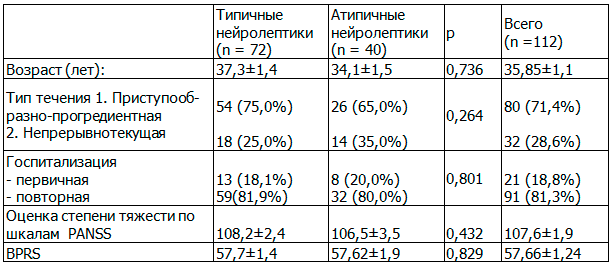
Материал и методы исследования. Проведено комплексное клинико-лабораторное исследование 112 мужчин в возрасте от 18 до 64 лет (средний возраст составил 35,85±1,12 лет) с диагнозом шизофрения, установленным в соответствии с критериями МКБ-10 (при наличии в течение более 1 месяца хотя бы одного симптома первого ранга или не менее двух симптомов второго ранга). Длительность заболевания составила от 0 до 44 лет, средняя продолжительность болезни на момент включения в исследование - 10,19±9,70 лет. Впервые госпитализирован в психиатрический стационар 21 (18,8%) больной, 91 (81,2%) – госпитализированы повторно, причем 22 (19,6%) пациентов страдали шизофренией менее 1 года, 48 (42,9%) пациентов от 1 до 10 лет, продолжительность заболевания более 10 лет отмечалась у 42 (37,5%) пациентов.
Средний балл по шкале PANSS на момент поступления составил 107,62±1,96 баллов (от 54 до 168 баллов), средний балл по шкале BPRS - 57,66±1,24 (от 30 до 89 баллов).
Пациенты были рандомизированы на две группы:
1). В первую группу вошли 72 больных (64,3%), получавших терапию типичными нейролептиками (галоперидол, трифтазин).
2). В основную группу вошли 40 больных (35,7%), получавших атипичные нейролептики (рисперидон, оланзапин, кветиапин) (табл. 1).
Таблица 1. Распределение по возрасту, типу течения, длительности заболевания, выраженности клинической симптоматики
Оценка состояния пациента выполнялась в динамике (на 1, 7, 21 сутки) на основе комплекса клинических, лабораторных, инструментальных методов исследования: 1) изучения анамнеза и жалоб; 2) клинического и психического состояния больного; 3) стандартизированной оценки психического состояния по шкалам PANSS и BPRS, проводившейся одним исследователем; 4) исследования свободнорадикальных процессов (СРП) в плазме крови по показателям генерации активных форм кислорода лейкоцитами - базальные (ПИХЛб) и стимулированные зимозаном (ПИХЛс) показатели интенсивности хемилюминесценции лейкоцитов, по показателям антиперекисной активности вторичной плазмы (АПА), малонового диальдегида (МДА); 5) исследование общего и биохимического анализов крови и мочи. В качестве нормального уровня СРП использовали показатели крови здоровых людей и доноров крови, посещавших станцию переливания крови. Группа сравнения состояла из 33 здоровых добровольцев в возрасте от 30 до 63 лет, средний возраст 50,12±11,76 лет.
Статистическая обработка результатов проводилась с применением программ Microsoft Excel и пакета статистического анализа данных SPSS 20.0 по стандартным критериям. Различия считались статистически значимыми при уровне ошибки p<0,05.
Результаты исследования и их обсуждение. Полученные данные продемонстрировали наличие значимого дисбаланса кислородного этапа СРП у больных шизофрении на 1-е сутки госпитализации. По сравнению с группой здоровых добровольцев зарегистрировано статистически значимое снижение уровня ПИХЛб в среднем в 2,71 раза (р<0,05), повышение ПИХЛс в 2,34 раза (р<0,05). В то же время в первые сутки не было обнаружено значимых различий по уровню АПА и МДА в группах здоровых добровольцев и больных шизофренией, но обнаруживалась тенденция к повышению перекисно-липидного маркера МДА в среднем в 1,13 раза на фоне увеличения уровня защитного маркера АПА в 1,10 раза (табл. 2). Таким образом, можно говорить о значимой роли дисбаланса кислородного этапа СРП у больных шизофренией при относительно сохранном перекисно-липидном этапе и высокой защитной антиоксидантной активности плазмы крови на начальных этапах приступа заболевания.
Таблица 2. Показатели СРП у больных шизофренией при поступлении в стационар
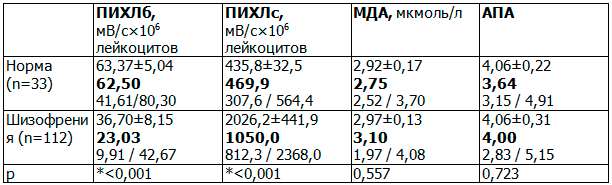
Примечание: здесь и далее результаты представлены в виде: первая строка (М±m) – среднее значение ± стандартная ошибка средней; вторая строка (Me) – медиана; третья строка (quartiles 25%/75%) – нижний и верхний квартили; * – p <0,05 – достоверное отличие показателя от нормы (критерий Манна-Уитни).
В ходе исследования все больные получали стандартное лечение как типичными, так и атипичными нейролептиками. На фоне лечения отмечалось снижение выраженности психопатологической симптоматики по шкалам PANSS и BPRS в 1,23 раза уже на 7-е сутки пребывания в стационаре (p<0,05). К 21-м суткам отмечалось дальнейшее снижение общего балла по использованным психометрическим шкалам в 1,47 и 1,46 раз, соответственно (p<0,05) (рис. 1).
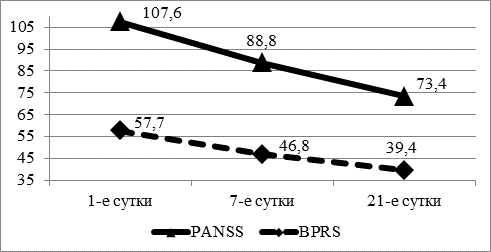
Рис. 1. Динамика состояния по шкалам PANSS и BPRS.
СР-дисбаланс усиливался пропорционально продолжительности заболевания. Так, уровень ПИХЛб был в 3,09 раза ниже нормы у больных с минимальной продолжительностью заболевания (менее 1 года) и в 3,67 и 2,56 раза ниже нормы у пациентов с длительностью заболевания 1-10 лет и >10 лет, соответственно (p <0,05). ПИХЛс был в 3,38 раз выше нормы у пациентов с продолжительностью заболевания до 1 года (р<0,05), в 2,23 раза выше нормы у пациентов с длительностью заболевания от 1 года до 10 лет и в 2,44 раза выше нормы у пациентов, страдающих шизофренией более 10 лет (p <0,05). Уровень МДА был на 23% выше нормы у пациентов с длительностью заболевания 1-10 лет (p<0,05). Уровень АПА в группе пациентов с продолжительностью заболевания от 1 до 10 лет был на 15% выше нормы (р<0,05). Сравнительный анализ выявил, что у больных с продолжительностью заболевания от 1 до 10 лет уровень МДА был в 1,3 раза (р<0,01) выше, а уровень АПА в 1,18 раз выше (р<0,05), чем у больных с продолжительностью заболевания более 10 лет (табл. 3).
Таблица 3. Показатели ПИХЛб, ПИХЛс, МДА и АПА у больных шизофренией в зависимости от длительности заболевания и по сравнению с нормой
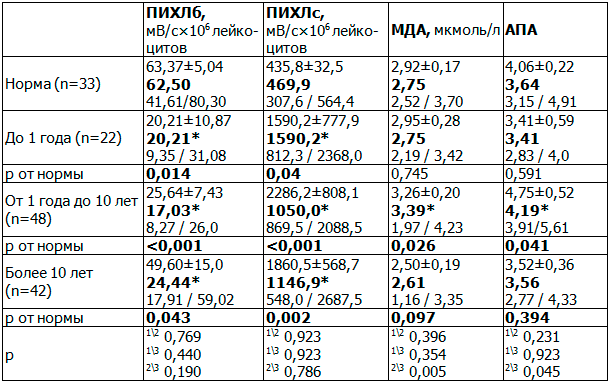
Примечание: длительность заболевания до 1 года и от 1 года до 10 лет (1\2) ; до 1 года и более 10 лет (1\3) ; от 1 года до 10 лет и более 10 лет (2/3).
Полученные данные указывают на максимальную выраженность повреждения головного мозга на клеточном уровне в период от 1 до 10 лет с момента возникновения шизофрении с компенсаторным повышением активности антиоксидантных защитных систем организма (АПА), в то время на отдаленных этапах заболевания (более 10 лет) снижается как активность деструктивных процессов, так и компенсаторного повышения АПА, что говорит о достижении некоторого баланса СРП. В то же время на момент госпитализации вне зависимости от длительности заболевания регистрируется выраженный дисбаланса кислородного этапа СРП (снижение уровня ПИХЛб и повышение уровня ПИХЛс), что указывает на тесную взаимосвязь с обострением психопатологической симптоматики.
Дисбаланс показателей СРП увеличивался пропорционально степени выраженности психопатологической симптоматики (табл. 4).
Таблица 4. Показатели свободнорадикальных процессов при шизофрении в зависимости от степени выраженности психопатологической симптоматики по шкале BPRS
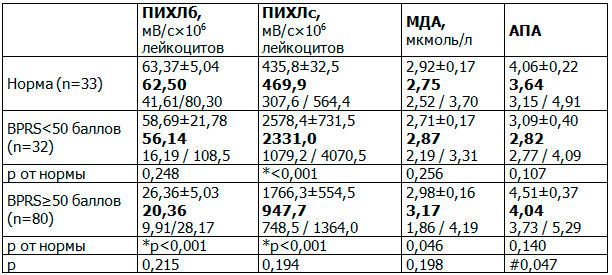
У пациентов с выраженностью психопатологической симптоматики <50 баллов по шкале BPRS обнаруживался дисбаланс кислородного этапа СРП в виде повышения уровня ПИХЛс в 5 раза относительно нормы. У больных со степенью выраженности психопатологической симптоматики по шкале BPRS 50 баллов и более отмечалось значимое снижение уровня ПИХЛб в 3 раза и повышение уровня ПИХЛс в 2 раза, а также активация перекисно-липидного этапа СРП в виде повышения уровня МДА на 15% по сравнению с нормой на фоне роста уровня АПА на 43% по сравнению с пациентами с умеренно выраженной симптоматикой.
При оценке влияния терапии нейролептиками на показатели СРП у больных шизофренией были выявлены следующие закономерности. Уровень ПИХЛб на 1-е сутки был в 2,62 раза ниже нормы у больных, получавших типичные нейролептики, и в 3,06 раз ниже нормы у больных, получавших атипичные нейролептики (p<0,05 по сравнению с нормой). К 7-м суткам лечения в обеих группах отмечался рост уровня ПИХЛб, не достигавший статистической значимости. Уровень ПИХЛб в группе больных, получавших атипичные нейролептики, демонстрировал стойкую тенденцию к росту на 7-е и 21-е сутки лечения, в то время как в группе больных, получавших типичные нейролептики, он несколько повышался на 7-е сутки и вновь снижался практически до исходного уровня к 21-м суткам лечения (p>0,05).
На первые сутки уровень ПИХЛс был выше нормы в 2,89 раз и в 2,01 раз у больных, получавших типичные и атипичные нейролептики, соответственно (p<0,05 по сравнению с нормой). На фоне лечения к 7 суткам отмечалось не значимое нарастание уровня ПИХЛс у больных, получавших типичные нейролептики в 1,82 раза на фоне небольшого снижения показателя в 1,04 раза в группе больных, получавших типичные нейролептики. К 21 суткам стационарного лечения в обеих группах отмечалась тенденция к снижению ПИХЛс.
Уровень АПА был сопоставим с нормой в обеих группах на 1-е сутки, однако к 7 суткам лечения на фоне приема атипичных нейролептиков отмечалось повышение уровня АПА в 1,41 раз на фоне снижения показателя в группе больных, получавших типичные нейролептики в 1,34 раза (p<0,05). К 21 суткам отмечалась нормализация уровня АПА в обеих группах.
Уровень МДА в 1-е сутки лечения был сопоставим в обеих группах. обнаружена тенденция к снижению МДА на 7 сутки в 1,62 раза с нормализацией показателя к 21 суткам лечения на фоне лечения типичными нейролептиками, в то время как на фоне приема атипичных нейролептиков уровень МДА несколько повышался к 7 суткам лечения в 1,08 раз и снижался до нормальных показателей к 21 суткам лечения (табл. 5).
Таблица 5. Динамика СРП у больных шизофренией в зависимости от типа принимаемых нейролептиков
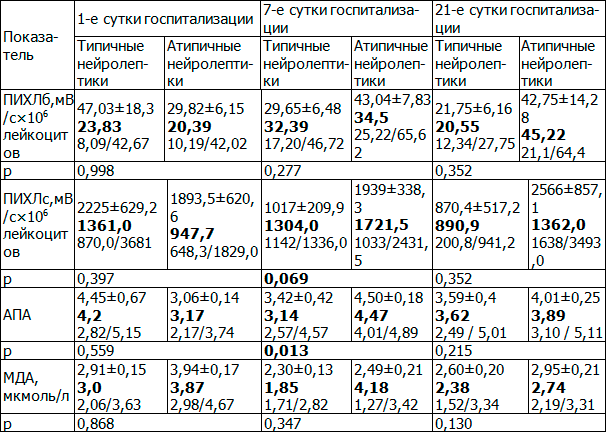
Данные в отношении повышения уровня АПА у больных шизофренией на фоне приема атипичных нейролептиков могут свидетельствовать в пользу преимуществ при назначении этой группы препаратов у больных с выраженным дисбалансом СРП с целью уменьшения повреждающего действия оксидантного стресса в первые 7-10 суток лечения.
Заключение. Таким образом, исследование СРП у больных шизофренией продемонстрировало значительные различия по сравнению с группой нормальных добровольцев, проявляющееся в дисбалансе кислородного этапа СРП в виде снижения уровней ПИХЛб и повышения уровней ПИХЛс на момент поступления в стационар в состоянии обострения заболевания. Выраженность психопатологической симптоматики обнаруживает взаимосвязь с показателями СРП, проявляясь повышением маркеров перекисно-липидного повреждения и дисбалансом кислородного этапа СРП у больных с уровнем 50 и более баллов по шкале BPRS. Назначение атипичных нейролептиков способствует увеличению защитной АПА плазмы, что может свидетельствовать в пользу целесообразности назначения препаратов этой группы у больных с выраженным дисбалансом СРП.
