Известно, что в полости рта содержится больше видов различных бактерий, чем в других полостях. Количество видов бактерий, включая анаэробы, колеблется от 100 до 200. Это объясняется не только тем, что бактерии, так называемые транзитные микроорганизмы, попадают в полость рта с воздухом, водой, пищей, но речь идет о резидентной бактериальной флоре полости рта, образующей довольно сложную и стабильную экосистему [4,6,7].
Согласно современным представлениям, смешанная слюна и ротовая жидкость - коллоидный раствор, построенный из мицелл фосфатов и гидрофосфатов кальция, окруженных плотными водно-белковыми оболочками. В слюне присутствуют: лизоцим, лактоферин, лактопероксидаза и другие ферменты - компоненты системы комплемента, а также гранулоциты и макрофаги - факторы неспецифической резистентности организма. Защитная активность слюны связана как с их непосредственным действием на микробы, так и с торможением адгезии к эмали зуба или эпителию слизистой оболочки [1,5 ,7].
Герпесвирусы человека 1 и 2 типов относятся к подсемейству Alphaherpes virine и характеризуются эффективным разрушением пораженных клеток, относительно коротким репродуктивным циклом и способностью пребывать в латентной форме в ганглиях нервной системы. Вирус содержится в слюне как при наличии поражений слизистых оболочек полости рта, так и без таковых, когда заболевание протекает в бессимптомной форме. Клинически выраженная первичная герпетическая инфекция наблюдается чаще у детей в возрасте от 6 месяцев до 5 лет и реже у взрослых. У детей наиболее частой формой первичного герпеса является афтозный стоматит, сопровождающийся обширным поражением слизистой оболочки полости рта [2,6].
Одним из наиболее информативных показателей - «индикаторов» состояния как организма в целом, так и полости рта являются микрофлора полости рта и факторы местной и общей неспецифической резистентности. Результаты изученных материалов за последнее десятилетия показывает, что в исследуемых материалах больных с различными патологиями полости рта состояние микрофлоры разнообразно [1,4].
Исходя из вышеизложенного, мы поставили перед собой цель изучить состояние микрофлоры полости рта и неспецифических факторов защиты у детей с острым герпетическим стоматитом (ОГС).
Таблица 1. Состояние микрофлоры полости рта у детей в норме и при остром герпетическом стоматите(lg KOE/мл, М±m
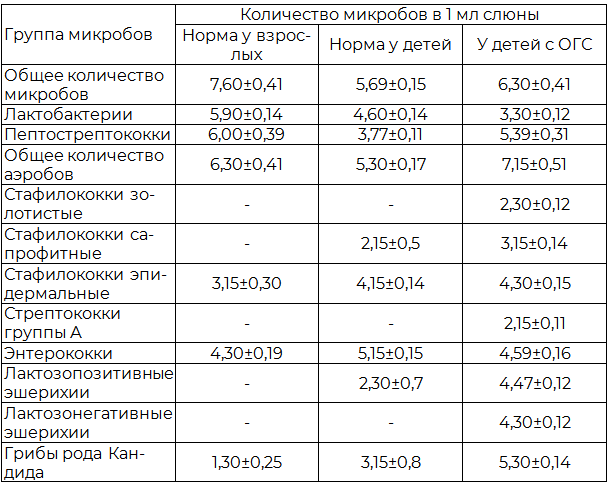
Примечание: lg - логарифм; KOE – колониеобразующая единица, ОГС - острый герпетический стоматит.
Материал и методы. Исследования проведены у 29 детей в возрасте от 8 месяцев до 3 лет, не отягощенных какими-либо общими заболеваниями. Больные лица были разделены на 2 группы. В первой группе 11 детей, у которых отсутствовал герпетический стоматит и какие-либо заболевания зубов, составили контрольную группу. 18 детей второй группы в период обследования болели острым герпетическим стоматитом.
У всех обследуемых утром через 2 часа после приема пищи в стерильные пробирки собирали ротовую жидкость. Из полученного материала в лаборатории готовили серийные разведения, из которых в последующем определенный объем засевали на поверхность дифференциально-диагностических питательных сред: агар для анаэробов, среда Эндо, молочно-солевой агар, среда Калина, кровяной агар, среда МРС-4, Сабуро и др. после инкубации в течение 24-72 часов в условиях термостата подсчитывали количество выросших колоний и переводили их в lg KOE/мл слюны. Для определения анаэробных микробов и лактобактерий использовали метод «запаянных» полиэтиленовых мешочков, заполненных магистральным природным газом.
Таблица 2. Состояние неспецифических факторов защиты полости рта у детей в норме и при ОГС
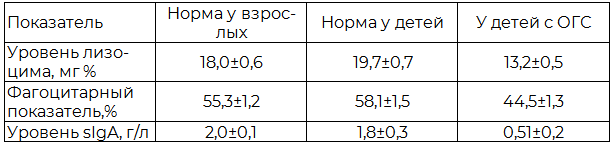
Примечание: sIgА - секреторный иммуноглобулин A.
Наряду с микробиологическими исследованиями у больных изучали иммунологические показатели. Для определения фагоцитарной активности нейтрофилов в слюне ее забор и обработку осуществляли по методу М.А. Темурбаева [8]. Отобранную слюну очищали, промывали забуференным раствором и центрифугировали при 1500 оборотов в минуту в течение 10 минут, надосадочную жидкость сливали, а к осадку добавляли 0,5 мл физиологического раствора. К 0,1 мл полученной лейковзвеси в пробирку добавляли 0,05 мл микробной взвеси суточной культуры Staphylococcus аureus (штамм 13) в концентрации 0,5 млрд. микробных тел/мл. пробирки с реактивной смесью встряхивали и помещали в термостат при 370 С на 30 минут. После инкубации пробирки вновь встряхивали и готовили мазки, которые фиксировали смесью Никифорова 20 мин, а затем окрашивали по Романовскому-Гимзе. Затем под микроскопом определяли фагоцитарный показатель [3].
Для определения активности лизоцима в слюне исследовали способ стерильных бумажных дисков. Забор слюны производили натощак в стерильные пробирки. В них тщательно пропитывали бумажные диски, затем эти диски укладывали на поверхность питательного агара в чашках Петри, засеянных газоном суточной культуры Micrococcus Lizodenticus (штамм 2665 Государственного контрольного института (ГКИ) им. Л.А. Тарасевича), посевы инкубировали в термостате при температуре 37ºС, активность лизоцима в слюне определяли по методу диффузии в агаре.
Уровень секреторного IgA в слюне определяли реакцией преципитации в геле по Манчини.
Результаты и обсуждение. Многочисленными исследованиями доказано, что в подавляющем большинстве случаев патологические процессы в полости рта сопровождаются дисбиотическими изменениями в микрофлоре ротовой жидкости, что, в свою очередь, приводит к нарушению состояния показателя системы иммунитета.
Учитывая ассоциативный характер «микробного пейзажа» при различных процессах в полости рта, закономерно возникает вопрос о роли отдельных представителей микрофлоры в развитии и течении заболевания. Выяснить это нам поможет изучение количественного и качественного соотношения отдельных представителей микробной флоры (табл. 1).
Как видно из табл. 1, при сравнении микрофлоры полости рта у здоровых взрослых людей и детей на первый взгляд особых отличий нет, однако при более глубоком анализе можно заметить, что у детей количество анаэробов на 2 порядка меньше, чем у взрослых, хотя состав аэробной флоры различается незначительно. Одним из существенных отличий флоры детей от таковой у взрослых является постоянное наличие эшерихий и возрастание более чем в 2 раза количества грибов рода Кандида. Видимо, это закономерный эволюционный процесс, характерный для детского организма.
Как и следовало ожидать, у детей с герпетическим стоматитом отмечаются дисбиотические изменения в микрофлоре ротовой жидкости. При этом, как видно из табл. 1, происходит достоверное увеличение количества как анаэробной, так и факультативной флоры. Интересно, что в факультативной флоре наблюдаются и количественные и качественные сдвиги. Так, на фоне существенного увеличения количества стафилококков, эшерихий и грибов рода Кандида высеваются штаммы стрептококков, эшерихий и стафилококков с патогенными свойствами. Необходимо отметить, что сдвиги оказывают определенное влияние на течение основного заболевания, которое приводит к появлению осложнений в виде наслоения вторичных инфекций.
Наиболее интересные данные получены нами при изучении состояния резистентности неспецифических факторов защиты полости рта у детей. Как видно из табл. 2, эти показатели у взрослых и детей близки, хотя уровень лизоцима в слюне и фагоцитарный показатель у детей несколько выше, а уровень секреторного иммуноглобулина IgA несколько ниже, чем у взрослых.
Общеизвестно, что вирусы большинства инфекций оказывают на организм иммунодепрессивное воздействие, что подтверждают и наши исследования. Так, у детей, больных герпетическим стоматитом (табл. 2), достоверно снижены все изучаемые показатели, но особенно значительно уровень секреторного IgA.
Таким образом, основываясь на проведенных исследованиях, можно заключить, что у детей с острым герпетическим стоматитом в полости рта происходит развитие дисбиоза и иммунодефицитного состояния, еще более усугубляющих клиническое течение болезни. Это необходимо учитывать при оказании терапевтической помощи больным детям.
Выводы
1. У детей, страдающих острым герпетическим стоматитом, в полости рта развивается дисбиотическое состояние, характерной особенностью которого является существенное увеличение количества стафилококков, эшерихий и грибов рода Кандида.
2. У детей с острым герпетическим стоматитом в ротовой жидкости отмечается иммунодефицит, характерной особенностью которого является достоверное снижение уровня лизоцима, секреторного иммуноглобулина класса А и показателя фагоцитоза.
