Понятие "качество жизни" сегодня прочно вошло в медицинскую терминологию и все чаще используется как в научных исследованиях, так и в клинической практике [4]. Существует множество определений этого термина, включающих такие ключевые факторы, как показатели физического здоровья, социального положения, психического состояния пациента и другое.
Согласно рекомендациям всемирной организации здравоохранения (ВОЗ), качество жизни определяется как индивидуальное соотношение положения индивидуума в жизни общества (с учетом культуры и систем ценностей этого общества) с целями данного индивидуума, его планами, возможностями и степенью неустройства. Другими словами, качество жизни - это субъективный показатель удовлетворения личных потребностей в жизни, отражающий степень комфортности человека как внутри себя, так и в рамках своего общества [1].
По данным ВОЗ, двадцатый век можно охарактеризовать как век сердечно-сосудистых заболеваний. Высокая распространенность и смертность населения, ухудшение качества жизни, вызванного артериальной патологией, заставило говорить об «эпидемии» этих болезней во второй половине прошлого столетия. Более всего от этого страдает население экономически развитых стран Европы и Северной Америки, где как раз патология сердечно-сосудистой системы занимает первое место среди причин смертности. А после 50-х годов наблюдается широкое распространение атеросклероза в географические зоны, в которых раньше не встречался (Япония, Китай, некоторые африканские страны).
Россия занимает одно из первых мест в мире по причинам смерти от сердечно-сосудистых заболеваний. Начиная с середины 1960-х годов XX века этот показатель неуклонно растет. Сегодня двое из трех мужчин умирают от последствий атеросклеротических заболеваний сердца и сосудов.
В развивающихся странах, в том числе и в Российской Федерации (РФ), люди с сердечно-сосудистыми заболеваниями умирают на 15-25 лет раньше и, в целом, данная статистика не имеет отчетливой тенденции к снижению. Среди причин, приводящих к развитию атеросклероза артерий, в настоящее время на первое место выходят социально-экономические, урабанизационные факторы и генетическая предрасположенность. Развитие науки и техники, улучшение медицинской помощи населению способствует так же и увеличению продолжительности жизни, что в конечном итоге приводит к увеличению в процентном соотношении случаев заболевания [6].
Лечение больных атеросклерозом магистральных артерий представляет собой чрезвычайно трудную задачу. По литературным данным, предложено более 600 методов лечения атеросклероза периферических артерий. Ученые всего мира пришли к выводу, что ни один из методов лечения, претендующий на патогенетичность, не может быть универсальным вследствие многообразия факторов, влияющих на развитие заболевания [5]. Большинство пациентов, на начальных этапах заболевания, не обращает внимания на снижение дистанции безболевой ходьбы и к специалисту попадают уже на стадии субкомпенсации либо декомпенсации артериального кровообращения.
Хирургическое лечение является главной составляющей в лечении пациентов с периферическим атеросклерозом. Оно приводит к адекватному восстановлению кровотока в конечности, и, как следствие, сохранению ее функциональных способностей, а так же улучшению качества жизни. Но при окклюзионном поражении дистальных артерий, зачастую, хирургическое лечение невыполнимо. В таких случаях необходимо искать новые, альтернативные способы лечения периферического атеросклероза. Для купирования хронической ишемии необходима стимуляция развития новых коллатеральных сосудов. Этот способ лечения получил название терапевтического ангиогенеза [3, 7].
Концепция терапевтического ангиогенеза начала развиваться после работ Фолькмана (J. Folkman), который разработал теорию о развитии и поддержании адекватного кровоснабжения с помощью ангиогенных факторов роста в опухолевых тканях. После выявления факторов роста кровеносных сосудов исследователи стали проверять гипотезы по стимулированию ангиогенеза в терапии ишемических состояний. Впервые в клинической практике терапевтический ангиогенез применил Ишнер (J. Isner). В 1994 г. 71-летней пациентке в тяжелом состоянии с критической ишемией нижних конечностей (КИНК) с трофическими изменениями был введен ген VEGF-165 (VEGF - vascular endothelial growth factor) в плазмидном векторе [8,9] с хорошим клиническим эффектом.
Используя накопленные данные о терапевтическом ангиогенезе, на базе ОАО «Институт стволовых клеток человека» г. Москва, был разработан препарат «Неоваскулген» для лечения хронической артериальной ишемии. Он представляет собой высокоочищенную сверхскрученую форму плазмиды pCMV-VEGF165, кодирующей эндотелиальный фактор роста сосудов (VEGF - vascular endothelial growth factor) под контролем промотора (управляющего участка ДНК). Препарат вводится в мышцы ишемизированной конечности пациента, в результате происходит стимуляция неоангиогенеза - увеличение количества сосудов (артерий, вен, капилляров) в местах инъекции, что приводит к улучшению кровоснабжения конечности и уменьшению степени ишемии. В 2009-2010 г. препарат прошел клиническое исследование и в 2011 г. был зарегистрирован Министерством здравоохранения Российской Федерации и внесен в Государственный реестр лекарственных средств РФ (регистрационный номер ЛП-000671) [11].
Цель исследования - оценка динамики качества жизни на протяжении трех лет после проведения генной терапии у больных с хронической ишемией нижних конечностей II и III степени по классификации А.В. Покровского-Фонтейна при периферическом атеросклерозе.
Материал исследования. Одной из трех баз клинического исследования препарата явилось отделение сосудистой хирургии Ярославской областной клинической больницы. За 2009 и 2010 г. в исследование были включены 45 человек (36 мужчин и 9 женщин). Соотношение мужчин и женщин составило 4:1. Возраст пациентов варьировал от 40 до 78 лет и в среднем составил 63,3±5,8 года. Больные разделены на 2 группы в зависимости от исходной степени (ст.) хронической ишемии нижних конечностей (ХИНК). Первая группа - 27 больных со II степенью и вторая группа - 18 пациентов с III степенью ХИНК по классификации А.В. Покровского-Фонтейна. Всем больным проведено введение препарата «Неоваскулген» двукратно внутримышечно в ишемизированную конечность в дозировке 1,2 миллиграмм (мг) с интервалом в 14 дней.
Лечение проводилось на фоне обязательной стандартной сосудистой терапии согласно национальным рекомендациям по лечению пациентов с заболеваниями периферических артерий, включающим постоянный прием антиагрегантов, статинов, дозированную нагрузочную ходьбу, гиполипидемическую диету.
Все пациенты подписали добровольное информированное согласие на участие в клиническом исследовании. Критериями включения в программу были полная проходимость проксимального артериального русла, наличие неоперабельного дистального поражения или анатомо-функциональная недостаточность коллатеральных путей кровотока. Критериями исключения являлись: декомпенсация функции любого органа или системы (в том числе и критическая ишемия нижних конечностей IV ст. с трофическими изменениями), острое инфекционное заболевание, возраст старше 80 лет, онкологическое заболевание в сроки менее 5 лет до начала исследования.
Методы исследования. В качестве основных методов исследования динамики качества жизни у пациентов с хронической ишемией нижних конечностей до и после проведения генной терапии, нами использовался стандартный опросник SF 36, объективная оценка состояния нижних конечностей (локальный статус) и измерение дистанции безболевой ходьбы на тредмил-тесте. В работе использовалась русская версия опросника SF 36 [1]. При каждом визите (перед введением препарата, через 1, 2 и 3 года наблюдения) пациентам выдавался опросник, где они оценивали при помощи шкалы баллов свое состояние за последний год. Анкета включает 36 вопросов, которые отражают 9 концепций (шкал) здоровья: физическую работоспособность, социальную активность, степень ограничения физической работоспособности и социальной активности, психическое здоровье, энергичность или утомляемость, боль, общую оценку здоровья и его изменения. Опросник обеспечивает количественное определение качества жизни по указанным шкалам [4]. Чем выше значение показателя, тем лучше оценка по избранной шкале. Полученные данные подвергнуты статистической обработке с расчетом достоверности различий по методу Вилкоксона.
Также в оценке результатов использовался анализ локального статуса ХИНК, проводимый при каждом визите пациентов и оцененный по трёхбалльной шкале с учетом всех возможных клинических проявлений (болевой синдром, онемение мышц, гиперемия кожи, отек, похолодание конечностей, гипотрофия мышц, изменение цвета кожных покровов, появление некротических изменений).
Тредмил-тест проводился при помощи беговой дорожки на ровной поверхности (угол наклона 0 градусов) со скоростью 1 километр в час до появления болей в нижних конечностях.
После проведения курса лечения генным препаратом, производился обязательный мониторинг здоровья пациентов с обследованием (лабораторные показатели крови, электрокардиография (ЭКГ), ультразвуковое исследование (УЗИ) органов брюшной полости, ультразвуковая доплероскопия (УЗДС) артерий нижних конечностей, тредмил-тест) через 1, 2 и 3 года наблюдения.
Результаты. Осложнений, связанных с введением препарата, не зафиксировано. Не отмечено случаев появления трофических расстройств, аллергических реакций в месте инъекций препарата.
Значительно улучшились показатели качества жизни через 1 год наблюдения с последующим сохранением положительного результата в течение трех лет у всех пациентов 1-й группы (II степень ХИНК). Данные динамики физического компонента здоровья представлены на рис. 1.
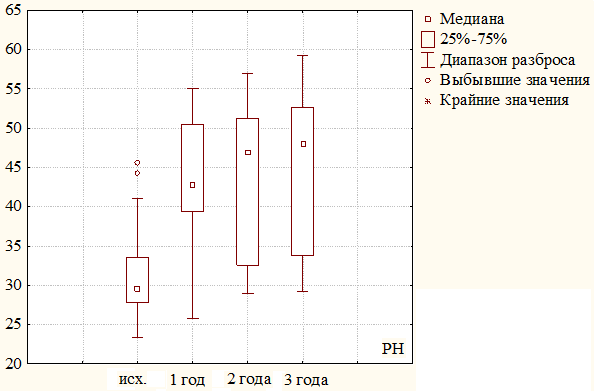
Рис. 1. Динамика изменения физического компонента здоровья (РН) за 3 года наблюдения у пациентов первой группы.
Исходно, у пациентов этой группы среднее значение физического компонента равнялось 31,23±6,24 балла. Через 1 год наблюдения показатель значительно увеличился и составил в среднем 43,31±8,39 (31,23 баллов против 43,31 баллов, критерий χ2, р=0,000). За второй и третий годы наблюдения он стабилизировался на отметке 44,50±9,41 и 44,74±9,56 баллов соответственно (43,31 баллов против 44,50 баллов и 44,50 баллов против 44,74 баллов, критерий χ2, р≤0,005). Различия между исходными значениями и последующими показателями в сроки до трех лет оказались статистически значимы (р≤0,005).
Психологический компонент здоровья. При включении в клиническое исследование (КИ) в первой группе он составлял в среднем 35,87±4,31 балла, за первый год наблюдения он значительно увеличился до 51,83±4,90 (35,87 баллов против 51,83 баллов, критерий χ2, р=0,000), а за 2 и 3 годы стабилизировался и достиг отметки 52,30±6,47 и 53,07±5,94 соответственно (51,83 баллов против 52,30 баллов и 52,30 баллов против 53,07 баллов, критерий χ2, р≤0,005). Различия между исходными значениями и последующими показателями в сроки до трех лет оказались статистически значимы (р≤0,005). Результаты изменения психологического компонента здоровья представлены на рис. 2.
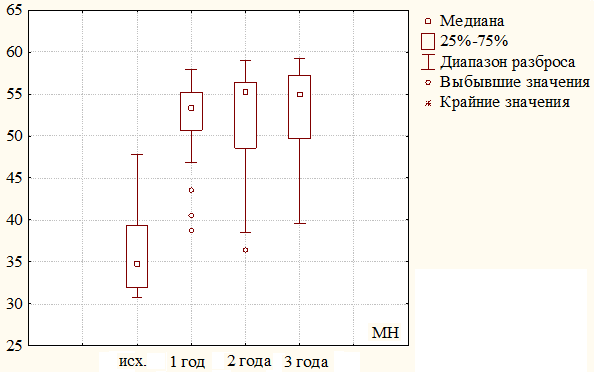
Рис. 2. Динамика изменения психологического компонента здоровья (МН) за 3 года наблюдения у пациентов первой группы.
Одним из основных компонентов качества жизни у больных с хронической ишемией нижних конечностей является дистанция безболевой ходьбы. Исходно ее среднее значение в первой группе составило 131±65 метров (м), через 1 год отмечается значительное увеличение показателей дистанции безболевой ходьбы (ДБХ) до 676±542м (131 м против 676 м, критерий χ2, р=0,000), и в течение последующих лет наблюдения показатель стабилизировался и составил через 2 года 704±475м, через 3 года 654±415м (см. рис. 3).
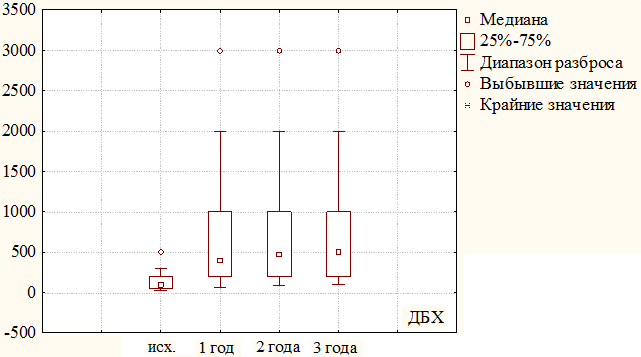
Рис. 3. Динамика изменения дистанции безболевой ходьбы за 3 года наблюдения у пациентов первой группы.
Различия между исходными и последующими значениями в сроки до трех лет оказались статистически значимы (676 м против 704 м, критерий χ2, р≤0,005). Сохранность конечностей на протяжении всего срока наблюдения в данной группе составила 100%.
У пациентов второй группы с III степенью ХИНК, мы так же отметили значительное увеличение всех показателей оценки качества жизни, по сравнению с исходными данными. Среднее значение физического компонента здоровья при включении в КИ составило 23,49±2,51 балла. В течение первого года показатель возрос до 37,67±5,93 (23,49 баллов против 37,67 баллов, критерий χ2, р=0,000) и в дальнейшем отмечено его постепенное увеличение до 40,11±7,40 к концу второго года (37,67 баллов против 40,11 баллов, критерий χ2, р≤0,005), и незначительное снижение за третий год до 39,63±7,68 балла. Различия между исходными значениями и последующими показателями в сроки до трех лет оказались статистически значимы (р≤0,005). Динамика физического компонента здоровья во второй группе представлена на рис. 4.
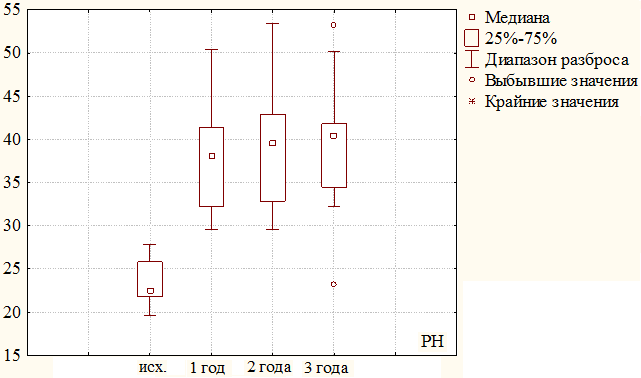
Рис. 4. Динамика изменения физического компонента здоровья (РН) за 3 года наблюдения у пациентов второй группы.
Изменения психологического компонента были более значимы. При включении в КИ средний показатель составлял 28,91±5,13 балла, за первый год наблюдения увеличился до 45,97±8,54 (28,91 баллов против 45,97 баллов, критерий χ2, р=0,000). За 2 год он продолжил свой рост и достиг отметки 50,98±7,60 балла (45,97 баллов против 50,98 баллов, критерий χ2, р≤0,005). За третий год наблюдения произошло незначительное снижения показателей психологического компонента здоровья, что составило 50,74±6,61 балла. Различия между исходными значениями и последующими показателями в сроки до трех лет оказались статистически значимы (р≤0,005). Результаты представлены на рисунке 5.
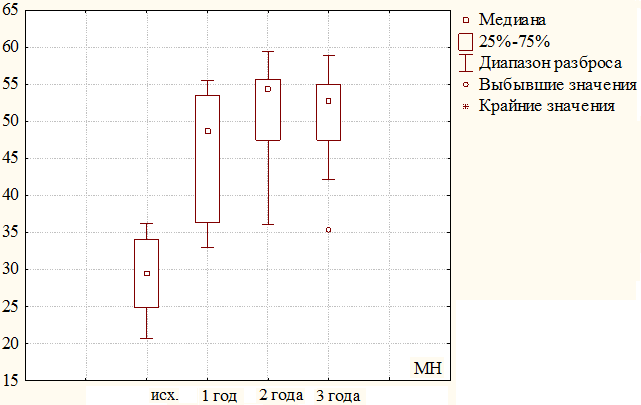
Рис. 5. Динамика изменения психологического компонента здоровья (МН) за 3 года наблюдения у пациентов второй группы.
При оценке показателей дистанции безболевой ходьбы, исходно среднее значение у пациентов 2-й группы равнялось 31,5±25м, через 1 год значительно увеличилось и достигло отметки 200±107м (31,5 м против 200 м, критерий χ2, р=0,000). Через 2 года наблюдался менее интенсивный положительный рост и к концу второго гола наблюдения составил 274±72м (200 м против 274 м, критерий χ2, р≤0,005), за 3 год стабилизировался на 271±63м (рисунок 6). Различия между исходными значениями и последующими показателями в сроки до трех лет оказались статистически значимы (р≤0,005). Сохранность конечностей за весь период наблюдения составила 78%. В трех наблюдениях в течение первого года и в одном в течение второго года выполнены ампутации нижних конечностей на уровне бедра по поводу прогрессирования хронической ишемии.
После проведения лечения больных с ХИНК генным препаратом отмечалась положительная динамика локальных проявлений заболевания. У пациентов, дистанция безболевой ходьбы которых превысила 500 м (40% наблюдений), такие проявления заболевания, как похолодание стопы и голени, онемение мышц голени, бледность кожных покровов были полностью купированы. У 35,5% остались минимальные жалобы: онемение икроножных мышц при повышенной нагрузке (например, быстром шаге или легком беге). В 28,8% случаев отмечены сохранение таких жалоб, как зябкость стопы, сухость кожных покровов. Положительная динамика по локальному статусу наиболее выражена была в течение первого года наблюдения и, в последующем, положительные результаты сохранились на протяжении всех трех лет.
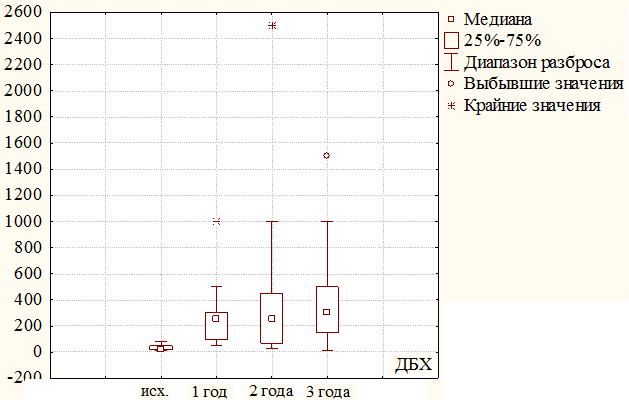
Рис. 6. Динамика изменения дистанции безболевой ходьбы у пациентов 2 группы за 3 года наблюдения.
Распределение пациентов в зависимости от исходной степени ишемии выглядело следующим образом (рисунок 7). При включении в исследование у 27 пациентов (60%) была II степень хронической ишемии и у 18 человек (40%) - III степень ХИНК. За 3 года наблюдения у 9 пациентов (20%) степень ХИНК уменьшилась до субклинической стадии (I ст.). Количество больных со II степенью составило 28 человек (62%); наблюдений с III степенью ХИНК - одно (2%). В четырех наблюдениях за трехлетний период выполнены ампутации бедра (9%) - все больные с исходной III степенью ХИНК. Трое пациентов умерло от сопутствующей патологии (двое от острого инфаркта миокарда и один от острого нарушения мозгового кровообращения), что составило 7%.
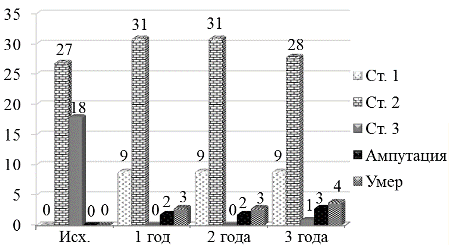
Рис. 7. Распределение пациентов в зависимости от степени хронической ишемии и сроков наблюдения.
Выводы. Использование стимулятора ангиогенеза на основе гена, кодирующего VEGF-165, в комплексной терапии пациентов с хронической ишемии нижних конечностей является безопасным и эффективным.
У 82% пациентов отмечено улучшение качества жизни как физического, так и, в большей степени, психологического компонента; отмечено значительное увеличение дистанции безболевой ходьбы, а также снижение либо отсутствие клинических проявлений ХИНК, значительно усугубляющих течение повседневной жизни пациентов. Повысилась их повседневная активность, количество выполненных дел перестало ограничиваться болями и другими жалобами, свойственными для хронической ишемии.
У всех пациентов в сроки до трех лет наблюдения отмечена хорошая переносимость препарата и отсутствие побочных действий; зафиксирована стабилизация полученных результатов.
В настоящее время, генные препараты не являются альтернативой реконструктивной хирургии при проходимом дистальном артериальном русле. Но, при невозможности выполнения хирургического лечения из-за дистальных окклюзий, будут способствовать повышению качества жизни, снижению количества ампутаций у пациентов с хронической ишемией нижних конечностей II и III степени.
