Введение. Врожденные ложные суставы костей голени (ВЛСКГ) относят к наиболее тяжелым формам ортопедической патологии, лечение которой ставит перед ортопедами сложную задачу, а решение ее растягивается, во многих случаях, на долгие годы. По мнению некоторых авторов трудности в лечении этого заболевания происходят из-за двух факторов: биологического - снижение репаративных способностей в диспластичном сегменте кости и механического - техническая сложность устранить деформацию не повреждая дистальной ростковой зоны [37]. Первый пункт, вероятно, более важен, так как проведенные клинико - рентгенологические, гистологические, ангиографические, реовазографические, неврологические исследования зоны псевдоартроза выявили различные дистрофические, некробиотические изменения в зоне ложного сустава, патологию сосудов, диспластические изменения в мышцах, нервах и сосудах этой области [2, 46]. Гистологические исследования зоны псевдоартроза выявили дистрофические и некробиотические изменения. Так, в работе F.Hefti с соавт. (2000), гистологические исследования у 192 пациентов выявили неспецифические изменения в зоне ложного сустава в 45,3% случаев, в 15,6% ультраструктура напоминала фиброзную дисплазию, а в 39% гистологически был подтвержден нейрофиброматоз [20]. Многочисленные исследования показали, что наиболее частой причиной возникновения ВСЛКГ являются: порок развития определенного участка кости; нейрофиброматоз I; кистозные образования кости. Наиболее резко выраженные дистрофические и некробиотические нарушения микроструктуры отломков, надкостницы, костного мозга и межотломковой фиброзно-хрящевой прослойки имеются у больных ВЛСКГ, развившемся на почве нейрофиброматоза I типа. Данный тип ложного сустава развивается на фоне редукции сосудистого русла и сопровождается более резким угнетением костеобразовательного процесса, по сравнению с другими типами псевдоартрозов. Морфологические исследования костной ткани отломков при нейрофиброматозе с использованием количественных критериев вскрывают дизонтогенетическую природу этой патологии, что проявляется в неспособности функционально неполноценных клеток формировать зрелую пластинчатую костную ткань [3,7].
Предложено множество классификаций ВЛСКГ, которые базируются, в основном, на рентгенологической картине [9,10,22]. С этиопатогенетической точки зрения интересна классификация, предложенная В.Л. Андриановым и А.П. Поздеевым, 1983, но и она не может служить руководством для предоперационного планирования, так как основана на анализе гистологического материала, взятого интраоперационно [1,4,6].
Тем не менее, учитывая нередкое рецидивирование ВЛСКГ, данные, полученные во время первого оперативного вмешательства, могут быть полезными на следующих этапах лечения.
Существует более 200 различных оперативных методик лечения врожденного псевдоартроза голени. Основные принципы изложены во многих работах и заключаются в резекции псевдоартроза, устранении угловой деформации, костной аутопластике, жесткой фиксации [15, 29, 31, 43, 47]. Но ни один подход к лечению, по мнению некоторых авторов, не показал идеального результата [30, 48]. Многие авторы предлагают дополнять оперативное лечение консервативными методиками, направленными на стимуляцию регенеративных способностей кости [21,34]. Используются различные способы фиксации (интрамедуллярный, накостный, чрескостный остеосинтез), а также различные их комбинации с различными хирургическими манипуляциями в зоне дефекта [11,17,23,40,41,44]. В подавляющем большинстве случаев выбор оперативной методики зависит скорее от возможностей и подготовленности ортопеда, чем от клинико-рентгенологической или морфологической ситуации [36].
Именно структурные изменения в зоне ложного сустава, которые имеют выявленные нами рентгеноморфологические параллели, во многом определяют сложность в лечении данных больных, что требует постоянных поисков более эффективных методик, а исследования последних лет дают надежду на то, что эти поиски будут успешными [4]. Большие надежды в лечении данной патологии большинство авторов сегодня связывают с методом Илизарова [12,13,33].
Материал и методы. Методом несвободной костной пластики по Г.А. Илизарову пролечено 30 больных ВЛСКГ. Возраст пациентов на момент начала лечения колебался от 1,5 до 21 года. Среди пациентов было 14 лиц женского пола и 16 -мужского. Впервые в центре прооперированы только 5 больных (17%), 76% (23 человека) имели от одного до 8 оперативных вмешательств до поступления в РНЦ «ВТО», 7% (2 пациента) имели более 8 оперативных вмешательств (рис. 1).
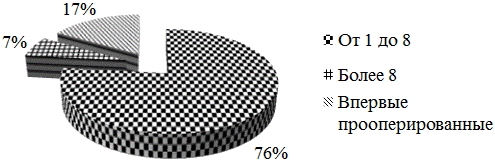
Рис. 1. Распределение больных по количеству перенесенных ранее оперативных вмешательств.
У двух пациенток ВЛС находился в латентной фазе. У двух больных несращение локализовалось на двух уровнях. У одного пациента ВЛСКГ имел место на обеих голенях. Все анатомо–функциональные нарушения представлены в табл. 1.
Таблица 1. Анатомо–функциональные нарушения пораженного сегмента

Из табл. 1 следует, что у всех больных имело место нарушение опороспособности конечности и угловые деформации.
Результаты и их обсуждение. Все пациенты оперированы методиками несвободной костной пластики по Г.А. Илизарову. Первостепенными задачами лечения были: восстановление опороспособности конечности, целостности берцовых костей с увеличением костной массы в зоне псевдоартроза. С целью профилактики рецидива большое внимание уделяли устранению деформаций берцовых костей, восстановлению дистального межберцового сочленения и функции голеностопного сустава, устранению порочных установок стопы. С целью восстановления целостности сегмента выполняли открытую адаптацию отломков, их расщепление и взаимное погружение концевых отделов. Атрофичные концы отломков дублировали, для усиления механической прочности сращения перекрывали зону стыка полнослойным фрагментом, отщепом, в том числе парной кости, использовали композиционные материалы. У двух больных в межотломковое пространство был внедрен костнопластический материал (Calciresorb Collagen). Наилучших результатов лечения удалось достигнуть при армировании большеберцовой кости спицами с гидроксиапатитным покрытием, которое применено у четырех больных. Продолжительность чрескостного остеосинтеза зависела от рентгеноанатомических особенностей отломков и их концевых отделов, величины деформации, укорочения, состояния мягких тканей, применяемых технологий остеосинтеза, поставленных лечебных задач. После достижения консолидации, остаточная деформация наблюдалась у 6 больных, укорочение – у 9 пациентов. Остаточное укорочение корректировалось ортопедической обувью. Средняя продолжительность фиксации у всех больных составила 183,3 дня. Средняя величина удлинения в данной группе – 6,7 см.
Случай 1. Больной Р., на момент начала лечения в РНЦ «ВТО» - 16 лет. Диагноз: Врожденый ложный сустав костей левой голени на фоне фиброзной дисплазии. Антекурвационная деформация 165°. Укорочение левой нижней конечности 2,0 см. В 11 лет получил патологический перелом костей левой голени в нижней трети. Обратился в травмпункт по месту жительства, голень фиксирована гипсовой лонгетой. Достигнута консолидация. Через 3 года вновь произошел патологический перелом. На рентгенограммах обнаружено объемное образование большеберцовой кости. Прошел обследование в онкологическом диспансере. Злокачественность процесса не подтверждена. В хирургическом отделении выполнена краевая резекция. Через два месяца консолидации не произошло, на рентгенограммах выявлен псевдоартроз левой большеберцовой кости. Выполнен чрескостный остеосинтез левой голени аппаратом Илизарова. Фиксация 7 месяцев. Через 2 месяца после снятия констатировано несращение. Обратился в РНЦ «ВТО». На рентгенограммах при поступлении определяется псевдоартроз нижних трети костей левой голени. Форма концов отломков гипотрофическая. Костномозговой канал большеберцовой кости в зоне псевдоартроза эбурнеирован на протяжении 5 см.
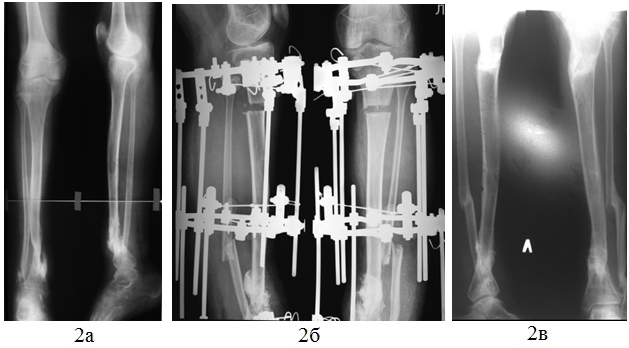
Рис. 2. Рентгенограммы голени больного Р., 16 лет в прямой и боковой проекциях, до лечения (а), в процессе лечения (б), после окончания (в).
С целью уточнения структуры и объема патологического участка кости пациенту до операции выполнена мультисрезовая компьютерная томография (МСКТ) левой голени. По данным МСКТ выявлены зоны резорбции, фрагментация и дефекты корковой пластинки, снижение плотности фрагментов большеберцовой кости в зоне ложного сустава, остеопороз и груботрабекулярная структура дистального метаэпифиза. Исследование с применением специальных фильтров позволяет определить с большой точностью границу патологического изменения структуры кости, учитывая строение корковой пластинки и архитектонику кости в области костно-мозгового канала и метафиза (рис. 3).
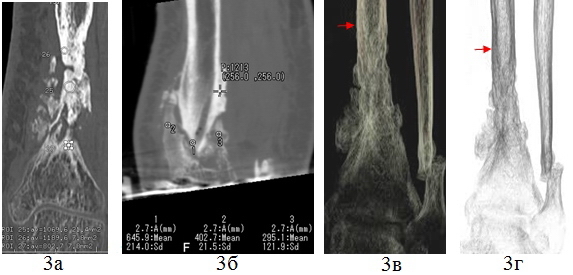
Рис. 3. МСКТ голеней больного Р., 16 лет до лечения. MPR во фронтальной и сагиттальной плоскостях зоны ложного сустава (а,б), 3D-реконструкция в костном режиме и с обработкой на фильтре Hardware Enhanced зоны ложного сустава (в, г).
Выполнено оперативное вмешательство: остеосинтез левой голени аппаратом Илизарова, открытая адаптация концов отломков большеберцовой кости, пластика материалом «Calciresorb/Collagen», остеотомия большеберцовой кости в верхней трети, малоберцовой - в средней трети. На 6 сутки начата дистракция в верхней трети темпом 0,25 по 4 раза в сутки. Длительность дистракции составила 20 дней. Срок фиксации 251 день. В результате лечения достигнута консолидация ложного сустава, уравнена длина нижних конечностей, исправлена деформация левой голени.
По данным МСКТ после окончания лечения отмечено сращение в зоне ложного сустава, корковая пластинка по медиальной поверхности полностью сформирована, по латеральной - на большем протяжении. В зоне дистракционного регенерата процесс перестройки не завершен, формируется корковая пластинка (рис 4).
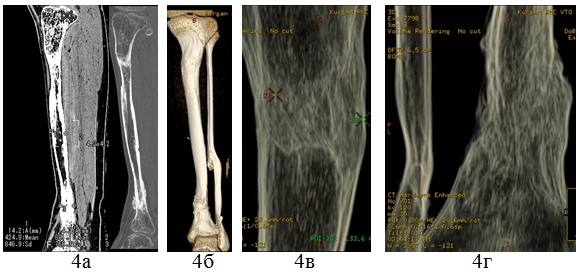
Рис. 4. МСКТ голеней больного Р., 16 лет через 7 месяцев после снятия аппарата: MPR в сагиттальной плоскости (а), 3D-реконструкция в костном режиме (б), 3D-реконструкция и с обработкой на фильтре Hardware Enhanced зоны дистракционного регенерата (в) и ложного сустава (г).
Случай 2. Пациентка Ш., на момент первого поступления в центр – 6 лет. Диагноз: врожденный ложный сустав нижней трети костей правой голени на фоне фиброзной дисплазии, латентная форма. Вальгусная деформации 170°. В 6 лет упала, появилась деформация в нижней трети правой голени, обратилась в РНЦ «ВТО». На рентгенограммах выявлена фиброзная дисплазия нижней трети правой большеберцовой кости, вальгусная деформация 170°. По данным МСКТ в области ложного сустава фрагментация и дефекты корковой пластинки на аксиальном срезе и при мультипланарной реконструкции (MPR). Костно-мозговой канал на протяжении 7 см имеет груботрабекулярное строение с обширными зонами, имеющими плотность не более 180HU (фиброзная ткань), корковая пластинка имеет прерывистые контуры (рис. 5).
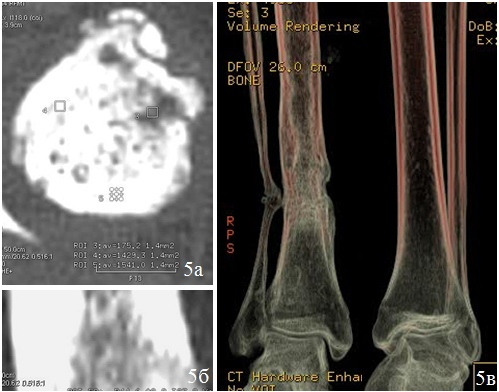
Рис. 5. МСКТ голеней больной Ш., до лечения: аксиальный срез (а), MPR во фронтальной плоскости на уровне ложного сустава (б); 3D-реконструкция голеней в костном режиме с обработкой на фильтре Hardware Еnhanced (в).
Учитывая полученные данные, оперативное лечение включало остеотомию нижней трети костей правой голени, остеотомию большеберцовой кости с формированием «отщепа», остеосинтез правой голени по Илизарову.
В послеоперационном периоде деформация дозировано исправлена. Через 4 месяца достигнута консолидация, аппарат демонтирован. Впоследствии трижды возникали рецидивы деформации, дважды имел место патологический перелом. Для лечения применялись методики чрескостного остеосинтеза, однократно выполнена костная пластика по Хахутову, в костномозговой канал имплантирована спица с напылением гидроксиапатита (рис.6). Впоследствии произошел перелом спицы, она была удалена.
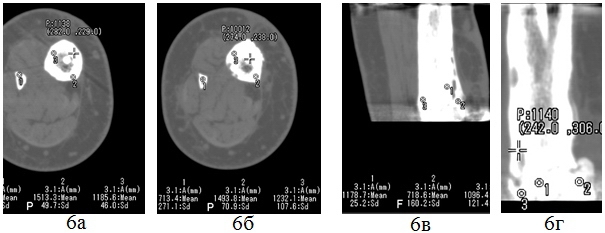
Рис. 6. МСКТ голеней больной Ш., в процессе лечения: аксиальные срезы (а,б), MPR во фронтальной плоскости на уровне ложного сустава (в, г).
В процессе лечения возникло инфекционное осложнение – спицевой остеомиелит нижней трети правой большеберцовой кости, который купирован консервативно. В настоящий момент ВЛС консолидирован. Сохраняется остаточная варусная деформация нижней трети правой голени 170°. Больная ходит без дополнительных средств опоры. Средний срок фиксации составил 134,8 дня. По данным МСКТ – формирование непрерывной корковой пластинки без органотипической перестройки кости в зоне бывшего ложного сустава, варусная деформация нижней трети голени (рис. 7).
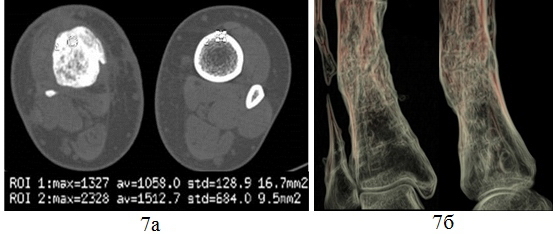
Рис. 7. МСКТ голеней больной Ш., после лечения: аксиальные срезы (а), 3D-реконструкция голеней в костном режиме с обработкой на фильтре Hardware Еnhanced, фронтальная и сагиттальная плоскости (б).
Обсуждение результатов. Анализ литературы и наших данных свидетельствует о том, что успешное лечение больных ВЛСКГ в настоящее время связано с использованием комплекса методических приемов, то есть надежной фиксацией, с возможностью устранения деформаций и применением различных методик и материалов для стимуляции костеобразования в зоне ложного сустава. Применение спиц с напылением гидроксиапатита, материала «Calciresorb/Collagen», пластики по Хахутову, формирование отщепа большеберцовой кости и фиксация аппаратом Илизарова позволили получить консолидацию ложного сустава в группе анализируемых нами больных. Следует отметить, что это удавалось сделать не всегда за один этап лечения. Метод Илизарова является на сегодняшний день основопологающим в лечении ВЛСКГ по мнению многих российских и зарубежных ортопедов [13,14,18,19,24,25,42]. Некоторые авторы, однако, считают, что аппарат Илизарова или Тейлора целесоообразно применять у детей старшего возраста [8,36]. В последние годы аппарат Илизарова используют чаще в сочетании с другими методами фиксации и стимуляции костеобразования. Так, в работе Thabet A.M., Paley D, 2008, указано, что комбинированное лечение (то есть , применение надкостницы, костная пластика , интрамедуллярные стержни и аппарат Илизарова) обеспечивают наилучшее сочетание биологических и механических свойств для лечения и предпочтительнее любого из этих методов в отдельности [37]. Перспективным авторы считают применение фармакологической коррекции, в том числе бисфосфонатов в системе комплексного лечения врожденных ложных суставов [33]. Приводятся также данные о применении рекомбинантного человеческого костноморфогенетического белка - 2 (rhBMP-2) при лечении больных с использованием аппарата Илизарова [16]. Тем не менее, в литературе достаточно много публикаций о применении других методик, в частности костной пластики с интрамедуллярной фиксацией [28,30,32,39,45].
Заключение. Наш опыт показывает, что дифференцированное применение методик несвободной костной пластики по Г.А. Илизарову, других способов стимуляции костеобразования с учетом анатомических и рентгено-морфологических особенностей строения ложного сустава , позволяет добиться хороших и удовлетворительных результатов лечения, кроме того, это дает возможность выполнять лечение, в большинстве случаев, одноэтапно.
