Актуальность. Уровень заболеваемости патологией мочеполовой системы остается сходным в течение последних пяти лет [1, 2]. Уротелиальный рак занимает 4 место по распространенности злокачественных опухолей после рака простаты (или молочных желез), легкого и колоректального рака [3–5]. Переходноклеточные карциномы верхних мочевых путей (ВМП) встречаются реже, чем мочевого пузыря, но в 60 % диагностируются уже на III стадии. К факторам риска относят курение табака и профессиональную деятельность (занятость в лакокрасочной, химической, нефтяной промышленности) [3]. Кроме того, мочеточники вторично вовлекаются в объемные процессы брюшной полости и особенно малого таза.
Экскреторная урография (ЭУ), являвшаяся ранее исследованием «первого ряда» у пациентов с патологией ВМП, в настоящее время все чаще вытесняется компьютерной урографией (КТУ) и, несколько реже, магнитно-резонансной урографией (МРУ). Наиболее вероятно это связано с большей диагностической ценностью последних и более высоким качеством получаемых изображений. Кроме того, методика ЭУ имеет ряд ограничений: важна подготовка кишки, адекватная почечная функция пациента, отсутствие тяжелых заболеваний печени и щитовидной железы.
На сегодняшний день КТУ является «золотым стандартом» в диагностике причин урообструкции, в том числе на мочеточниковом уровне. Это исследование позволяет быстро и всесторонне оценить состояние мочевых путей [6, 7].
У ряда обследуемых использование ионизирующего излучения затруднительно: это пациенты, нуждающиеся в многократных динамических исследованиях (особенно молодого возраста), беременные, пациенты со сниженной почечной функцией и лица с аллергическими реакциями на контрастное вещество. В этих ситуациях методикой выбора может стать магнитно-резонансная урография (МРУ), позволяющая установить факт урообструкции и заподозрить ее причину [8–10].
МР-исследование мочевых путей может быть выполнено 2 способами: в виде статической бесконтрастной урографии с использованием ультрабыстрых Т2-взвешенных последовательностей (Т2-ВИ) – таких как при магнитно-резонансной МР-холангиопанкреатографии, и с использованием Т1-ВИ после внутривенного введения контрастного вещества (по аналогии с рентгеновской ЭУ). Методика бесконтрастной МРУ основана на получении высокоинтенсивного МР-сигнала от малоподвижной жидкости, находящейся в естественных и/или патологических структурах в зоне исследования, и позволяет визуализировать мочевые пути при их расширении, кисты различной локализации, позвоночный канал.
Цель исследования – оценка чувствительности КТ и МРУ (нативного исследования и с контрастным усилением) для пациентов с объемными процессами мочеточников.
Материалы и методы. Под наблюдением находились 142 пациента, проходивших лечение по поводу заболеваний верхних мочевых путей (ВМП) в ГБУЗ г. Москвы «Городская клиническая больница им. С. И. Спасокукоцкого» ДМЗ г. Москвы, ГБУЗ г. Москвы «Городская клиническая больница им. С.С. Юдина» ДМЗ г. Москвы и Отраслевом клинико-диагностическом центре ПАО «Газпром» в период с 2013 по 2017 гг. Структура патологии представлена в табл. 1.
Таблица 1. Распределение обследованных пациентов по нозологии (n = 142)
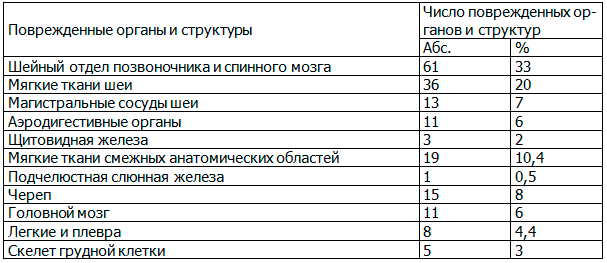
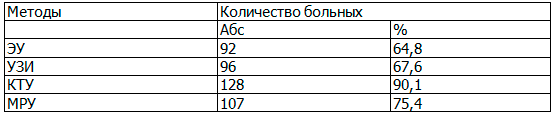
Всем больным проведено комплексное лучевое обследование: ЭУ первично выполнена в 64,8 % (n = 92), УЗИ – в 67,6 % (n = 96). Далее всем пациентам выполнялась КТУ и/или МРУ (табл. 2).
Таблица 2. Лучевые исследования, проведенные пациентам
Пациенты с первичными опухолями мочеточников (n = 12; 8,22 %), а также с вторичным вовлечением органа в объемные процессы малого таза (n = 32; 21,9 %) и больные с метастатическим поражением лимфатических узлов (n = 2; 1,37 %) были выделены в отдельную подгруппу (n = 46; 31,5 %).
КТУ на 160-срезовом сканере Aquilion Prime (Toshiba, Япония) проведена в 90,1 % (n = 128), в том числе 42 (91,3 %) пациентам из подгруппы с объемными образованиями. Перед исследованием осуществлялся сбор аллергоанамнеза, информации о выполненных ранее исследованиях с применением КВ, о наличии/отсутствии анафилактоидых реакций, пациент давал согласие на проведение исследования. Для получения внутривенного болюсного усиления использовались только неионные контрастные препараты (концентрация йода 200-350 мг/мл). При проведении исследования использовался двухголовочный инъектор, с помощью которого в локтевую вену вводилось 90-120 мл контрастного препарата (1,5 мл на 1 кг массы пациента) со скоростью 4 мл/с, после окончания введения контрастного средства автоматически болюсно вводилось 50 мл физиологического раствора, с той же скоростью. За 30 мин до исследования пациенты принимали 200–400 мл негазированной питьевой воды, что улучшало визуализацию брюшной полости и предотвращало наложение контрастированных петель тонкой кишки.
МРУ на высокопольных аппаратах с напряженностью магнитного поля 1,5 Тл Vantage Atlas (Toshiba, Япония) и 3,0 Тл Ingenia (Philips, Нидерланды) выполнена 107 (75,4 %) пациентам, в том числе 100 % из подгруппы с объемными образованиями; в 35 (32,7 %) случаях это была экскреторная МРУ (с внутривенным введением гадолиний содержащего контрастного вещества – 0,1 ммоль/кг массы тела), у 11 (10,3 %) больных ограничились статическим нативным исследованием. Разработанный оптимизированный протокол представлен в табл. 3. Использовались импульсные последовательности с подавлением сигнала от жировой ткани – T2 Fat Sat ax 4 мм, T1 FLASH Fat Sat 3D Cor 2 мм, быстрые импульсные последовательности HASTE – Cor 3 мм, единичные толстые косые срезы 60 мм (слева и справа) на задержке дыхания. Для комплексной оценки органов малого таза и поиска осложнений вмешательств на ВМП всем пациентам обязательно выполняли диффузионно-взвешенные изображения (ДВИ) (с построением карт ИКД). В случае экскреторной урографии проводили введение контрастного вещества.
Таблица 3. Оптимизированный протокол МР-исследования

Для заполнения полых мочевых органов и таким образом лучшей их визуализации за 1–1,5 ч до исследования пациентам рекомендовали выпить 500 мл негазированной воды. Всем обследуемым за 15 минут до исследования выполнялась диуретическая нагрузка в виде фуросемида 10 мг внутривенно; за 30 минут до исследования для уменьшения числа двигательных артефактов применялся дротаверин 120 мг per os. Поверхностная брюшная катушка закреплялась при помощи ремней. К проведению МРТ не допускались пациенты с электрическими или магнитными имплантатами, в случае экскреторной МРУ – при значении СКФ < 30 мл/мин/1,73 м2.
В качестве референсного метода рассматривались результаты компьютерной урографии (КТУ), подтвержденные при оперативном вмешательстве.
Результаты и их обсуждение. Распределение локализации патологических изменений мочеточников у пациентов с объемными образованиями показано в табл. 4. Анализ представленных данных демонстрирует, что наиболее часто поражалась нижняя треть мочеточника (включая интрамуральный отдел) – в 74,1 % (n = 34). Реже встречалось вовлечение верхней трети органа и ЛМП – в 17,24 % (n = 8 чел) и средней трети – 8,66 % (n = 4).
Таблица 4. Распределение локализации патологических изменений мочеточников у пациентов с объемными процессами (n = 46)

Локализация патологических изменений подтверждена цистоскопией и операцией, в 78,3 % (n = 36) на мочеточниках выполнено реконструктивно-пластическое вмешательство по Боари либо уретеро-уретероанастомоз с помощью робота da Vinci (Intuitive Surgical, США). В 10 (21,7 %) случаях выполнена нефростомия (рис. 1).
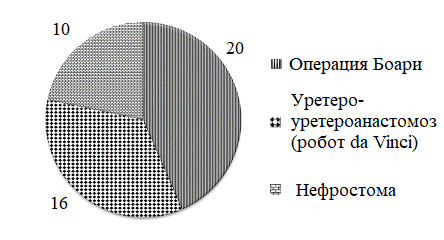
Рис. 1. Виды оперативного вмешательства у исследуемой группы.
По данным лучевых методов определялись обструкция органа на определенном уровне (n = 46; 100 %;), дефект наполнения (n = 8; 17,4 %), супрастенотическое расширение (n = 33; 71,7 %), гидронефроз (n = 35; 76,1 %), расширение почечной лоханки (n = 29; 63,0 %). Протяженность дефекта наполнения или изменений стенки мочеточника и/или окружающей клетчатки варьировала от 2 мм до 7 мм. Реакция паранефральной, парауретеральной клетчатки отмечалась у 58,7 % (n = 27), скопления жидкости в малом тазу у 52,1 % (n = 24). Дополнительно отмечались нарушение выделительной функции почки у 26,1 % (n = 12) больных, развитие лоханочно-почечных рефлюксов у 4,35 % (n = 2).
Уровень обструкции мочеточника был верно определен во всех исследованиях как при КТУ, так и при МРУ. Высокая тканевая контрастность МРТ позволяла выявить ретенцию ВМП в 100 % случаев и установить диагноз без использования контрастного усиления в большем числе наблюдений по сравнению с МСКТ (МРТ позволила ограничиться нативным исследованием у 23,9 % (n = 11) пациентов, МСКТ – у 8,7 % (n = 4). Расширенные мочевые пути характеризовались гиперинтенсивным МР-сигналом на Т2-ВИ при статической МРУ, благодаря высокому МР-сигналу от мочи (рис. 2, а, б); почки, мочеточники и мочевой пузырь визуализировались одновременно. Т2-ВИ толстыми срезами позволяли получить изображения в любой плоскости и реконструировать из них изображения MIP. Отсутствие ретенции мочевых путей снижало эффективность нативной МРУ, из-за недостаточного количества гиперинтенсивной жидкости.
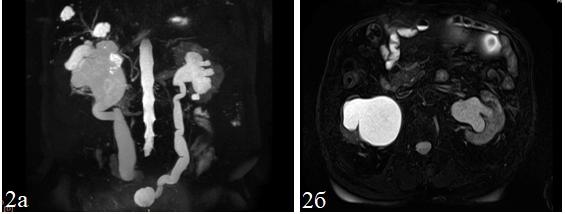
Рис. 2. МР-томограммы БП пацциента П., 56 лет. 3D MRCP в корональной проекции (а) и Т2-ВИ с подавлением сигнала от жировой ткани в аксиальной проекции (б). Отмечается двусторонняя уретеропиелокаликоэктазия (больше справа, расширение мочеточника достигает 31 мм), истончение паренхимы правой почки. На изученном уровне также визуализируются кисты печени и киста правой почки.
Объемные образования мочеточников визуализировались как дефекты наполнения – в 5 (10,9 %) случаях при МРУ и 7 (8,7 %) – при КТУ, из них в 4 (8,7 %) случаях дополнительно определялся симптом «кубка» (расширения мочеточника дистальнее дефекта наполнения) (рис. 3, а, б). Непосредственно первичный мягкотканный компонент отмечался в 5 случаях, как при КТУ, так и при МРУ (рис. 4, а, б).
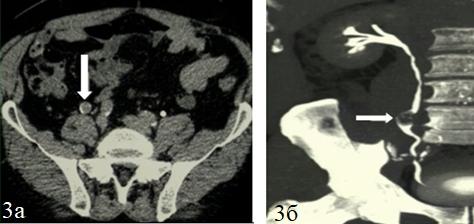
Рис. 3. КТУ, аксиальная плоскость (а) и реконструкция в корональной плоскости (б). На границе верхней и средней третей правого мочеточника наблюдается мягкотканный компонент (а, стрелка), на корональной реконструкции визуализируется симптом «кубка» (б, стрелка).
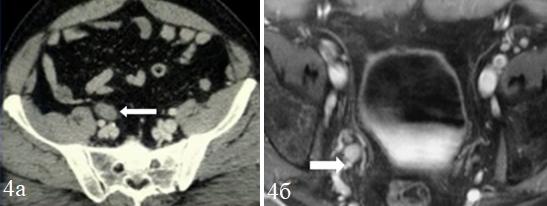
Рис. 4. Мягкотканное образование правого мочеточника: а – КТ-томограмма в аксиальной плоскости, в средней трети органа определяется объемное образование (стрелка), без признаков воспалительных изменений забрюшинной клетчатки; б – постконтрастная МР-томограмма в корональной плоскости, наблюдается мягкотканный компонент, накапливающий контрастное вещество (стрелки).
В 2 (4,34 %) случаях экскреторная МРУ обнаружила мягкотканный компонент имеющейся опухоли, который не визуализировался при нативных сериях/уточнила его границы (рис. 5, а – в).
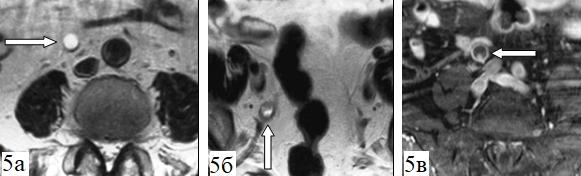
Рис. 5. МР-томограмма БП в аксиальной плоскости, Т2-ВИ: а – определяется расширение правого мочеточника на уровне нижней трети (а), создается впечатление об утолщении его стенки (б, стрелка); в – постконтрастные Т1-ВИ с подавлением сигнала от жировой ткани: на фоне накапливающей контрастный препарат стенки органа в просвете визуализируется небольшой мягкотканный компонент (в, стрелка).
Сравнительный анализ возможностей методов лучевой диагностики при определении признаков переходно-клеточных опухолей мочеточников представлен в табл. 5. Поскольку УЗИ не позволяло выявлять специфические признаки, его результаты не учитывались. Низкая чувствительность ЭУ на этапе первичной диагностики связывалась с трудностью получения адекватного контрастирования мочеточников и, соответственно, затруднением визуализации мелких (менее 15 мм) очагов.
ЭУ также не позволяла отдифференцировать сгусток крови от уротелиальной опухоли и не отображала утолщение стенок органа, что объясняет невысокую специфичность (82 %).
Таблица 5. Эффективность методов лучевой диагностики при определении признаков уротелиальных образований мочеточников, %
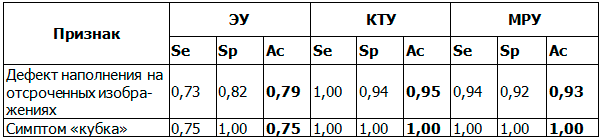
Примечание: ЭУ – экскреторная урография, КТУ – компьютерная урография, МРУ – магнитно-резонансная урография.
Прорастание мочеточника опухолью малого таза было отмечено у 32 больных при МРУ, у 29 при КТУ. Стандартные последовательности (включая DWI и построение ADC-карт) позволяли визуализировать объемные образования, последующая МРУ – точнее оценить их границы и распространение, что важно при выборе хирургической тактики (рис. 6, а – г).
МРТ также давало дополнительную информацию в виде оценки состояния окружающей клетчатки (инфильтрация выявлена в 27 (58,7 %) случаях, наиболее чувствительной последовательностью являлись серии с жироподавлением. На них периуретерально отмечалось повышение МР-сигнала.
МРУ позволяла выявить изменения паренхиматозных органов, печени, надпочечников и заподозрить наличие вторичного поражения костей таза (обнаружено в 6 случаях). Выпот в малом тазу одинаково хорошо обнаруживался как на МРТ, так и на УЗИ (n = 12, 26,1 %), и что, вероятно, связано с яркостью лучевых проявлений свободных скоплений жидкости. Стандартные Т2-ВИ и последовательности с подавлением сигнала от жировой ткани позволяли увидеть жидкостные скопления и дифференцировать их, например, от кист и фолликулов яичников.
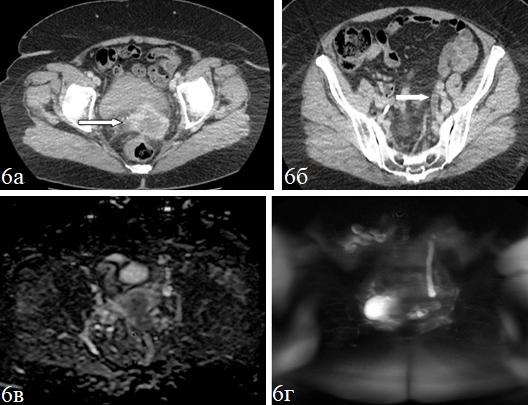
Рис. 6. КТ-томограммы в аксиальной плоскости: а – венозная фаза сканирования, в проекции шейки матки определяется мягкотканное образование гетерогенной структуры, с периферическим накоплением и с сохранением гиподенсивных слабо накапливающих зон в центральных отделах (стрелка); б – КТУ, на фоне законтрастированного правого мочеточника наблюдается отсутствие функции левой почки: спустя 180 мин контрастирования ВМП не получено, левый мочеточник в нижней трети расширен до 9 мм (стрелка); в – ADC-карта демонстрирует ограничение диффузии в области объемного образования шейки матки и левого мочеточника; г – бесконтрастная МРУ в корональной плоскости визуализирует левосторонний уретерогидронефроз и «обрыв» левого мочеточника на уровне объемного образования шейки матки.
Сравнительная эффективность методов лучевой диагностики в определении их вовлечения опухолевыми процессами малого таза представлена в таблице 6.
Чувствительность УЗИ в выявлении вовлечения мочеточников в опухолевый процесс малого таза оказалась невысокой (29 %), что может объясняться затруднением визуализации у больных с ожирением и при пневматозе кишки, а также сложностями анатомических взаимоотношений при наличии опухолевых процессов. КТУ продемонстрировала относительно высокую чувствительность (91 %), тем не менее ее возможности при визуализации органов малого таза были ниже, чем у МРТ.
Таблица 6. Эффективность методов лучевой диагностики при определении вовлечения мочеточников опухолевыми процессами малого таза (n = 32), в %
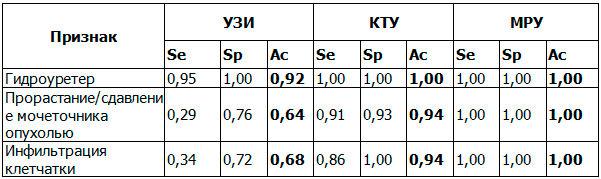
Примечание: КТУ – компьютерная урография, МРУ – магнитно-резонансная урография.
Высокая чувствительность МРУ в выявлении вовлечения мочеточников связана с ее более высокой тканевой контрастностью и возможностью получения полипозиционных изображений, что помогает в выявлении органа-источника опухолевого процесса и оценке его распространенности. Чувствительность МРУ также была максимальной в выявлении состояния периуретеральной клетчатки, ее вовлечение четко определялось на бесконтрастных сериях с подавлением сигнала от жировой ткани, обнаруживая отек и/или выпот в мезоректуме.
Заключение. При локализации патологических изменений в нижней трети мочеточника, особенно в дистальном его отделе/устье, наиболее ценную диагностическую информацию может предоставить МРУ – статическая и с последующим контрастным усилением. В данном случае МРУ позволит хорошо визуализировать структуры малого таза, оценить состояние лимфатических узлов. В случае нахождения изменений в верхней трети мочеточника или лоханочно-мочеточниковом переходе, получить адекватное изображение мочевых путей возможно как при КТУ, так и с помощью МРУ и УЗИ. При локализации «зоны интереса» в средней трети органа наиболее полный объем диагностической информации может предоставить КТУ.
МРУ позволяет получить дополнительную диагностическую информацию о состоянии стенки органа и инфильтрации окружающей клетчатки. Возможность комплексной оценки органов брюшной полости и малого таза позволяет исключить иную патологию и влияет на тактику ведения пациента.
Отсутствие ионизирующего излучения позволяет использовать МРУ у беременных женщин и детей, у пациентов со сниженной почечной функцией. Учитывая сходную с КТУ диагностическую эффективность, методика может применяться и для динамического контроля результатов лечения.
