Введение. В последние годы прослеживается тенденция к увеличению заболеваемости инфарктом миокарда (ИМ) среди женщин в молодом возрасте, причём ишемическая болезнь сердца (ИБС) у них отличается бессимптомным, агрессивным и быстрым течением [2,11,12].
Результаты исследований показывают более низкие показатели качества жизни у женщин с ИБС, преимущественно в старших возрастных группах по сравнению с мужчинами того же возраста, что во многом связано с наличием тяжелой сопутствующей патологии, психологической составляющей [1,14]. Однако, в литературе недостаточно отражены аспекты качества жизни у молодых пациенток с различными формами ИБС.
К настоящему времени накоплены многочисленные данные о значительном влиянии острого и хронического психосоциального стресса, в том числе, тревоги и депрессии на развитие и исходы ИМ, доказана связь психического статуса больных после острого ИМ с долговременным прогнозом. Вместе с тем, если для мужчин значимость психосоциальных факторов рассматривается как определенная, то в отношении женщин этого нельзя сказать однозначно в связи с малым числом исследований в женской популяции [7,8,11,13].
Оценка качества жизни и выраженности тревожно-депрессивных расстройств особенно у женщин, перенесших инфаркт миокарда в молодом возрасте и имеющих худший отдалённый прогноз, является необходимым критерием эффективного лечения и реабилитации в позднем постинфарктном периоде [3,5].
Цель исследования. Оценить качество жизни и выраженность тревожно-депрессивных расстройств у женщин перенесших инфаркт миокарда в молодом и среднем возрасте и выявить факторы риска, влияющие на их характеристики.
Методы. В аналитическое одномоментное поперечное исследование были включены 98 женщин, из них 1 группу (контрольную, n=53, средний возраст 31,5±12,4 лет) составили женщины моложе 55 лет без клинических признаков ИБС и симптомного атеросклероза и 2 группу (основную, n=45, средний возраст 54,2±5,4 лет) - женщины, перенесшие ИМ в возрасте до 55 лет, включённые в разные сроки позднего постинфарктного периода: менее года - до 15 лет. Me (Q25-Q75) - 2,5 (1; 6) лет. Исследование выполнялось на базе Государственного Бюджетного Учреждения здравоохранения Архангельской области (ГБУЗ АО) «Первая городская клиническая больница им. Е.Е. Волосевич» г. Архангельск, с привлечением женщин из Архангельска, Северодвинска и Новодвинска.
Критерии исключения: отказ от участия в исследовании, беременность, онкологические заболевания, злоупотребление алкоголем и наркотическими средствами.
Проведена оценка традиционных факторов риска, измерение окружность талии (ОТ), см, рассчитан индекс массы тела (ИМТ) по формуле Кетле, кг/м2, определены липиды, глюкоза, число компонентов метаболического синдрома (МС) согласно определению Международной Федерации Диабета (IDF) [15].
Была оценена фракция выброса левого желудочка (ФВЛЖ) по Teicholс по стандартной методике на эхокардиографическом аппарате GE Vivid I GE (Израиль, 2007). У женщин основной группы также учитывали особенности раннего постинфарктного периода, наличие повторного ИМ и острое нарушение мозгового кровообращения (ОНМК) в анамнезе, проведение реваскуляризации миокарда, выраженность хронической сердечной недостаточности (ХСН) по классификации NYHA на момент исследования.
Качество жизни оценивалось по опроснику SF-36. Результаты оценивали в баллах от 0 до 100 по восьми шкалам, составленным таким образом, что более высокая оценка указывала на более высокий уровень качества жизни. Шкалы сгруппированы в два показателя: 1-й - физический компонент здоровья (ФЗ), включающий физическое (PF) и ролевое (RP) функционирование, обусловленные физическим состоянием, интенсивность боли (BP) и общее состояние здоровья (GH); 2-й - психический компонент здоровья (ПЗ), представленный психическим здоровьем (MH), ролевым эмоциональным функционированием (RE), социальным функционированием (SF) и жизненной активностью (VT).
Для выявления у женщин тревоги и депрессии использовали госпитальную шкалу тревоги и депрессии (HADS), которая позволяет определить и разделить субклинический и клинический уровни тревоги и депрессии. Нормой считали показатель по шкале тревоги/депрессии 7 баллов и менее, при показателе 8-10 баллов определяли субклинический уровень тревоги/депрессии, при 11 баллах и выше - клинически выраженный уровень тревоги/депрессии.
Для математической обработки результатов исследования использовалась компьютерная программа SPSS for Windows (версия 17). Для проверки вариационных рядов на нормальность распределения применялся тест Шапиро-Уилка. Количественные данные представлены как среднее арифметическое (M) ± стандартное отклонение (SD) в случае нормального распределения и как медиана (Me) и квартили (Q25 - 75) при иных распределениях. При сравнении средних значений двух независимых групп, в случае нормального распределения, использован двусторонний t-критерий Стьюдента, при других - непараметрический критерий Манна-Уитни. При множественном сравнении был использован однофакторный дисперсионный анализ ANOVA с применением Post Hoc парных сравнений с поправкой Бонферрони при равной дисперсии для нормально распределенных данных. Дихотомические переменные сравнивались с использованием χ2. Статистическая достоверность присваивалась при значении p <0,05. Проводился корреляционный анализ с определением рангового коэффициента Спирмена (ρ sp.), однофакторный и множественный линейный регрессионный анализ для поиска предикторов и построения прогностических моделей.
Результаты и обсуждение. Основные клинические характеристики исследуемых женщин основной и контрольной групп представлены в табл. 1.
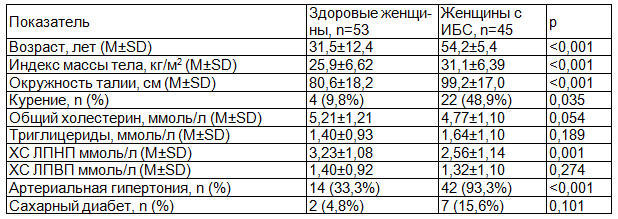
У женщин с ИБС достоверно чаще встречались такие факторы риска и их сочетание, как абдоминальное ожирение, артериальная гипертензия (АГ) и курение.
Таблица 1. Клиническая характеристика исследуемых женщин
Систолическая функция ЛЖ была снижена у женщин в постинфарктном периоде в сравнении со здоровыми женщинами, и составила 0,60±0,10 против 0,69±0,12, p=0,001.
Средний возраст развития первого ИМ у женщин составил 50,1±5,5 лет. ИМ с зубцом Q встретился у 22 (48,9%) пациенток, а не ИМ без зубца Q - у 23 (51,1%). Исходя из анамнеза, перенесенный ИМ распределился по классификации тяжести (T.Killip) следующим образом: в 23 (79,3%) случаях наблюдался ИМ I класса, в 3 (10,3%) случаях - II класса, с застоем в лёгких, в 1 (3,4%) случае - III класса, с отёком лёгких и в 2 (6,9%) случаях - IV класса, с кардиогенным шоком. У 6 (13,3%) женщин регистрировался повторный ИМ. Большей части женщин проводилась реваскуляризация миокарда: в 27 (61,4%) случаях стентовое чрескожное вмешательство и в 8 (18,2%) - аортокоронарное шунтирование (АКШ). В 6 (13,3%) случаях женщины, помимо ИМ, перенесли ОНМК.
На момент включения в исследование по классификации NYHA функциональный класс (ФК) ХСН соответствовал у 16 (35,6%) пациенток ФК I, у 28 (62,2%) - ФК II и у 1 (2,2%) - ФК III.
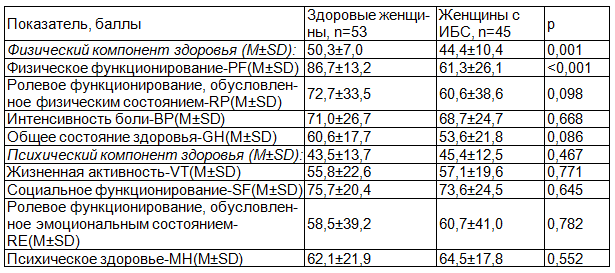
Проведено сравнение показателей качества жизни по опроснику SF-36 у женщин с ИБС и женщин контрольной группы (табл. 2).
Таблица 2. Показатели опросника SF-36 у здоровых женщин и женщин с ИБС
На всей группе женщин выявлено различие в количестве баллов физического компонента здоровья в зависимости от числа компонентов МС (F=6,310; p=0,001). Post Hoc анализ показал значимое межгрупповое различие между женщинами с 3-5 компонентами МС и женщинами с отсутствием признаков МС (42,42±9,97 баллов против 52,52±8,31 баллов; p=0,003), а также женщинами с 1-2 компонентами, когда ОТ >80 см (42,42±9,97 баллов против 50,75±6,27 баллов; p=0,003). Выявлен линейный тренд изменений физического компонента здоровья от тяжести проявлений МС (рис.1): F=9,501; p=0,003.
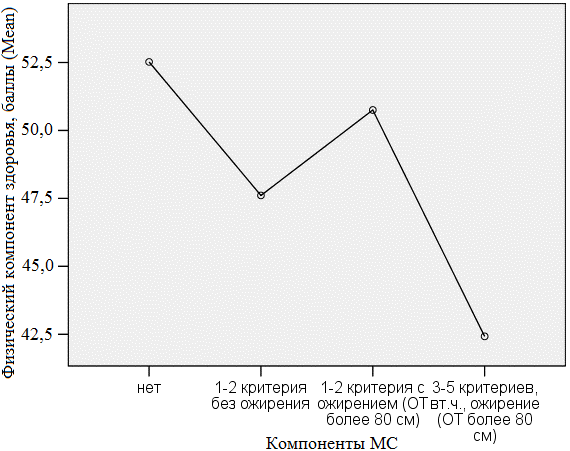
Рис. 1. Зависимость физического компонента здоровья от числа компонентов МС.
Сравнительный анализ обеих групп женщин по опроснику HADS не выявил достоверных различий по уровню тревоги и депрессии и в подавляющем большинстве случаев показал отсутствие у них тревожно-депрессивных расстройств.
В постинфарктном периоде женщины чаще находились в состоянии выраженной тревоги - 14 (32%), чем депрессии - 9 (20,4%). При этом депрессия у них преимущественно протекала в скрытой форме (рис. 2, 3).
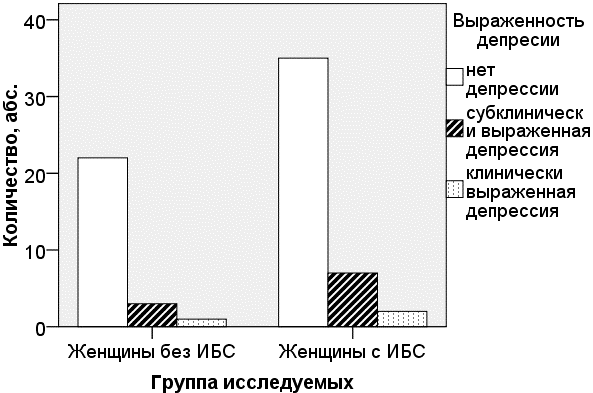
Рис. 2. Выраженность депрессии у женщин с ИБС и без ИБС (p=0,654).
Результаты клинико-эпидемиологических исследований КОМПАС и КООРДИНАТА по изучению депрессивных расстройств в общесоматической практике [4, 6] показали, что депрессия у пациентов после перенесенного ИМ развивается в 54% случаев, что выше, чем полученные нами данные на группе женщин до 55 лет. Тревожные расстройства, по данным разных авторов, среди больных ИБС выявляются почти у 20% пациентов, в нашем исследовании процент женщин с перенесенным ИМ и тревожными расстройствами был выше и составил 32%.
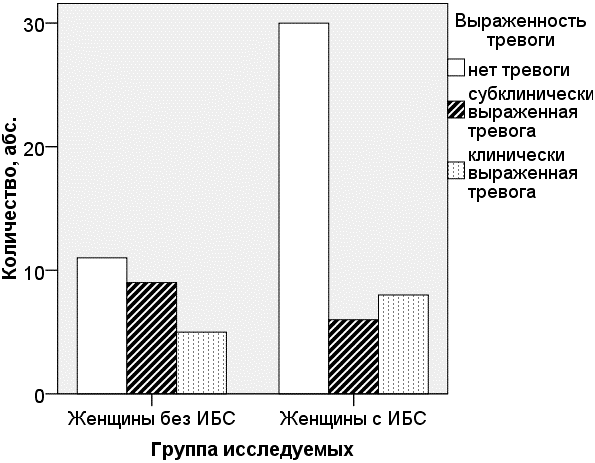
Рис. 3. Выраженность тревоги у женщин с ИБС и без ИБС (p=0,192).
На всей группе женщин определена зависимость депрессии (баллы, по шкале HADS) от физического компонента здоровья (баллы) и психического компонента здоровья (баллы) в виде регрессионной модели: F=19,864; p<0,001; R2=0,438; (для физического компонента β=-0,400; р=0,001; для психического компонента β=-0,381; р=0,002). Также выявлена однофакторная регрессионная зависимость депрессии (баллы, по шкале HADS) от окружности талии: F=4,251; p=0,042; R2=0,063; (для ОТ β=0,251; р=0,042).
Однофакторный регрессионный анализ показал, что на величину физического компонента здоровья оказывали влияние возраст (β=-0,423, p<0,001), OT (β=-0,323, p<0,001), число компонентов МС (β=-0,360, p<0,001), группа исследуемых (β=-0,320, p=0,001). Далее в ходе множественного линейного регрессионного анализа было изучено влияние данных предикторов после корректировки на потенциальные вмешивающиеся факторы. Статистически значимое влияние не сохранилось ни для одного из отобранных факторов на величину физического компонента здоровья при значимости самой модели (F=3,713, df4, p=0,008; R2 =0,163) при анализе всей группы женщин.
Предпринята попытка найти предикторы ухудшения физического компоненты здоровья для группы женщин в позднем постинфарктном периоде. Посредством корреляционного анализа у женщин с ИБС обнаружена обратная корреляционная связь между уровнем физического компонента здоровья и возрастом (ρ sp.=-0,334, p=0,025), а также ФК ХСН (ρ sp.=-0,509, p<0,001) и депрессией (ρ sp.=-0,368, p=0,014). Получена зависимость выраженности депрессии (в баллах) от ФК ХСН (β= 0,509, p<0,001).
Для основной группы женщин построена прогностическая модель зависимости физического компонента качества жизни пациенток, перенесших ИМ в молодом возрасте от возраста, ФК ХСН по NYHA, выраженности депрессии (табл.3).
Таблица 3. Прогностическая модель для оценки физического компонента здоровья у женщин с ИБС
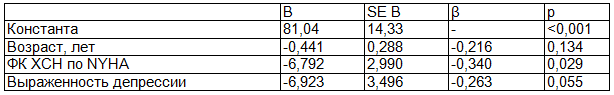
ФК ХСН явился фактором, оказывающим независимое влияние на снижение физического здоровья (p=0,029) при коррекции модели на возраст. F=7,452, p<0,001, R2=0,599, скорректированный R2=0,359.
Таким образом, развитие и прогрессирование ХСН у пациенток с постинфарктным кардиосклерозом, вне зависимости от возраста, оказывает негативное влияние на качество жизни и влечёт за собой развитие депрессивных расстройств.
Выводы. Качество жизни у женщин, перенесших инфаркт миокарда в возрасте до 55 лет, при сравнении со здоровыми женщинами, ухудшается за счет физического компонента здоровья. В постинфарктном периоде женщины чаще находились в состоянии выраженной тревоги - 14 (32%), чем депрессии - 9 (20,4%). ФК ХСН оказывает независимое влияние на снижение физического здоровья при коррекции модели на возраст.
