Инфекции мочевыводящих путей (ИМП) занимают лидирующее положение в этиологии всех нозокомиальных инфекций [1]. На долю ИМП приходится примерно 40% всех нозокомиальных инфекций в США, вызывая или способствуя развитию 7500 летальных исходов в год [2].
В настоящее время более 70% всех нозокомиальных ИМП приходится на долю грамотрицательных микроорганизмов, из которых доминирующим возбудителем является Escherichia coli [1, 3]. Из других наиболее частых возбудителей следует отметить Klebsiella pneumoniae, Pseudomonas aeruginosa, а также Acinetobacter spp. [1, 3 ,4].
Нозокомиальные ИМП, как правило, вызываются полирезистентными микроорганизмами, включая штаммы, продуцирующие бета-лактамазы расширенного спектра (БЛРС) [3]. Так, по данным российского исследования РЕЗОРТ, в отделениях реанимации и интенсивной терапии ведущим возбудителем нозокомиальных ИМП являлась P. aeruginosa (30,8%), а среди штаммов E. coli (25,8%) и K. pneumoniae (11,1%) частота продукции БЛРС составила 45% и 70,4%, соответственно [3, 4].
В связи с тем, что внутрибольничные уропатогены подвержены селективному давлению антибиотиков, а влияние этого фактора варьирует в различных регионах и отделениях стационаров [3, 5], возможны проблемы в выборе «стартового» антибиотика для лечения нозокомиальных ИМП. Основой для эмпирической терапии могут служить локальные данные о структуре возбудителей ИМП у данной категории пациентов и их чувствительности к антимикробным препаратам [5, 6].
Целью данного исследования явилось определение оптимальной антимикробной терапии внутрибольничных ИМП с учетом факторов риска, этиологической структуры и фармакодинамической активности антибиотиков.
Материалы и методы. В исследование были включены пациенты с нозокомиальными инфекциями мочевыводящих путей, находившиеся на стационарном лечении в урологическом отделении Смоленской областной клинической больницы (СОКБ).
Были обследованы пациенты с клинически и лабораторно подтвержденным инфекционным поражением мочевыводящих путей (МВП). С целью установления этиологически значимого микроорганизма всем пациентам проводили бактериологическое исследование клинического материала. От каждого исследованного пациента исследовалась средняя порция свободно выпущенной или полученной через катетер мочи. Моча собиралась в специальные стерильные контейнеры для разового использования (Медполимер, Россия) и доставлялась в лабораторию в течение 2 часов.
Посев клинического материала проводили на среды McConkey и Endo (BBL, США). При наличии клинических или лабораторных симптомов ИМП диагностически значимым считался титр бактерий 104 КОЕ/мл или более [3, 6]. Идентификацию микроорганизмов проводили с помощью биохимических тестов по общепринятым методикам. Определение чувствительности микроорганизмов к антибиотикам проводили диско-диффузионным методом согласно методическим указаниям МУК 4.2.1890-04) [7].
Ввод, статистическую обработку и анализ данных проводили с помощью компьютерной программы Microsoft Excel (версия 7.0 для Windows 2000).
Результаты исследования и обсуждение
1. Общая характеристика пациентов.
В исследование было включено 115 пациентов с нозокомиальными ИМП, находившиеся на стационарном лечении в СОКБ в 2005 – 2008 гг. В связи с тем, что в дальнейшем при обследовании пациентов хотя бы один возбудитель был выделен из мочи у 82 из 115 пациентов (71,3%) для анализа использовались (принимались за 100%) данные по 82 пациентам.
Отрицательный результат культурального исследования мочи у остальных 33 пациентов (28,7%) связан с несколькими причинами. У 7 из 33 (21%) пациентов в ходе обследования был диагностирован абсцесс почки, при этом наблюдалась обструкция мочеточника, дренирующего пораженную почку («блок» почки) что, возможно, и явилось причиной отрицательного результата бактериологического исследования мочи. В остальных 26 случаях отрицательный результат микробиологического исследования мочи мог быть связан с предшествующей антибактериальной терапией.
Распределение обследованных пациентов по нозологическим формам представлено в табл. 1.
Таблица 1. Нозологическая структура ИМП в анализируемой популяции

Таким образом, среди включенных в исследование пациентов 47 пациентов (57,3 %) имели инфекции верхних отделов МВП, а у 35 пациентов (42,7%) отмечались поражения нижних отделов МВП.
В исследование вошли пациенты мужского и женского пола, среди них 66 мужчин и 16 женщин. Развитию внутрибольничных ИМП у 67 пациентов (81%) предшествовало оперативное вмешательство по поводу обструкции МВП. Причиной обструкции у 25 пациентов явилось наличие камней в мочеточнике, у 42 пациентов – доброкачественная гиперплазия предстательной железы (ДГПЖ). Все ИМП являлись осложненными. Минимальный возраст пациентов составил 23 лет, максимальный - 85 лет. Средний возраст пациентов оказался равным 58,5 лет. Рецидивы ИМП в анамнезе отмечались у 33 пациентов (40,2%). 18 пациентов (21,9%) получали антибактериальную терапию по поводу ИМП в течение последних 6 месяцев перед настоящей госпитализацией. На момент развития ИМП у 68 из 82 пациентов был установлен мочевой катетер.
2. Структура выделенных возбудителей ИМП
У 62 пациентов (69,5%) в диагностически значимом титре был выделен 1 микроорганизм из мочи, у 20 пациентов (28%) - 2 возбудителя. Таким образом, в анализ структуры возбудителей и их антибиотикорезистентности были включены 102 штамма.
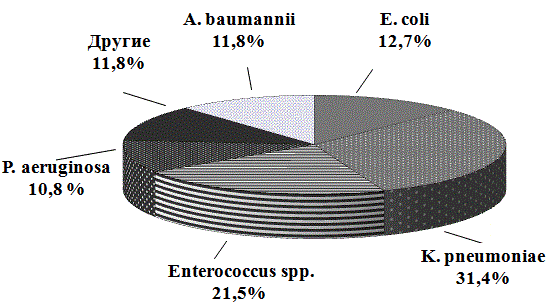
Рис. 1. Структура возбудителей нозокомиальных ИМП
Основными возбудителями оказались представители семейства Enterobacteriaceae. При этом штаммы K. pneumoniae составили 32 штамма (31,4%), E. сoli – 13 штаммов (12,7%) (рис. 1). Другими этиологически значимыми микроорганизмами были Enterococcus spp. – 22 штаммов (21,5%), A. baumannii 12 штаммов (11,8%), P. aeruginosa – 11 штаммов (10,8%).
К группе другие (11,8%) отнесены следующие возбудители: P. mirabilis – 7 штаммов, S. aureus – 3 штамма, Enterobacter spp. – 2 штамма.
По данным литературы энтеробактерии является доминирующим возбудителем как неосложненных, так и осложненных ИМП [3, 5, 6]. Однако, если при неосложненных ИМП кишечная палочка является возбудителем в 90% случаев [5, 8], то при осложненных ИМП, в том числе и при внутрибольничных ИМП, ее доля в структуре возбудителей уменьшается [6]. В тоже время возрастает значение других представителей Enterobacteriaceae, таких микроорганизмов, как клебсиеллы, протеи, энтеробактер [6, 8]. В нашем исследовании доля энтеробактерий составила составила 62,7% (64/102 штаммов), причем основным возбудителем явилась K. pneumoniae (32/102 штаммов).
Из других грамотрицательных микроорганизмов в исследуемой популяции пациентов были выделены 12 штаммов A. baumannii и 11 штаммов P. aeruginosa. Значение этих микроорганизмов также возрастает при внутрибольничных ИМП, выводя их на второе после представителей семейства Enterobacteriaceae место [3, 5, 6]. В данном исследовании все пациенты с ИМП, вызванными A. baumannii и P. aeruginosa, имели оперативное(ые) вмешательство(а) по поводу МКБ или ДГПЖ.
У 22 включенных в анализ пациентов был выделены представители Enterococcus spp., из них 13 штаммов были идетифицированы как E. faecalis, в остальных случаях идентифицировать до вида не удалось. Большинство (74%) пациентов, у которых был выделен из мочи энтерококк, имели в анамнезе рецидивирующие ИМП, и в течение предыдущих 6 месяцев получали антибактериальную терапию по поводу ИМП, 12 из 22 пациентов имели сопутствующую МКБ. Необходимо отметить, что только в 2 случаях E. faecalis был выделен в виде монокультуры, у 20 пациентов Enterococcus spp. выделялся из мочи в диагностически значимом титре в ассоциации с K. pneumoniae и E. сoli.
3. Чувствительность выделенных возбудителей к антибиотикам
Klebsiella pneumoniae
Чувствительность к антимикробным препаратам была определена у 32 штаммов К. pneumoniae. Из всех тестируемых антибиотиков активным в отношении штаммов K. pneumoniae являлся только имипенем, к которому были чувствительны все 100% штаммов. Устойчивость всех выделенных штаммов K. pneumoniae к пенициллинам и цефалоспоринам была обусловлена продукцией БЛРС. Высокая частота БЛРС-продуцирующих бактерий была получена в других рассийских исследованиях [4, 9]. Все штаммы также были резистентны к аминогликозидам и фторхинолонам.
Escherichia coli
Чувствительность к антимикробным препаратам была определена у 13 штаммов E. coli. Все выделенные штаммы (100%) были чувствительны к имипенему и меропенему.
В исследовании была выявлена высокая устойчивость нозокомиальных штаммов E. coli к амоксициллин/клавуланату и цефалоспоринам III-IV поколения (цефотаксиму, цефтазидиму и цефепиму). Резистентными к данным антибиотикам оказались 11 из 13 выделенных возбудителей, что возможно, связано с продукцией ими БЛРС [9].
Из аминогликозидов только к амикацину были чувствительны 38,4% (5/13) штаммов E. сoli. Резистентность к гентамицину составила 100%.
Acinetobacter baumannii.
В данном исследовании чувствительность к антимикробным препаратам была определена у 12 штаммов A. baumannii.
В данном исследовании выявлена 100% устойчивость данного возбудителя к цефепиму и цефтазидиму. К ципрофлоксацину были резистентны 9 из 12 тестированных штаммов, к амикацину – 6/9. Все выделенные штаммы были чувствительны к имипенему.
Pseudomonas aeruginosa
Определялась чувствительность к антимикробным препаратам у 11 штаммов P. aeruginosa. Среди цефалоспоринов III-IV поколения с антисинегнойной активностью наиболее активными был цефтазидим, к которому были чувствительны 5 штаммов. К цефепиму 7 из 11 тестированных штаммов были резистентны. К имипенему были чувствительны 9 выделенных штаммов, у 3 пациентов была выделена P. aeruginosa, устойчивая ко всем тестируемым антиботикам.
Из аминогликозидов самой высокой активностью обладал амикацин – 5 из 11 (45,5%) тестированных штаммов были к нему чувствительны. Все выделенные штаммы были устойчивы к гентамицину. Сходные результаты, свидетельствующие о наибольшей активности амикацина и наименьшей активности гентамицина в отношении P. aeruginosa, получены и в отечественном многоцентровом исследовании [10]. По его результатам к амикацину были нечувствительны всего 6,3% а к гентамицину – 73,9%.
К ципрофлоксацину был чувствителен только 1 штамм P. aeruginosa. В отечественных исследованиях активность фторхинолонов против P. aeruginosa варьировала от 67,2 до 53% [10, 11].
Enterococcus spp
В отношении исследованных штаммов Enterococcus spp. наибольшей активностью обладал ванкомицин. Все штаммы были к нему чувствительны. Из 22 исследованных энтерококков 7 (31,8%) оказались резистентными к ампициллину. К гентамицину и ципрофлоксацину были резистентны 100% возбудителей.
Выводы
1. Основными факторами риска для развития нозокомиальных ИМП является наличие обструкции МВП, постановка катетера, предшествующие эпизоды ИМП и антибиотикотерапии.
2. Наиболее частыми возбудителями нозокомиальных ИМП в урологическом отделении СОКБ является К. pneumoniae (31,5%), Enterococcus spp (21,5%) и E. coli (12,7%).
3. Высокой фармакодинамической активностью в отношении основного возбудителя К. pneumoniae обладает только имипенем. Все возбудители обладали устойчивостью к цефалоспоринам III-IV и аминогликозидам.
4. Препаратами выбора для лечения нозокомиальных ИМВП в урологическом отделении СОКБ являются карбапенемы.
